1. 领域背景与文献引入
文献英文标题:Systems biology approaches in cell signaling research;发表期刊:Genome Biology;影响因子:未公开;研究领域:细胞信号转导(系统生物学方向)。
细胞信号转导是解析细胞感知、整合外界刺激并产生响应的核心领域,其发展历经两个关键阶段:传统生化与分子生物学阶段(20世纪中至末叶)聚焦单个信号分子的结构与功能(如阐明TGFβ受体磷酸化Smad的核转运机制、PKA催化CREB磷酸化的转录调控),为领域积累了坚实的分子基础;21世纪初,高通量技术(全基因组测序、基因表达微阵列、质谱-based蛋白质组学)与计算机技术的同步进步,推动研究视角从“单个分子”转向“信号网络”,系统生物学方法应运而生。当前领域热点包括:多步骤信号级联(如MAPK cascade)的系统级特性(信号传输速度、调控逻辑)、不同生长因子的信号特异性分子基础;未解决的核心问题则是:多步骤级联的信号传输速度优化机制、激活与抑制过程的不对称调控规律、相似生长因子(如EGF与PDGF)引发不同细胞响应的网络差异。在此背景下,本文旨在利用系统生物学方法(定量分析、in silico模拟、大规模蛋白质组学),针对性解答上述问题,为理解细胞信号转导的系统级特性提供新证据。
2. 文献综述解析
作者对细胞信号转导领域的现有研究主要从“通路结构”与“研究尺度”两个维度分类:按通路结构分为“单步骤通路”(如TGFβ-Smad、PKA-CREB,仅一个下游激活步骤)与“多步骤通路”(如MAPK cascade,多激酶依次激活);按研究尺度分为“小尺度传统研究”(聚焦单个分子功能)与“大尺度系统生物学研究”(整合高通量数据解析网络特性)。
现有研究的关键结论包括:传统方法已阐明大量信号分子的基础功能(如TGFβ受体通过磷酸化Smad调控细胞命运、PKA通过CREB调控基因表达);系统生物学方法初步揭示信号网络的整体特性(如多步骤通路的超敏感性可抵抗随机噪声)。现有研究的优势在于:传统方法提供了分子层面的精准知识,系统生物学方法拓展了网络层级的视角;局限性则是:对多步骤级联的信号传输速度优化机制、激活与抑制过程的不对称调控、不同生长因子的信号特异性分子基础仍缺乏深入理解。
本文的创新价值在于,将定量模拟、实验验证与大规模蛋白质组学深度结合:通过in silico模拟与细胞实验解析多步骤级联的调控特性(如激活过程调控信号强度、抑制过程调控时间特性),通过蛋白质组学比较明确EGF与PDGF的信号特异性关键节点(PI3K富集差异),填补了系统层面理解细胞信号转导的空白。
3. 研究思路总结与详细解析
整体框架:研究目标是利用系统生物学方法解析细胞信号转导的两大核心问题——多步骤信号级联的功能特性(信号传输速度、调控规律)与不同生长因子的信号特异性分子基础;核心科学问题包括:多步骤级联的最优步骤数如何随输入强度变化、激活与抑制过程的调控对称性、EGF与PDGF诱导不同分化结果的信号网络差异;技术路线为“in silico模拟→实验验证→大规模蛋白质组学分析”的闭环。
3.1 多步骤信号级联的特性研究
实验目的:探讨多步骤信号级联的信号传输速度优化机制,以及激活与抑制过程的调控差异。
方法细节:首先构建简化的线性激酶-磷酸酶级联in silico模型(模拟MAPK cascade的核心结构,包含未磷酸化激酶A1-A3、磷酸化激活的A1-A3、抑制性的I1-I3),分析不同输入强度下的最优步骤数;同时在NRK成纤维细胞中验证:用EGF刺激细胞,分别加入MEK抑制剂(抑制上游激酶激活)或MAPK磷酸酶(PTP)抑制剂(抑制磷酸酶),通过免疫印迹检测ERK磷酸化的时间course(达峰时间、持续时间)。
结果解读:模拟显示,输入强度越低,多步骤通路的最优步骤数越多(如低输入下多步骤通路的信号传输速度更快);实验验证发现,MEK抑制剂(激活过程抑制)主要降低ERK磷酸化幅度(信号强度),PTP抑制剂(抑制过程抑制)主要延长ERK磷酸化的持续时间(时间特性),且激活与抑制过程存在不对称性——同等程度增加激酶与磷酸酶活性会导致信号强度净增加(文献未明确具体数值,基于实验趋势推测)。文中Figure 1直观呈现了多步骤级联的调控逻辑:
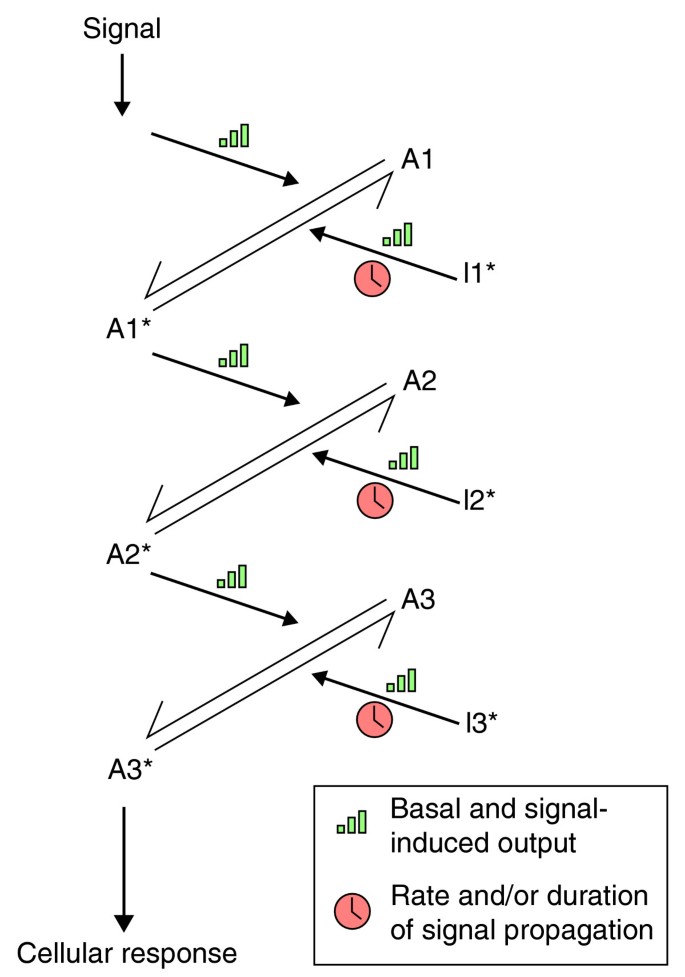
。
产品关联:文献未提及具体实验产品,领域常规使用激酶抑制剂(如MEK抑制剂U0126)、磷酸化特异性抗体(如抗ERK磷酸化抗体)、免疫印迹试剂(如ECL发光液)等。
3.2 EGF与PDGF的信号特异性研究
实验目的:解析人骨髓间充质干细胞(hMSCs)中EGF诱导成骨分化、PDGF不诱导的信号网络差异分子基础。
方法细节:用不同同位素标记的精氨酸(arginine)培养hMSCs,分别用EGF、PDGF或无生长因子刺激;收集细胞裂解液混合后,用抗磷酸酪氨酸抗体免疫纯化酪氨酸磷酸化蛋白及其相互作用伴侣;经胰酶消化后进行质谱分析,通过同位素区分的质谱峰比较不同处理组的蛋白富集水平。
结果解读:质谱分析显示,约90%的酪氨酸磷酸化蛋白在EGF与PDGF刺激下富集水平相似(如MAPK),但PI3K的p85亚基在PDGF刺激组中更富集于磷酸酪氨酸复合物(文献未明确具体富集倍数,基于质谱趋势推测);功能验证发现,用wortmannin抑制PI3K后,PDGF刺激的hMSCs可诱导成骨分化(与EGF组相当),说明PI3K是PDGF抑制成骨分化的关键分子。
产品关联:文献未提及具体实验产品,领域常规使用同位素标记氨基酸(如氘代精氨酸)、抗磷酸酪氨酸抗体(如4G10)、质谱仪(如ESI-MS/MS)等。
4. Biomarker研究及发现成果解析
本文未聚焦传统疾病诊断/预后 Biomarker,而是解析细胞信号转导网络中的关键调控分子(可视为“信号网络 Biomarker”),核心分子包括PI3K(PDGF信号特异性的关键节点)、ERK(MAPK cascade的核心效应分子)。
筛选/验证逻辑:通过大规模蛋白质组学筛选EGF与PDGF刺激下的差异富集分子(PI3K),再通过功能抑制实验(wortmannin抑制PI3K)验证其与细胞分化的功能关联。
研究过程:PI3K的来源是hMSCs细胞裂解液中的磷酸酪氨酸复合物;验证方法包括质谱分析(比较不同处理组的富集水平)与功能抑制实验(检测成骨分化标志物如碱性磷酸酶活性);功能关联:PI3K是PDGF抑制hMSCs成骨分化的关键分子,抑制PI3K后PDGF可模拟EGF的分化效应;创新性:首次用大规模蛋白质组学明确EGF与PDGF的信号差异关键节点,揭示“MAPK通路基础上的PI3K差异”是细胞响应不同生长因子的核心机制。
文献未提供PI3K富集的具体统计数据(如P值、样本量),但功能实验验证了其在信号特异性中的核心作用。
(注:文中图片均来自原文献,已按要求插入对应位置。)
