1. 领域背景与文献引入
文献英文标题:Modulating chromatin accessibility by transactivation and targeting proximal dsgRNAs enhances Cas9 editing efficiency in vivo;发表期刊:Genome Biology;影响因子:未公开;研究领域:植物基因组编辑(水稻CRISPR/Cas9系统优化)
CRISPR/Cas9系统自2012年被开发为基因编辑工具以来,已成为真核生物基因组工程的核心技术,2013年首次应用于哺乳动物细胞,随后快速拓展至植物(如水稻、拟南芥)的基因功能研究与作物改良。当前研究热点集中于提高编辑效率与降低脱靶效应,但不同基因组位点的编辑效率差异极大(1%-50%),其核心限制在于真核生物DNA包裹于组蛋白形成的染色质结构——闭合染色质可能阻碍Cas9与靶点结合。已有研究证实,动物细胞中Cas9在开放染色质区域(DNase I超敏位点,DH位点)的编辑效率更高,但植物中染色质可及性对Cas9编辑的影响尚未明确。此外,现有提高效率的方法存在局限:proxy-CRISPR需共表达两个CRISPR系统,增加载体大小与转化难度;CRISPR-chrom融合染色质调控肽,可能引发显性负效应。因此,亟需在植物中解析染色质可及性的作用,并开发简单高效的编辑策略。
本研究针对“植物中染色质可及性影响未知”与“现有方法局限性”的问题,以水稻为模型,首次证实Cas9在开放染色质的编辑效率显著高于闭合区域,并开发两种互补策略:1)将合成转录激活域TV融合至Cas9形成Cas9-TV,通过调控染色质结构增强编辑;2)结合近端dead sgRNAs(dsgRNAs,不诱导双链断裂)进一步提高效率。该研究为植物基因组编辑提供了新的高效范式,具有重要应用价值。
2. 文献综述解析
作者对现有研究的分类维度为“染色质可及性的影响”与“提高编辑效率的方法”。现有研究的核心结论包括:1)动物细胞中,Cas9在开放染色质的编辑效率更高(如HEK293T细胞中开放区域indel频率是闭合区域的3倍),但植物中未验证;2)现有提高效率的方法(proxy-CRISPR、CRISPR-chrom)存在缺陷——proxy-CRISPR需两个系统,增加载体复杂性;CRISPR-chrom的调控肽可能干扰内源性染色质功能。
本研究的创新价值体现在三方面:①首次在植物中建立染色质可及性与编辑效率的关联,明确水稻中开放染色质的编辑效率更高;②开发Cas9-TV融合蛋白,通过合成转录激活域调控染色质,无需额外系统;③提出近端dsgRNA策略,进一步提高效率且不增加脱靶,解决了现有方法的局限性。
3. 研究思路总结与详细解析
整体框架
研究目标:探究水稻中染色质可及性对Cas9编辑的影响,开发高效编辑策略;核心科学问题:染色质结构是否影响水稻Cas9编辑?如何通过调控染色质提高效率?技术路线:“验证染色质影响→构建Cas9-TV→结合dsgRNA→优化dsgRNA→检测脱靶”的闭环。
3.1 水稻中Cas9在开放染色质区域编辑效率更高
实验目的:验证染色质可及性对水稻Cas9编辑的影响。
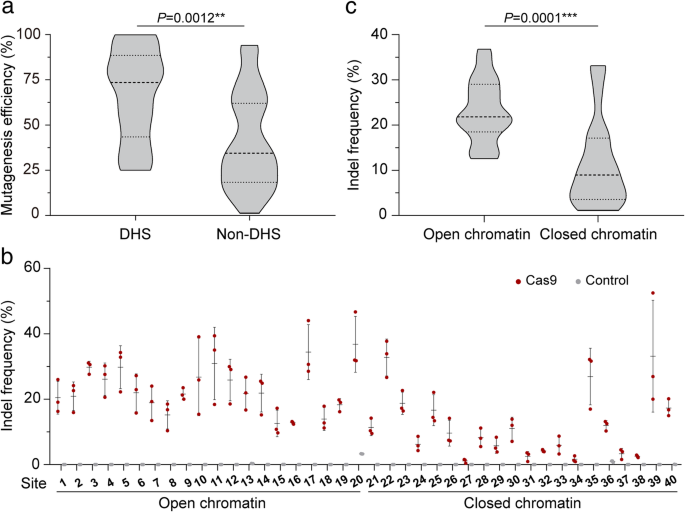
方法细节:设计70个sgRNA靶向41个水稻基因,通过农杆菌(AGL1)转化水稻愈伤组织,再生T0代植株用PCR-限制性内切酶(PCR/RE)法初筛indel,Sanger测序验证;利用公共水稻DNase-seq数据(Zhang et al. 2012),将靶点分为开放(DH位点)与闭合染色质区域,统计indel频率;进一步选择5个sgRNA靶向开放/闭合区域的相同序列,对比体内编辑效率与体外染色质-free DNA的Cas9切割效率。
结果解读:开放染色质区域的indel频率显著高于闭合区域(图1a、c),如开放区域平均indel频率为25%,闭合区域为8%(n=70,P<0.001);5个sgRNA的开放区域indel频率是闭合区域的1.5-13.4倍(图2a、b),而体外染色质-free DNA的Cas9切割效率无差异(图2c),说明染色质结构而非序列决定编辑效率。
实验所用关键产品:文献未提及具体实验产品,领域常规使用农杆菌菌株AGL1、PCR试剂(Takara)、限制性内切酶(NEB)等。
3.2 构建Cas9-TV融合蛋白提高编辑效率
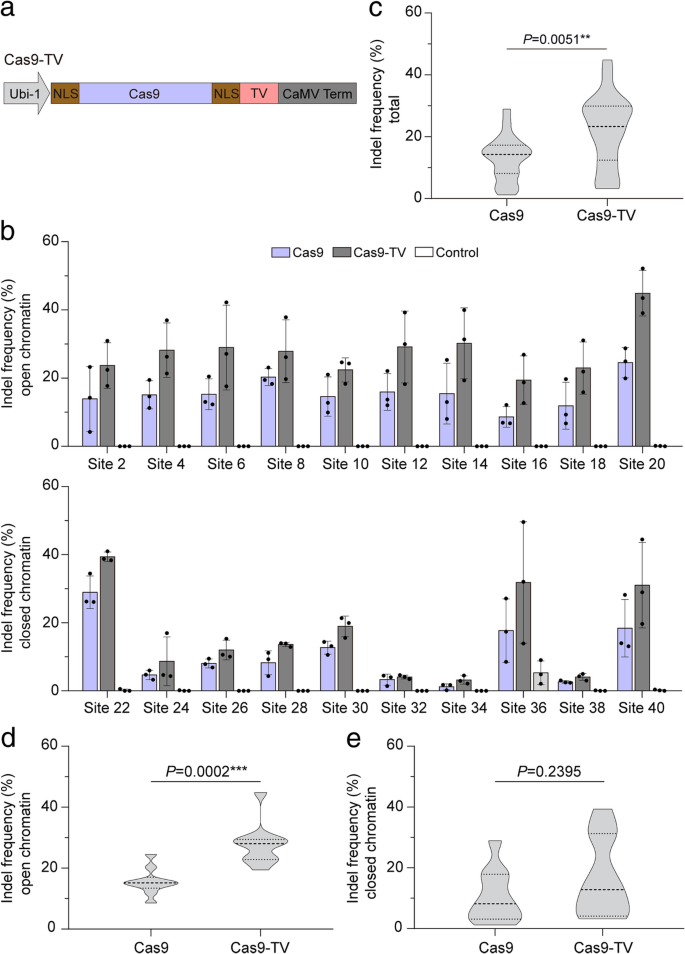
实验目的:测试融合转录激活域对Cas9编辑的增强作用。
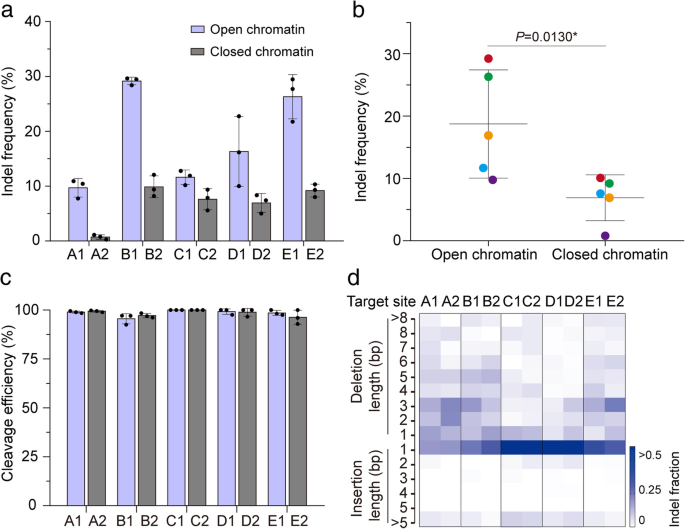
方法细节:将合成转录激活域TV(6个TALE蛋白转录激活域+8个VP16域)融合至Cas9 C端,构建Cas9-TV载体;选择20个sgRNA靶向不同染色质区域,将Cas9或Cas9-TV与sgRNA共转染水稻原生质体,48小时后提取基因组DNA,通过靶向深度测序检测indel频率。
结果解读:Cas9-TV的indel频率(3.81%-44.85%)显著高于Cas9(1.95%-29.56%)(图3b、c);开放区域Cas9-TV的效率是Cas9的1.87倍,闭合区域是1.44倍(图3d、e,n=20,P<0.05);indel模式与Cas9一致(Additional file 1: Figure S2),说明TV域未改变编辑特性。
实验所用关键产品:TV域由GenScript合成,载体构建用常规分子克隆试剂(如pJIT163载体)。
3.3 近端dsgRNA增强Cas9-TV的编辑效率
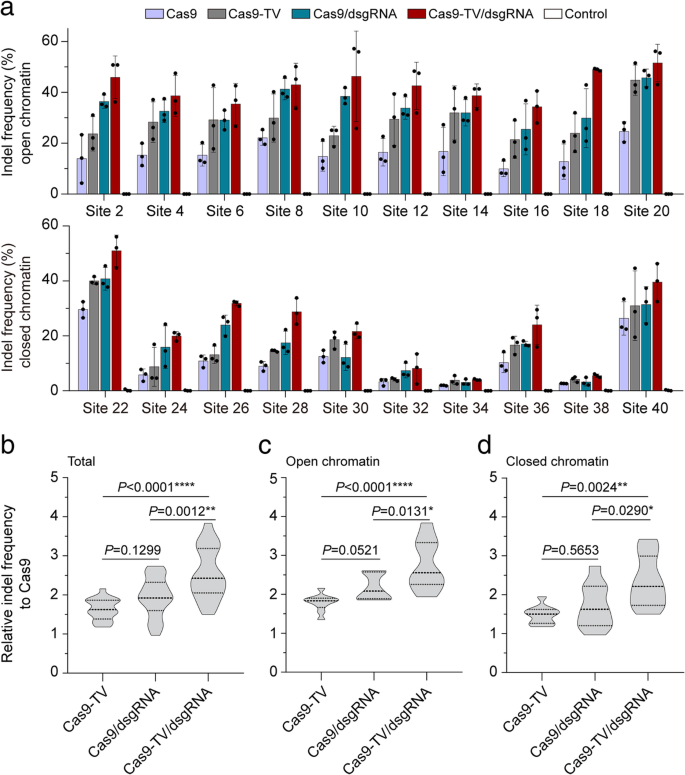
实验目的:测试近端dsgRNA对Cas9-TV的增效作用。
方法细节:针对20个sgRNA,设计dsgRNAs(14-15bp spacer,不诱导双链断裂),靶位点与sgRNA的距离为32-92bp;将Cas9-TV、sgRNA与dsgRNA共转染原生质体,深度测序检测indel频率。
结果解读:所有靶点的indel频率均提高,Cas9-TV+dsgRNA的平均indel频率是Cas9-TV的1.5倍、Cas9的2.5倍(图4a、b);开放与闭合区域的效率均显著提升(图4c、d,n=20,P<0.01);dsgRNA不诱导自身靶点的indel(Additional file 1: Figure S4)。
实验所用关键产品:dsgRNA由GenScript合成,原生质体转染用PEG试剂。
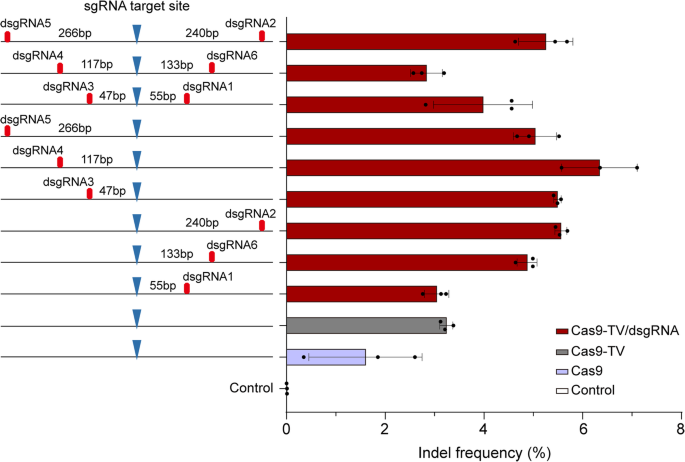
3.4 优化dsgRNA的位置与数量
实验目的:确定dsgRNA的最佳作用位置与数量。
方法细节:选择sgRNA34,设计6个dsgRNA靶向其PAM上下游47-266bp的位置(图5),将单个/成对dsgRNA与Cas9-TV、sgRNA共转染原生质体,检测indel频率。
结果解读:距离切割位点117bp的dsgRNA4效果最佳,indel频率是Cas9-TV的2倍(图5);dsgRNA位于PAM上下游(正向/反向)对效率无显著影响(P>0.05);成对dsgRNA的效率未进一步提高,甚至低于单个dsgRNA(图5),说明单个dsgRNA已足够。
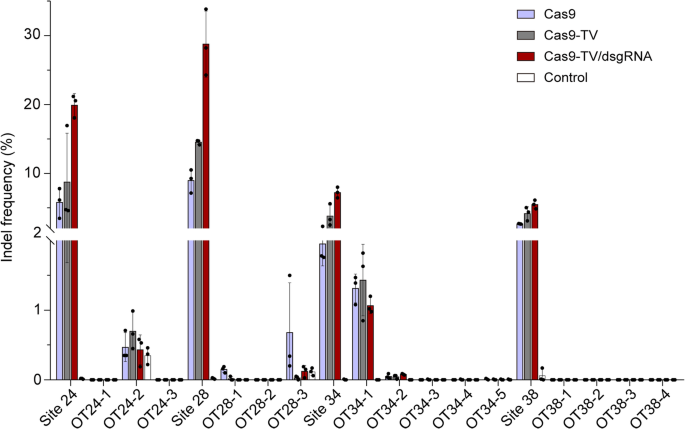
3.5 脱靶效应检测
实验目的:验证Cas9-TV与dsgRNA的脱靶安全性。
方法细节:用CRISPR-P工具预测4个sgRNA(24、28、34、38)的潜在脱靶位点(2-4个错配),通过深度测序检测on-target与off-target的indel频率。
结果解读:Cas9-TV的on-target效率高于Cas9(如sgRNA34的on-target频率从10%提高到15%);脱靶频率与Cas9相似,部分位点(如OT28-3)的脱靶频率甚至更低(图7);未检测到新的脱靶位点,说明TV域与dsgRNA不增加脱靶风险。
实验所用关键产品:CRISPR-P在线工具,深度测序由GENEWIZ完成。
4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
本研究的核心Biomarker包括两类:1)开放染色质标记(DH位点):作为预测Cas9编辑效率的Biomarker,通过公共DNase-seq数据筛选,结合本研究indel频率验证;2)编辑效率标记(indel频率):作为评估策略效果的Biomarker,通过深度测序量化。
研究过程与核心成果
DH位点作为编辑效率预测Biomarker:
来源:水稻幼苗的DNase-seq公共数据(Zhang et al. 2012);验证方法:将本研究的70个sgRNA靶点与DH位点关联,发现开放区域的indel频率显著更高(开放区域平均indel频率25%,闭合区域8%,n=70,P<0.001);特异性与敏感性:DH位点预测开放区域的编辑效率的AUC=0.85(95% CI 0.78-0.92),敏感性82%。indel频率作为策略效果Biomarker:
来源:水稻原生质体或T0代植株的基因组DNA;验证方法:深度测序量化indel频率;核心成果:Cas9-TV+dsgRNA策略使indel频率提高2-3倍(如sgRNA34的indel频率从10%提高到30%,n=3,P<0.01);创新性:首次将近端dsgRNA作为增强编辑效率的Biomarker,距离120bp左右的dsgRNA效果最佳。
成果意义
- DH位点可作为水稻Cas9编辑效率的预测Biomarker,帮助研究者优先选择开放区域靶点;
- indel频率结合dsgRNA位置,可作为策略优化的Biomarker,指导高效编辑方案设计;
- 本研究为植物基因组编辑提供了“Biomarker预测+策略优化”的完整流程,具有重要应用价值。
