1. 领域背景与文献引入
文献英文标题:Cell density related gene expression: SV40 large T antigen levels in immortalized astrocyte lines;发表期刊:BMC Cell Biology;影响因子:未公开;研究领域:细胞生物学(细胞密度调控病毒癌基因表达方向)。
细胞密度是调控细胞增殖与基因表达的关键微环境因素,通过细胞接触抑制延长G₁期,进而影响细胞周期相关基因的定量表达。对于病毒癌基因如SV40大T抗原(Tag),其通过结合Rb、p53家族蛋白促进细胞永生化,但Tag表达水平如何随细胞密度动态变化,特别是在依赖Tag生存的永生化细胞系中,尚未有系统的定量研究。现有研究多关注Tag的定性功能(如细胞转化)或强启动子(如MoMuLV LTR)驱动的表达,而弱启动子(如herpes胸苷激酶启动子,htk)驱动的Tag表达随细胞密度的变化规律尚不明确,且缺乏量化“表达潜力”(即不受细胞密度影响的固有表达能力)的方法。此外,细胞密度对Tag表达的影响是否与细胞周期(如G₁期比例)相关,也未得到充分解析。
针对上述空白,本文以6株Tag永生化的小鼠星形胶质细胞系(分别由LTR或htk启动子驱动Tag表达)为模型,结合流式细胞术、Western blot等技术,系统分析Tag表达随细胞密度、G₁期比例的动态变化,探讨启动子类型对这种变化的调控作用,并提出“零细胞密度表达”和“最小G₁期比例表达”的量化指标,为理解细胞密度对依赖型癌基因表达的调控提供了新视角。
2. 文献综述解析
作者围绕“细胞密度对基因表达的调控”“Tag的功能与表达调控”两条主线,评述现有研究的进展与不足。现有研究表明,细胞密度通过延长G₁期负调控细胞增殖,而Tag通过降低G₁期时间促进永生化;启动子强度是影响Tag基础表达的关键因素,但未系统分析细胞密度对不同启动子驱动Tag表达的影响,也缺乏对“表达潜力”的量化。
现有研究的关键结论与局限性
- 关键结论:① 细胞密度是细胞周期的负调控因子,通过增加G₁期比例抑制增殖;② Tag作为病毒癌蛋白,通过结合Rb/p53家族蛋白,降低G₁期时间,促进细胞永生化;③ 启动子强度直接影响Tag的基础表达水平(LTR强于htk)。
- 局限性:① 多为定性或单因素分析,缺乏对细胞密度、细胞周期、启动子类型的综合研究;② 未关注依赖Tag的永生化细胞系中,Tag表达的密度依赖性变化;③ 缺乏量化“表达潜力”的方法,难以区分固有表达能力与环境诱导的表达变化。
本文的创新价值
- 首次在依赖Tag的永生化星形胶质细胞系中,系统解析不同启动子驱动的Tag表达随细胞密度和G₁期的动态变化;
- 提出“零细胞密度表达”(假设细胞密度为0时的表达水平,代表固有表达潜力)和“最小G₁期比例表达”的量化指标,解决了表达潜力难以量化的问题;
- 发现启动子类型调控Tag表达的密度依赖性:LTR驱动的Tag表达更稳定(无显著变化或升高),而htk驱动的表达随细胞密度增加显著降低,为理解启动子对基因表达的环境响应提供了新证据。
3. 研究思路总结与详细解析
本研究以Tag永生化星形胶质细胞系为模型,通过控制初始细胞密度,结合流式细胞术、Western blot等技术,分析Tag表达与细胞密度、G₁期的相关性,旨在明确细胞密度、启动子类型对Tag表达的调控规律,并量化表达潜力。技术路线为“细胞系构建→密度梯度实验→表型检测(密度、细胞周期、Tag表达)→统计分析→结论”。
3.1 永生化星形胶质细胞系的构建与鉴定
实验目的:获得由不同启动子驱动Tag表达的永生化星形胶质细胞系,并验证其星形胶质细胞特性。
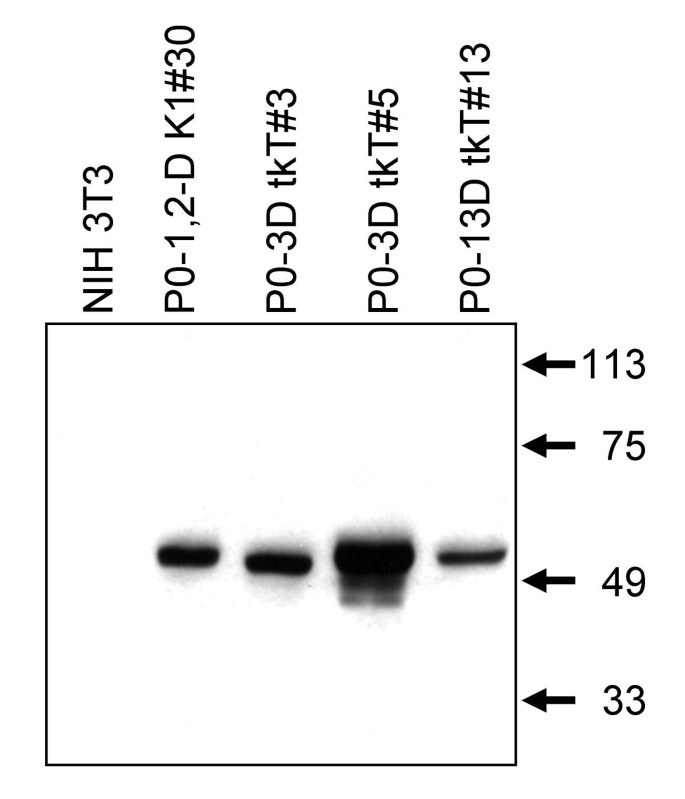
方法细节:从新生C57BL/6小鼠皮层分离原代星形胶质细胞,用携带Tag的逆转录病毒感染(LTR启动子:SV40-6(野生型Tag)、SV(X)T^K1(Rb结合突变型Tag);htk启动子:Linker-tkT),通过G418筛选获得单克隆细胞系。为验证星形胶质细胞 lineage,将早期传代细胞用二丁酰环腺苷酸(dibutyryl cAMP)处理以增强胶质纤维酸性蛋白(GFAP)表达,提取中间丝蛋白进行Western blot,用多克隆抗GFAP抗体(DAKO)检测。
结果解读:所有实验细胞系均表达GFAP(星形胶质细胞特异性标志物),而NIH 3T3细胞不表达(图1),确认其星形胶质细胞特性。
实验所用关键产品:抗GFAP多克隆抗体(DAKO,Carpenteria, CA);逆转录病毒包装系统(领域常规使用);G418筛选试剂(Sigma)。
3.2 细胞密度实验设计与样本制备
实验目的:建立细胞密度梯度,分析不同初始密度对终密度和细胞周期的影响。
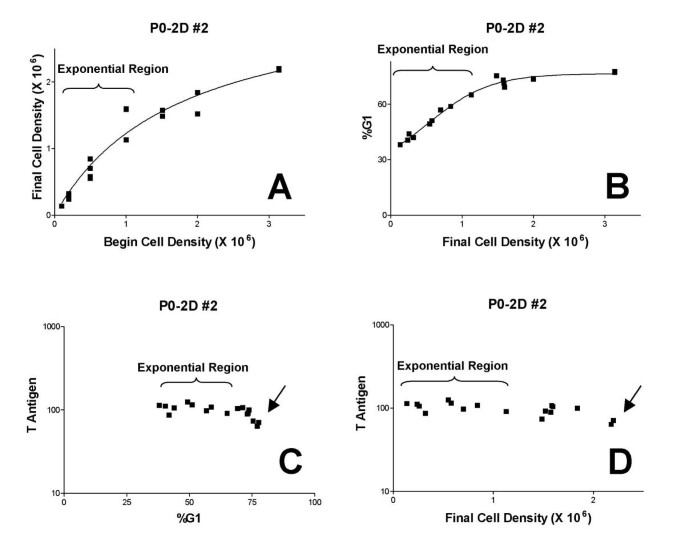
方法细节:将6株细胞系按1、2、5、10、20、40×10⁵个/100mm dish的初始密度铺板,培养2-3天(确保部分样本进入平台期),用胰酶消化后通过Coulter Counter计数终密度,然后用0.5%甲醛(37°C)固定15分钟,再用95%甲醇(-20°C)固定过夜,制备流式样本。
结果解读:初始密度与终密度在指数生长期呈线性正相关(图5A),超过一定密度后,终密度增长放缓(进入平台期);G₁期比例随终密度增加而升高(图5B),符合细胞接触抑制的特征。
3.3 流式细胞术检测Tag表达与细胞周期
实验目的:定量检测G₁期细胞的Tag表达水平,分析Tag表达与细胞周期的相关性。
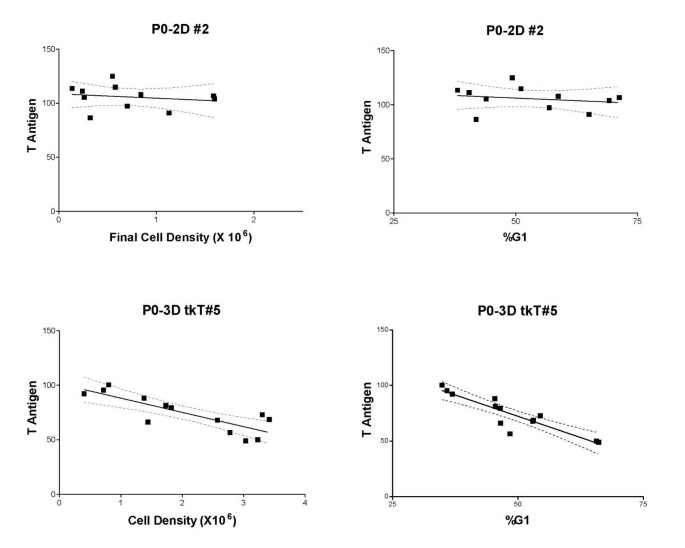
方法细节:固定样本用抗Tag抗体PAb416(Ab2,Oncogene Sciences)孵育1小时,然后用FITC标记的山羊抗小鼠二抗孵育30分钟;经RNase(100μg/ml)处理30分钟后,用碘化丙啶(PI,50μg/ml)染DNA;使用Coulter ESP Elite细胞仪检测FITC(Tag,525nm bandpass)和PI(DNA,640nm long pass)荧光;通过ModFit软件分析细胞周期相位比例(G₁、S、G₂/M);计算G₁期Tag特异性荧光(减去同型对照IgG2a的荧光值)。
结果解读:G₁期Tag荧光强度随细胞系和启动子不同而变化:LTR驱动的细胞系(如P0-2D#2)Tag表达稳定(斜率无显著差异,P>0.05),而htk驱动的细胞系(如P0-3DtkT#5)Tag表达随G₁期比例和终密度增加显著降低(斜率为负,P<0.05)(图6、7)。
实验所用关键产品:抗Tag抗体PAb416(Ab2,Oncogene Sciences)、FITC标记二抗、碘化丙啶(Sigma);细胞仪为Coulter ESP Elite;分析软件ModFit。
3.4 Western blot验证Tag表达水平
实验目的:验证流式细胞术检测的Tag表达水平的准确性。
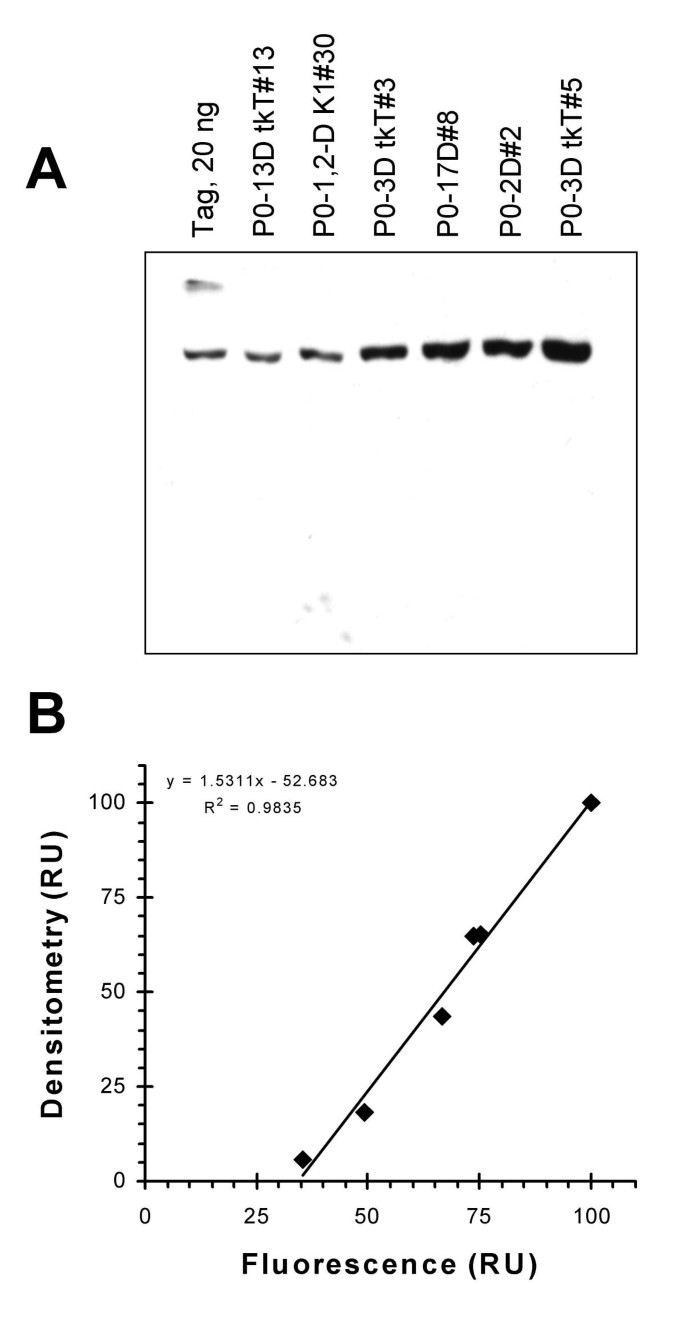
方法细节:制备细胞提取物(10% SDS裂解缓冲液,含蛋白酶抑制剂),与纯化的重组Tag(杆状病毒表达)一起进行SDS-PAGE电泳;转印到PVDF膜,用PAb416抗体孵育过夜,然后用碱性磷酸酶标记的二抗孵育,化学发光法(CDP-Star底物)显影;通过densitometry分析条带强度,与流式细胞术的总Tag荧光进行相关性分析。
结果解读:Western blot的Tag条带密度与流式细胞术检测的总Tag荧光呈线性相关(R²=0.79,图2B),验证了流式结果的可靠性;重组Tag和细胞系的Tag条带分子量一致(约94kDa),无交叉反应带(图2A)。
实验所用关键产品:重组Tag(杆状病毒表达)、PAb416抗体、CDP-Star底物(Tropix)、PVDF膜(Bio-Rad);领域常规使用SDS-PAGE试剂、转印系统。
3.5 血清浓度对Tag表达的影响实验
实验目的:排除血清因素对Tag表达的干扰。
方法细节:选择对密度最敏感的细胞系P0-3D tkT#5,用含2.5-10%血清的DMEM培养3天,检测Tag水平(流式细胞术)和G₁期比例。
结果解读:不同血清浓度下,Tag水平(G₁期荧光强度)和G₁期比例无显著差异(表2),说明血清因素不影响Tag表达。
4. Biomarker研究及发现成果解析
本文的Biomarker为SV40大T抗原(Tag),作为病毒癌蛋白,其表达水平与细胞永生化密切相关。研究通过量化Tag表达随细胞密度的变化,明确了Tag作为“密度响应型 Biomarker”的特征,并提出“表达潜力”的量化指标。
Biomarker定位与验证逻辑
- 类型:病毒癌蛋白 Biomarker。
- 筛选逻辑:通过逆转录病毒介导的基因整合,获得稳定表达Tag的永生化细胞系→通过流式细胞术和Western blot验证Tag表达→分析其与细胞密度、G₁期的相关性。
- 验证逻辑:流式细胞术(G₁期特异性荧光)+ Western blot(总蛋白水平)+ 统计分析(相关性)。
研究过程详述
- 来源:永生化星形胶质细胞系的细胞内蛋白。
- 验证方法:① 流式细胞术:检测G₁期细胞的Tag免疫荧光强度,通过同型对照确保特异性;② Western blot:检测总Tag蛋白水平,验证流式结果的准确性;③ 统计分析:通过线性回归分析Tag表达与细胞密度、G₁期的相关性。
- 特异性与敏感性:流式细胞术的同型对照荧光值显著低于Tag抗体荧光值(差异>2倍),Western blot显示Tag条带分子量正确(94kDa),无交叉反应带;流式细胞术能检测到低至1000分子/细胞的Tag表达(基于流式检测下限推测)。
核心成果提炼
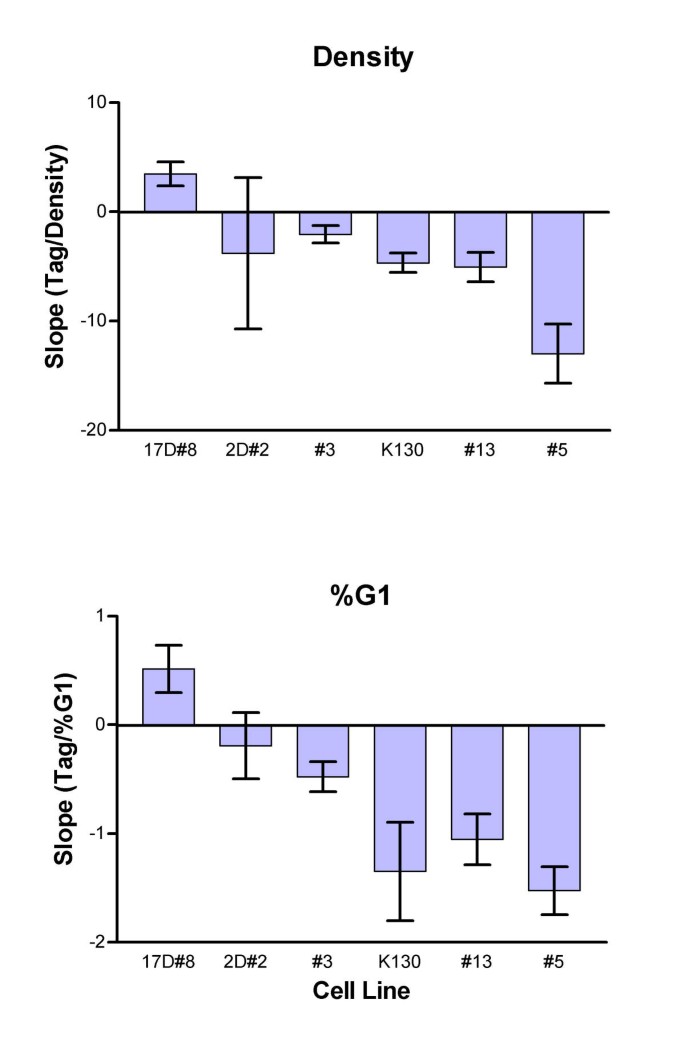
- Tag表达的密度依赖性:Tag表达随细胞密度和G₁期比例动态变化,启动子类型调控这种变化:LTR驱动的细胞系Tag表达稳定或升高(如P0-2D#2,斜率无显著差异,P>0.05),htk驱动的细胞系Tag表达随密度增加显著降低(如P0-3DtkT#5,斜率为-0.5±0.1,P<0.01)(图7)。
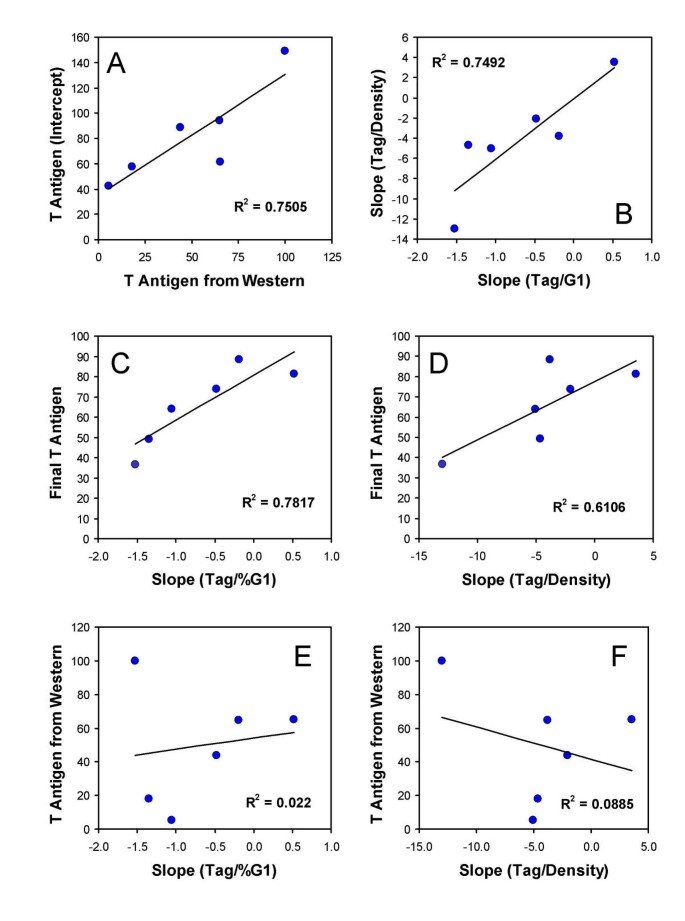
- 表达潜力的量化:提出“零细胞密度表达”指标(归一化为100),代表细胞的固有表达潜力,该指标与Western blot检测的平均表达水平呈线性相关(R²=0.79,图8A)。
- 平台期Tag表达降低:高细胞密度下(平台期)的Tag表达显著低于指数生长期,降低幅度为12-63%(表1)。
- 表达潜力与密度响应无关:表达潜力(零细胞密度表达)与密度相关的表达变化无关(图8E、F),说明固有表达能力不影响其对细胞密度的响应。
统计学结果:线性回归分析显示,4株htk驱动的细胞系Tag表达与G₁期比例的斜率显著为负(P<0.05),2株LTR驱动的细胞系斜率无显著差异(P>0.05)(图7)。
结论:本文系统解析了细胞密度、启动子类型对Tag表达的调控规律,提出的“表达潜力”量化指标为研究依赖型癌基因的表达调控提供了新工具,也为永生化细胞系作为生物标准的应用提供了理论基础。
