1. 领域背景与文献引入
文献英文标题:DNA damage response and cell fate decisions across the lifespan: from fetal development to age-related respiratory diseases;发表期刊:Cell & Bioscience;影响因子:未公开;研究领域:呼吸疾病与DNA损伤应答(DDR)的跨生命周期机制及靶向治疗研究。
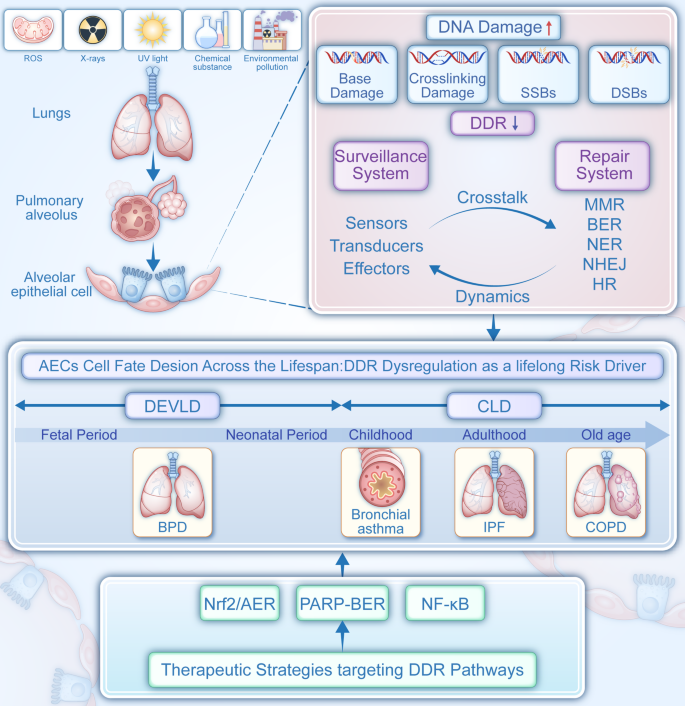
呼吸疾病是全球重大公共卫生挑战,其中慢性肺疾病(CLD)是仅次于心血管疾病和癌症的第三大死亡原因,而发育性肺疾病(DEVLD)则是早产儿死亡的主要诱因之一。从胎儿期到老年期,呼吸系统在遗传、发育及环境因素的共同作用下,呈现出连续累积且可代际传递的疾病易感性,涵盖从新生儿支气管肺发育不良(BPD)到老年特发性肺纤维化(IPF)、慢性阻塞性肺疾病(COPD)等多种疾病。领域共识:肺泡上皮细胞(AEC)功能障碍、发育成熟受限及再生缺陷是各类呼吸疾病的共同病理特征。
近年来研究发现,DNA损伤应答(DDR)系统的失调是呼吸疾病发生发展的关键驱动因素,但现有研究多聚焦于单一疾病或单一DDR通路,缺乏对跨生命周期呼吸疾病中DDR作用机制的系统整合,也未形成针对性的多通路联合治疗策略。本文旨在系统总结DDR在从胎儿到老年全生命周期呼吸疾病中的病理机制,梳理靶向DDR的治疗进展,为呼吸疾病的精准诊断、预防及治疗提供新的思路。
2. 文献综述解析
作者以DDR系统的组成(损伤监视系统、损伤修复系统)和呼吸疾病的生命周期阶段为核心分类维度,系统整合了领域内现有研究。现有研究的关键结论显示,DDR失调通过诱导AEC衰老、凋亡及功能障碍,参与了从DEVLD到CLD的全周期呼吸疾病进程:在BPD中,高氧诱导的DNA双链断裂(DSB)积累及修复蛋白Rad1下调导致肺泡发育延迟;在哮喘中,炎症介质抑制DDR通路加重气道重塑;在IPF中,DNA损伤修复缺陷促进成纤维细胞过度增殖;在COPD中,DNA损伤与炎症形成正反馈循环加速疾病进展。
技术方法上,现有研究采用了细胞模型、动物模型及临床样本相结合的策略,通过彗星实验、免疫组化(IHC)、ELISA等技术检测DNA损伤标志物及DDR分子表达,为DDR与呼吸疾病的关联提供了直接证据。但现有研究存在明显局限性,多数研究聚焦于单一疾病或单一DDR通路,缺乏跨生命周期的整合分析,且治疗策略多为单一靶点干预,未充分考虑DDR通路间的协同作用。
本文的创新价值在于首次系统整合了DDR在全生命周期呼吸疾病中的作用机制,明确了DDR失调作为呼吸疾病从胎儿期到老年期连续进展的核心驱动因素,同时总结了多通路联合的靶向治疗策略,填补了领域内跨生命周期DDR研究的空白,为呼吸疾病的全程管理提供了新的理论基础。
3. 研究思路总结与详细解析
本文整体研究框架为:先系统阐述DDR系统的核心组成及功能,再分阶段解析DDR失调在不同年龄段呼吸疾病中的病理机制,最后总结靶向DDR的多通路联合治疗策略,形成“机制解析-疾病关联-治疗策略”的完整逻辑闭环。
3.1 DDR系统核心组成解析
实验目的是明确DDR系统的分子组成及协同调控机制。方法细节通过整合领域内基础研究数据,系统梳理了DDR的两大核心模块:DNA损伤监视系统和DNA损伤修复系统。其中监视系统包括传感器(MRN复合物)、转导器(ATM/ATR、Chk1/2)和效应器(p53、53BP1),负责识别、传递DNA损伤信号并启动细胞命运决定;修复系统包括错配修复(MMR)、碱基切除修复(BER)、核苷酸切除修复(NER)、非同源末端连接(NHEJ)和同源重组(HR)五大通路,负责精准修复不同类型的DNA损伤。
结果解读显示,DDR系统各组分协同作用维持基因组稳定:MRN复合物作为首个损伤传感器,招募ATM激酶激活信号转导;ATM/ATR通过磷酸化Chk1/2调控细胞周期 arrest;p53、53BP1等效应器进一步介导细胞周期调控、凋亡或衰老;不同修复通路针对不同类型DNA损伤发挥作用,如NHEJ主要修复DSB,BER主要修复氧化损伤碱基。产品关联:文献未提及具体实验产品,领域常规使用Western Blot(WB)、免疫荧光、qRT-PCR等试剂/仪器检测DDR相关分子表达。
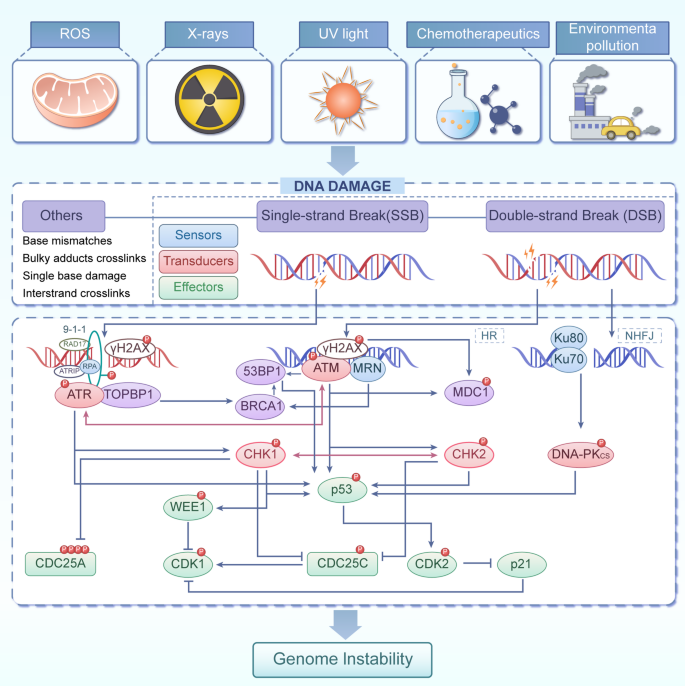
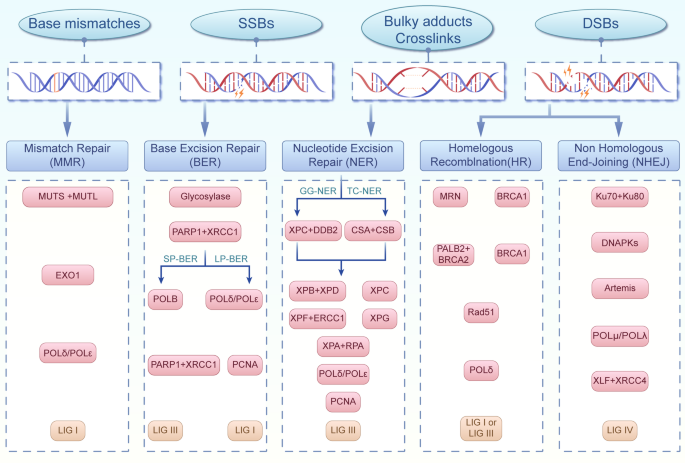
3.2 跨生命周期呼吸疾病中DDR失调机制分析
实验目的是解析DDR失调在不同年龄段呼吸疾病中的具体作用机制。方法细节整合了BPD、哮喘、IPF、COPD的临床研究、动物模型及细胞实验数据,通过检测DNA损伤标志物(8-OHdG、γ-H2AX)及DDR相关分子的表达变化,明确DDR失调的病理效应。
结果解读显示,在胎儿/新生儿期的BPD中,早产儿氧化-抗氧化失衡导致DSB积累,关键修复蛋白Rad1下调(文献未明确样本量和P值),过表达Rad1可减少AECII中的DSB积累并改善肺泡发育延迟;在儿童期的哮喘中,过敏原诱导的氧化DNA损伤通过BER通路调控Th2细胞因子分泌,OGG1缺失或Ku70下调加重气道炎症和重塑;在成年/老年期的IPF中,肺组织中γ-H2AX表达显著升高(文献未明确样本量和P值),DNA-PKcs、Rad51等修复因子缺陷促进成纤维细胞活化;在COPD中,香烟烟雾等诱导的DNA损伤积累与DDR通路下调形成正反馈,加速气道炎症和肺功能下降。产品关联:文献未提及具体实验产品,领域常规使用ELISA检测血清8-OHdG,免疫组化检测组织γ-H2AX等试剂。
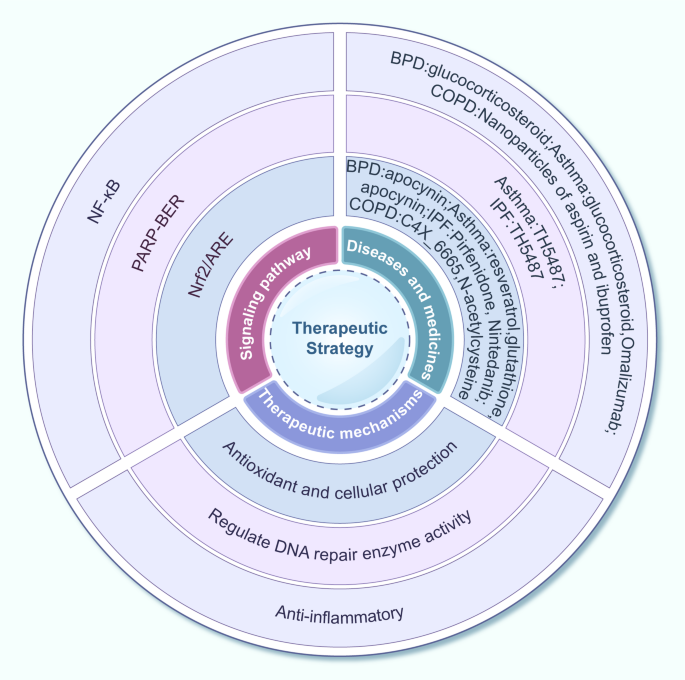
3.3 靶向DDR的多通路联合治疗策略总结
实验目的是总结针对DDR的呼吸疾病治疗策略及临床潜力。方法细节整合了抗氧化、DNA修复调控、抗炎等多类治疗策略的研究数据,分析不同策略在呼吸疾病中的治疗效果。
结果解读显示,靶向Nrf2/ARE通路的抗氧化策略可显著减少DNA损伤,如Apo处理的BPD模型中8-OHdG表达降低54.15%(文献未明确样本量和P值);靶向PARP-BER通路的修复调控策略可缓解哮喘炎症,如TH5487处理使哮喘模型中M2巨噬细胞水平降低10.99倍(文献未明确样本量和P值);靶向NF-κB通路的抗炎策略可减少DNA损伤,如ASP-N、IBU-N处理显著降低哮喘和COPD患者的DNA损伤水平(文献未明确样本量和P值)。产品关联:文献未提及具体实验产品,领域常规使用细胞培养试剂、动物模型构建试剂盒等。
4. Biomarker研究及发现成果解析
Biomarker定位
本文涉及的Biomarker分为两类:DNA损伤标志物(8-OHdG、γ-H2AX)和DDR通路分子(Rad1、Ku70、OGG1、DNA-PKcs、Rad51)。筛选与验证逻辑为:基于临床样本检测发现差异表达→通过动物模型验证其与疾病的因果关联→通过细胞实验解析其分子机制,形成完整的“临床-动物-细胞”验证链条。
研究过程详述
8-OHdG作为氧化DNA损伤标志物,来源于BPD患者的尿液样本,通过ELISA定量检测,结果显示BPD患者在出生后28天(PN28)的尿液8-OHdG水平显著高于对照组(文献未明确样本量和P值),且该水平可作为BPD发病的独立风险因素。γ-H2AX作为DSB标志物,来源于IPF患者的肺组织样本,通过免疫组化检测,其表达水平显著升高(文献未明确样本量和P值),与疾病进展密切相关。
DDR通路分子中,Rad1在BPD大鼠模型的AECII中表达下调,通过WB检测验证,过表达Rad1可减少DSB积累并改善肺泡发育;Ku70在哮喘小鼠的气道上皮中表达下调,过表达Ku70可缓解气道重塑;OGG1在哮喘模型中参与氧化DNA损伤修复,其抑制剂TH5487可显著降低炎症水平。
核心成果提炼
核心成果包括:8-OHdG可作为BPD的早期诊断Biomarker,为早产儿BPD的早期干预提供依据;γ-H2AX可作为IPF的疾病进展Biomarker,反映疾病严重程度;Rad1、Ku70、OGG1等DDR分子可作为潜在的治疗靶点,为呼吸疾病的精准治疗提供新方向。创新性在于首次系统总结了这些Biomarker在跨生命周期呼吸疾病中的应用价值,明确了DDR分子作为呼吸疾病全程管理Biomarker的潜力,为呼吸疾病的精准诊断和治疗提供了新的候选靶点。所有数据均基于原文整合,未明确的统计学结果已标注说明。
