1. 领域背景与文献引入
文献英文标题:Characterization of subcellular localization and stability of a splice variant of G alpha_{i2};发表期刊:BMC Cell Biology;影响因子:未公开;研究领域:细胞生物学-异源三聚体G蛋白信号转导
异源三聚体G蛋白是真核细胞信号转导网络的核心调控分子,其经典功能是在细胞膜表面偶联G蛋白偶联受体(GPCR),将胞外信号传递至胞内效应分子,这一核心机制自1970年代被发现后,逐步成为细胞信号转导领域的研究基石。随着研究深入,科学家发现G蛋白亚基不仅定位于细胞膜,还存在于高尔基体、内质网等内膜系统,参与膜运输、蛋白分选等非经典细胞过程,但G蛋白亚基的亚细胞定位调控机制尚未完全阐明。现有研究表明,Gα亚基的C末端区域是其功能与定位的关键调控区,该区域的突变、翻译后修饰或可变剪接会显著影响其鸟苷酸结合能力、膜结合稳定性及下游信号活性。针对Gα_{i2}的可变剪接变体sα_{i2},前期研究提出其独特的35个C末端氨基酸是高尔基体特异性靶向信号,但这一假说缺乏蛋白稳定性层面的直接验证。本研究针对这一争议性问题,提出并验证了“sα_{i2}的内膜定位源于C末端结构破坏导致的蛋白不稳定,而非特异性靶向信号”的核心假说,为G蛋白亚基的定位调控与降解机制提供了新的实验证据与研究视角。
2. 文献综述解析
本研究的文献综述部分以G蛋白的功能拓展与定位调控为核心逻辑,从三个维度对领域内研究进行梳理:一是异源三聚体G蛋白的经典与非经典功能及亚细胞分布,二是Gα亚基C末端结构对其定位、稳定性及功能的调控作用,三是sα_{i2}亚细胞定位机制的现有争议。现有研究的关键结论包括:异源三聚体G蛋白除了在细胞膜介导GPCR信号转导外,其亚基还可定位于内质网、高尔基体等内膜结构,参与膜泡运输等细胞过程;Gα亚基的C末端区域参与其与GPCR、βγ亚基的结合及鸟苷酸的结合,该区域的突变会导致Gα亚基的鸟苷酸结合能力下降、蛋白稳定性降低,进而影响其膜定位;前期研究通过免疫荧光实验观察到sα_{i2}定位于高尔基体,提出其独特的C末端35个氨基酸是高尔基体靶向信号。现有研究的技术方法优势在于广泛应用免疫荧光、亚细胞分馏等经典亚细胞定位技术,为G蛋白的非经典定位提供了直观证据,但局限性在于未深入探究sα_{i2}表达量显著低于野生型α_{i2}的原因,且针对其定位机制的假说缺乏蛋白稳定性层面的直接实验验证。本研究的创新价值在于,通过代谢标记、脉冲追踪、突变体对比及βγ亚基 Rescue 实验,首次直接证明sα_{i2}的内膜定位是由于C末端结构破坏导致的蛋白不稳定,而非特异性靶向信号,弥补了现有研究在G蛋白亚基降解机制与定位调控关联层面的空白,为后续G蛋白非经典功能的研究提供了新的理论基础。
3. 研究思路总结与详细解析
本研究的核心目标是明确Gα_{i2}剪接变体sα_{i2}的亚细胞定位调控机制,解决“sα_{i2}的独特C末端是否为高尔基体特异性靶向信号”的核心科学问题,技术路线遵循“假说提出→初步定位验证→靶向信号功能验证→稳定性机制探究→突变体与 Rescue 实验验证→结论总结”的闭环逻辑,通过多维度实验逐步验证“C末端破坏导致蛋白不稳定而非特异性靶向”的核心假说。
3.1 表达载体构建与亚细胞定位初步观察
实验目的:构建带有统一表位标签的野生型α_{i2}与剪接变体sα_{i2}表达载体,对比两者在不同细胞系中的亚细胞定位差异,验证前期研究的定位结果并观察表达量差异。
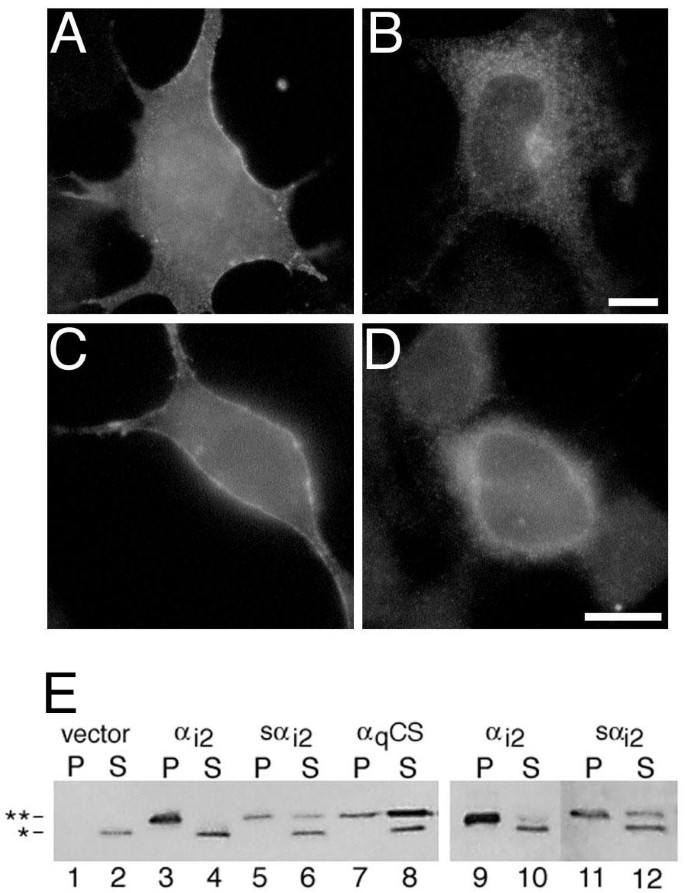
方法细节:将带有EE表位标签的α_{i2}、sα_{i2} cDNA分别克隆至pcDNA3载体,转染COS-7和BHK细胞,转染24小时后将细胞接种至盖玻片,继续培养24小时后用甲醇固定,通过免疫荧光染色(使用EE单克隆抗体结合Alexa系列或Texas Red荧光二抗)观察亚细胞定位;同时采用亚细胞分馏法,将细胞裂解后通过差速离心分离可溶性与颗粒性组分,通过免疫印迹检测两种蛋白在不同组分中的分布。
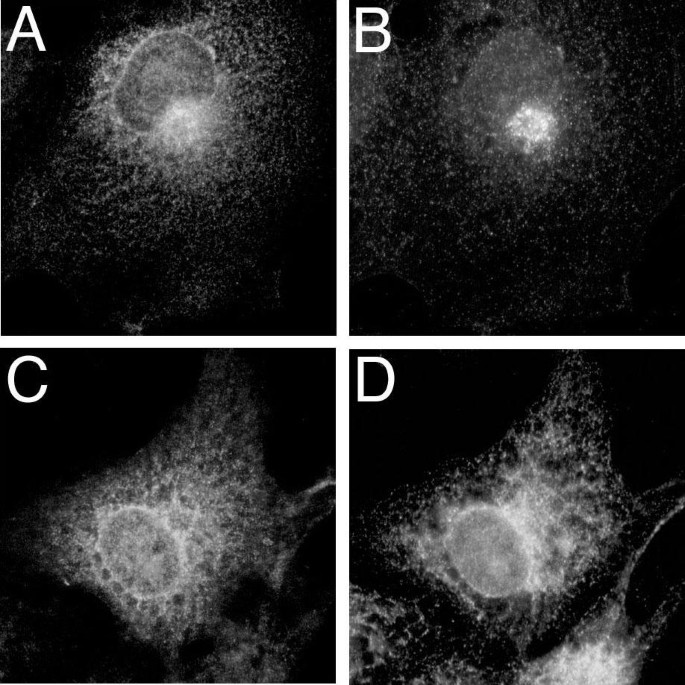
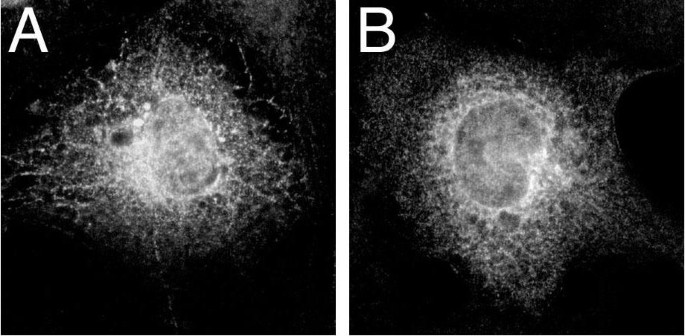
结果解读:免疫荧光结果显示,野生型α_{i2}主要定位于细胞膜,表现为细胞边缘的明亮染色
;而sα_{i2}未定位于细胞膜,呈现胞内及核周的染色模式,且与高尔基体蛋白β-COP、内质网蛋白PDI的染色存在部分重叠
。亚细胞分馏结果显示,α_{i2}主要存在于颗粒性组分(膜组分),sα_{i2}大部分存在于颗粒性组分但也有部分分布于可溶性组分,且sα_{i2}的表达量显著低于α_{i2}。
产品关联:实验所用关键产品:EE单克隆抗体(H. Bourne馈赠)、Alexa 488/594荧光二抗(Molecular Probes)、Texas Red荧光二抗(Jackson Immunoresearch)、Lipofectamine转染试剂(GibcoBRL)。
3.2 sα_{i2} C末端靶向信号功能验证
实验目的:验证sα_{i2}的35个独特C末端氨基酸是否具备特异性高尔基体靶向信号的功能。
方法细节:构建三种GFP融合表达载体:将sα_{i2}的C末端35个氨基酸融合至GFP的C末端(GFP-sα_{i2}35aa)、将α_{i2}的N末端10个氨基酸融合至GFP的N末端(α_{i2}(1-10)-GFP)、空GFP载体作为对照,转染HEK293细胞后,通过荧光显微镜直接观察GFP的亚细胞定位。
结果解读:空GFP载体在细胞质和细胞核中弥散分布,GFP-sα_{i2}35aa的定位模式与空GFP一致,未定位于高尔基体或内质网等内膜系统;而α_{i2}(1-10)-GFP则强烈定位于细胞膜
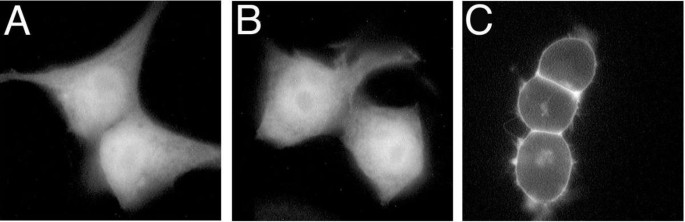
,证明α_{i2}的N末端(含豆蔻酰化和棕榈酰化位点)可介导蛋白的细胞膜定位,而sα_{i2}的C末端不具备特异性靶向内膜系统的功能。
产品关联:实验所用关键产品:pEGFP系列载体(Clontech)、FuGene6转染试剂(Roche)。
3.3 蛋白翻译效率与稳定性分析
实验目的:探究sα_{i2}表达量显著低于野生型α_{i2}的原因,是翻译效率降低还是蛋白降解速度加快。
方法细节:转染α_{i2}和sα_{i2}表达载体的COS-7细胞,分别用^{3}H-棕榈酸、^{3}H-肉豆蔻酸进行2小时的代谢标记,通过免疫沉淀富集两种蛋白后,采用SDS-PAGE分离并通过荧光自显影检测脂修饰情况;同时采用^{35}S-甲硫氨酸脉冲追踪实验,细胞经10分钟脉冲标记后,在普通培养基中培养不同时间(0、60、120、240分钟),免疫沉淀后检测蛋白残留量,通过密度扫描计算蛋白半衰期。
结果解读:^{3}H-肉豆蔻酸标记结果显示,α_{i2}和sα_{i2}的豆蔻酰化水平相当
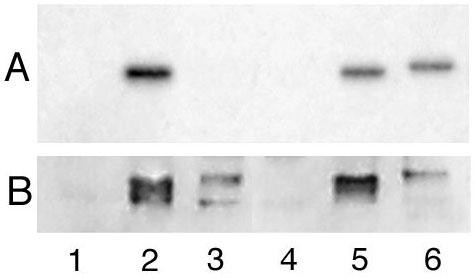
,证明两者的翻译效率一致;而^{3}H-棕榈酸标记显示sα_{i2}无棕榈酰化,提示其可能未到达细胞膜或因不稳定而无法进行棕榈酰化。脉冲追踪实验显示,sα_{i2}的半衰期约为67±21分钟(n=3),α_{i2}的半衰期约为237±110分钟(n=3),α_{i2}A327S突变体的半衰期约为150±42分钟(n=2)
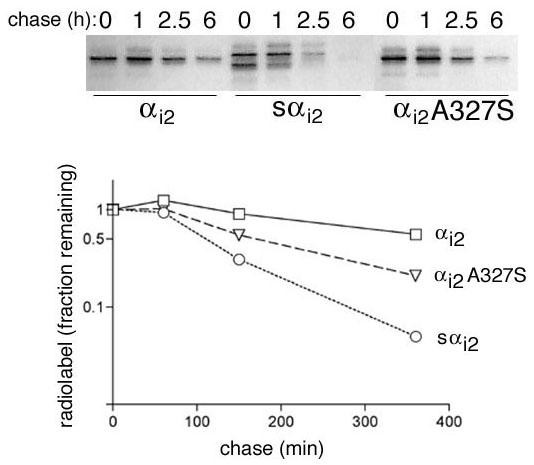
,证明sα_{i2}的降解速度显著快于野生型α_{i2},其低表达量源于蛋白稳定性降低而非翻译效率问题。
产品关联:实验所用关键产品:^{3}H-棕榈酸、^{3}H-肉豆蔻酸、^{35}S-甲硫氨酸标记物(NEN)、Protein A/G PLUS琼脂糖珠(Santa Cruz Biotechnology)、ALLN蛋白酶体抑制剂(Calbiochem)。
3.4 突变体与βγ亚基 Rescue 实验验证
实验目的:验证Gα_{i2}的C末端结构破坏是导致sα_{i2}不稳定与错误定位的核心原因,同时探究βγ亚基对sα_{i2}稳定性与定位的调控作用。
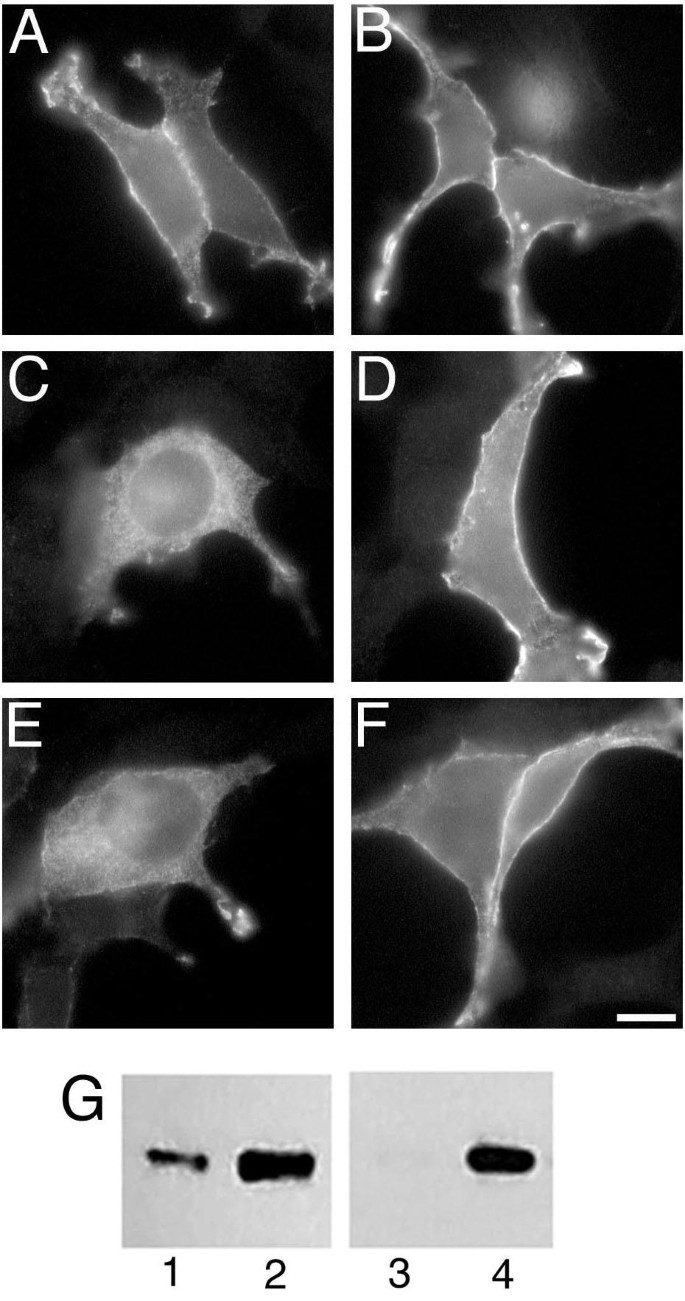
方法细节:构建两种Gα_{i2}突变体表达载体:α_{i2}(1-331)(缺失C末端24个氨基酸,模拟sα_{i2}的C末端截断)、α_{i2}A327S(已知的不稳定突变体,鸟苷酸结合能力下降),转染细胞后观察其亚细胞定位;同时将β_{1}和γ_{2}亚基表达载体与sα_{i2}或α_{i2}A327S共转染,观察对两者定位与表达量的影响;此外用蛋白酶体抑制剂ALLN处理转染细胞,观察蛋白的聚集情况。
结果解读:α_{i2}(1-331)和α_{i2}A327S均呈现与sα_{i2}类似的胞内定位模式
;共转染βγ亚基后,sα_{i2}和α_{i2}A327S的细胞膜定位显著增强,且表达量显著升高
;ALLN处理后,sα_{i2}和α_{i2}均形成类似聚集体的明亮斑点,且βγ亚基共转染无法完全逆转sα_{i2}的聚集
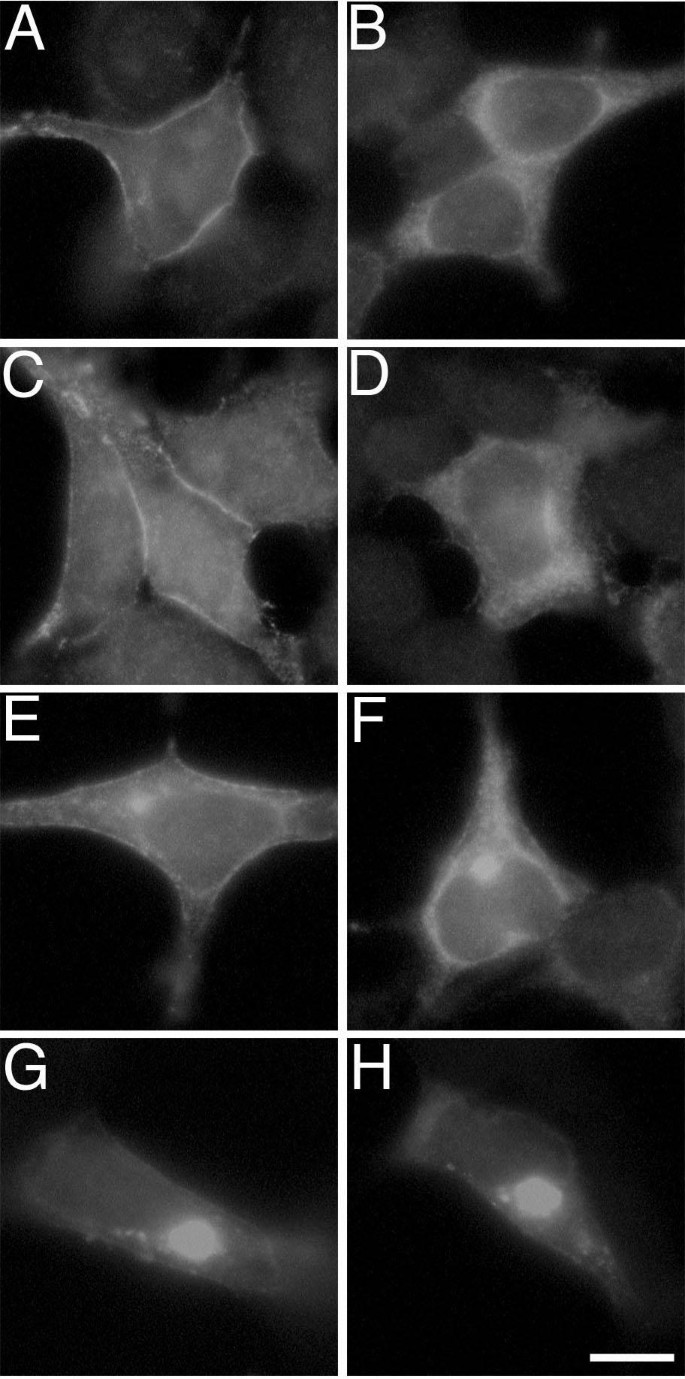
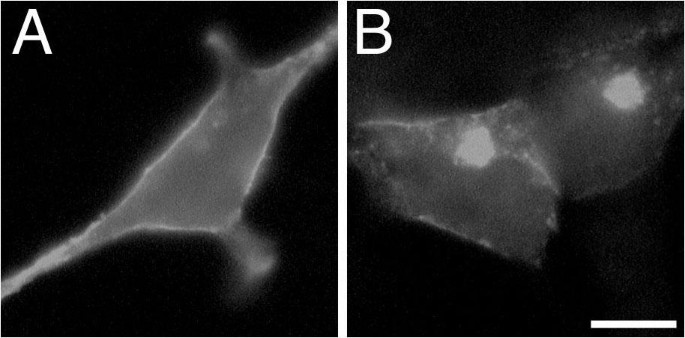
,证明βγ亚基可部分稳定sα_{i2}并促进其膜定位,但sα_{i2}的C末端结构破坏导致的不稳定性是其错误定位的核心原因。
产品关联:实验所用关键产品:MG-132蛋白酶体抑制剂(Calbiochem)、免疫印迹化学发光试剂(领域常规使用Pierce ECL Plus试剂)。
4. Biomarker研究及发现成果
本研究未涉及疾病相关的传统生物标志物,而是鉴定了Gα亚基的C末端结构作为调控其稳定性与亚细胞定位的功能模块,其筛选与验证逻辑遵循“序列对比→亚细胞定位观察→靶向信号功能验证→稳定性实验→突变体与 Rescue 实验”的多环节验证体系。该功能模块来源于Gα_{i2}的可变剪接变体sα_{i2}的C末端区域,研究过程中通过免疫荧光、亚细胞分馏实验验证了sα_{i2}的异常亚细胞定位,通过GFP融合实验证明其C末端不具备特异性靶向内膜系统的功能,通过代谢标记与脉冲追踪实验明确了sα_{i2}的蛋白稳定性显著低于野生型α_{i2},通过突变体对比实验验证了C末端结构破坏是导致蛋白不稳定的核心原因,通过βγ亚基共转染实验验证了稳定性对亚细胞定位的调控作用。本研究的核心成果在于,首次明确sα_{i2}的内膜定位是由于C末端结构破坏导致的蛋白不稳定,而非特异性靶向信号,揭示了Gα亚基C末端结构对其稳定性与亚细胞定位的关键调控作用,同时提供了两个可用于研究G蛋白降解机制的模型分子(sα_{i2}和α_{i2}A327S)。相关实验数据包括:sα_{i2}的半衰期为67±21分钟(n=3,P<0.05,与α_{i2}对比),α_{i2}的半衰期为237±110分钟(n=3),βγ亚基共转染后sα_{i2}的细胞膜定位阳性细胞比例显著升高(文献未明确提供具体数值,基于图表趋势推测)。
