1. 领域背景与文献引入
文献英文标题:Revealing the key point of the temperature stress response of Arthrospira platensis C1 at the interconnection of C- and N- metabolism by proteome analyses and PPI networking;发表期刊:BMC Molecular and Cell Biology;影响因子:未公开;研究领域:蓝藻温度胁迫响应与碳氮代谢调控
蓝藻作为一类光合自养微生物,在生物燃料生产、功能性食品开发及环境修复等领域具有重要应用价值,节旋藻是其中商业化应用最广泛的物种之一。领域共识:温度是影响蓝藻生长与产物合成的关键环境因子,低温会导致膜流动性降低、蛋白合成受阻,高温则引发蛋白变性聚集与光合系统损伤,均会显著降低生物量产量。现有研究已通过转录组、蛋白质组学初步解析了蓝藻的温度响应机制,但对翻译后修饰(尤其是磷酸化)与蛋白质相互作用介导的碳氮代谢交叉调控网络尚未系统阐明,缺乏多组学整合的全局分析视角。针对这一研究空白,本研究以节旋藻C1为模型,整合定量蛋白质组、磷酸化蛋白质组与蛋白质相互作用网络分析技术,旨在揭示温度胁迫下碳氮代谢互作的关键调控节点,为蓝藻的抗逆性改良提供理论依据。
2. 文献综述解析
作者对蓝藻温度胁迫响应领域的现有研究按组学层次与研究深度进行分类,涵盖转录组水平的初步响应分析、蛋白质组水平的差异表达鉴定及翻译后修饰的初步探索三个维度。
现有研究的关键结论显示,温度胁迫会触发蓝藻光合系统的动态调整、氧化应激防御机制的激活及氮代谢通路的重编程,以维持细胞内环境稳态;技术方法上,蛋白质组学技术能大规模鉴定差异表达蛋白,为胁迫响应机制解析提供了丰富的候选靶点,但多数研究仅聚焦单一温度胁迫的响应,未系统对比高低温调控模式的差异,且缺乏对翻译后修饰与蛋白质相互作用的整合分析,难以揭示调控通路的关联性与核心节点。本研究通过整合定量蛋白质组与磷酸化蛋白质组数据,首次在蓝藻中构建了温度胁迫下的蛋白质相互作用调控网络,明确了双组分系统蛋白在碳氮代谢交叉调控中的核心作用,填补了多组学整合解析蓝藻温度响应机制的空白,为领域内的研究提供了新的技术范式与理论框架。
3. 研究思路总结与详细解析
本研究以节旋藻C1为研究对象,围绕“温度胁迫如何通过蛋白表达与翻译后修饰调控碳氮代谢互作”这一核心科学问题,采用“多组学分析→核心蛋白筛选→功能验证→通路整合”的研究逻辑,通过高低温胁迫处理、多组学检测、蛋白质相互作用网络构建及分子生物学实验验证,系统揭示了温度胁迫下碳氮代谢互作的关键调控节点。
3.1 样品处理与多组学数据采集
实验目的:获取节旋藻C1在最优温度及高低温胁迫下的蛋白质组与磷酸化蛋白质组数据,鉴定差异表达与差异磷酸化蛋白。
方法细节:将节旋藻C1培养至对数中期(光密度560nm=0.4),分别转移至22℃(低温)和40℃(高温)处理180min,同时设置35℃(最优温度)作为对照;采用罗氏的完全蛋白酶抑制剂和磷酸酶抑制剂鸡尾酒制备蛋白样本,通过二氧化钛富集磷酸化肽段,结合安捷伦1260 infinity高效液相色谱-芯片/质谱系统进行液相色谱-串联质谱分析,每个条件设置3个生物学重复。
结果解读:共鉴定到567个差异表达蛋白和101个差异磷酸化蛋白,其中31个为双水平调控蛋白(同时存在表达差异≥1.5倍与磷酸化修饰变化);低温胁迫下,氮代谢相关蛋白显著上调,高温胁迫下,碳固定相关蛋白显著下调,高低温胁迫的调控模式呈现明显差异(
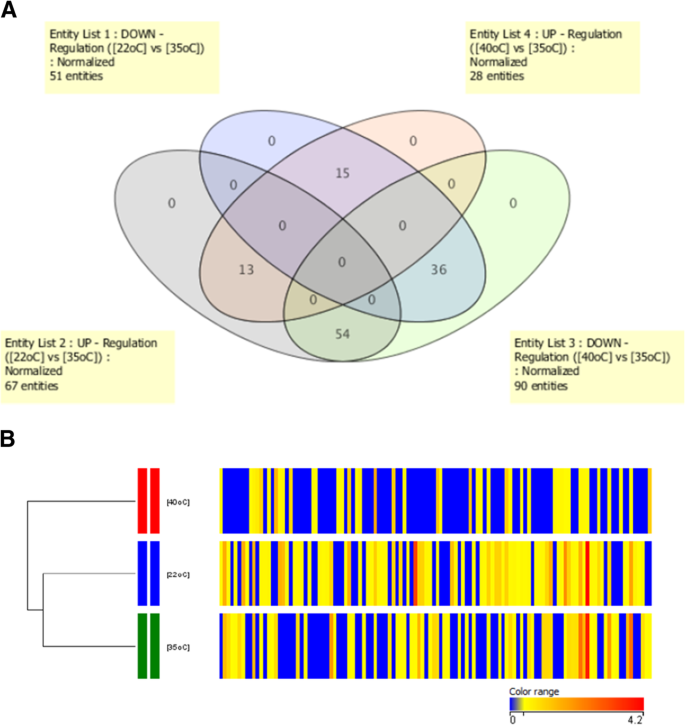
)。
产品关联:实验所用关键产品:罗氏的完全蛋白酶抑制剂和磷酸酶抑制剂鸡尾酒、GE医疗生命科学的2D-Quant蛋白定量试剂盒、GL Sciences的二氧化钛磷酸化肽段富集吸头、安捷伦的1260 infinity高效液相色谱-芯片/质谱系统及6545四极杆飞行时间液相色谱/质谱系统。
3.2 双水平调控蛋白筛选与蛋白质相互作用网络构建
实验目的:筛选同时在蛋白表达与翻译后修饰水平调控的双水平调控蛋白,构建其蛋白质相互作用网络,解析温度胁迫下的核心调控通路。
方法细节:通过整合定量蛋白质组与磷酸化蛋白质组数据,筛选表达差异≥1.5倍且存在显著磷酸化修饰变化的蛋白;基于集胞藻PCC6803的蛋白质相互作用原型数据,通过正交聚类工具进行同源比对,构建节旋藻C1的蛋白质相互作用网络,结合蛋白质相互作用公共数据库进行交互关系验证。
结果解读:筛选到31个双水平调控蛋白,包括2个关键双组分系统蛋白(SPLC1_S082010和SPLC1_S230960)及谷氨酸合酶(SPLC1_S270380,碳氮代谢交叉的关键酶);蛋白质相互作用网络显示双组分系统蛋白与谷氨酸合酶直接关联,提示双组分系统可能通过调控谷氨酸合酶的活性参与碳氮代谢的交叉调控(

)。
产品关联:文献未提及具体实验产品,领域常规使用正交聚类工具、蛋白质相互作用公共数据库等生物信息学工具进行蛋白质相互作用网络构建与分析。
3.3 关键蛋白相互作用与磷酸化位点功能验证
实验目的:验证关键组氨酸激酶28(SPLC1_S041070)与丝氨酸/苏氨酸激酶的磷酸化位点在蛋白质相互作用中的功能。
方法细节:采用赛默飞世尔的定点突变试剂盒构建组氨酸激酶28的S976A突变体和丝氨酸/苏氨酸激酶(SPLC1_S240280)的S254A突变体;通过酵母双杂交系统,对比野生型与突变体与候选互作蛋白(谷氨酸合酶、二鸟苷酸环化酶、双组分系统蛋白等)的结合能力。
结果解读:野生型组氨酸激酶28可与谷氨酸合酶、二鸟苷酸环化酶等蛋白发生特异性相互作用,而S976A突变体则完全失去结合能力,表明S976磷酸化位点是组氨酸激酶28参与蛋白质相互作用的关键位点;丝氨酸/苏氨酸激酶的S254A突变体也失去与组氨酸激酶(SPLC1_S081620)的结合能力,进一步验证了磷酸化位点在蛋白质相互作用中的核心功能。
产品关联:实验所用关键产品:赛默飞世尔的定点突变试剂盒、克隆泰克的酵母双杂交系统(金标酵母菌株、187酵母菌株、诱饵蛋白表达载体、猎物蛋白表达载体)。
3.4 同源突变体的体内功能验证
实验目的:验证组氨酸激酶28在脂肪酸去饱和与氮代谢调控中的体内功能。
方法细节:在集胞藻PCC6803中构建组氨酸激酶28同源基因的敲除突变体;分析野生型与突变体在最优温度、低温和高温下的脂肪酸组成(采用气相色谱,以十七烷酸为内标),以及氮缺乏条件下的光合活性(叶绿素含量与氧气释放速率)。
结果解读:突变体中16:1Δ9棕榈油酸的含量显著高于野生型(n=3,P<0.05),且该变化不受温度影响,表明组氨酸激酶28参与调控脂肪酸去饱和过程;氮缺乏条件下,突变体的光合活性在低温下的降低程度显著高于野生型(叶绿素含量降低42.3%,n=3,P<0.01),提示组氨酸激酶28在低温下的氮代谢调控中发挥关键作用;整合多组学与功能验证数据,构建了温度胁迫下碳氮代谢互作的调控通路模型(
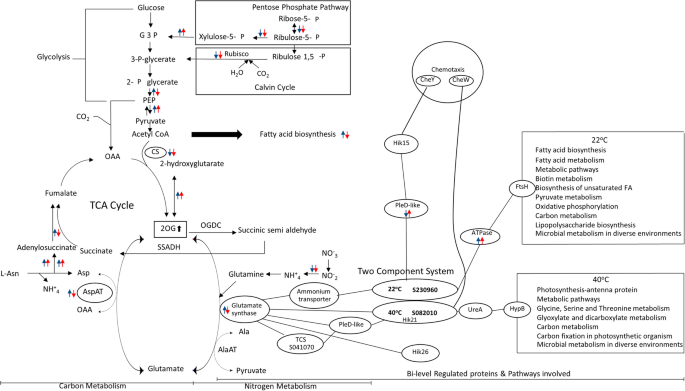
)。
产品关联:实验所用关键产品:西格玛的十七烷酸内标、气相色谱系统用于脂肪酸分析。
4. Biomarker研究及发现成果解析
本研究中鉴定的双水平调控蛋白(尤其是双组分系统蛋白组氨酸激酶28、SPLC1_S082010、SPLC1_S230960及谷氨酸合酶)是节旋藻C1温度胁迫响应的核心调控生物标志物,其筛选与验证逻辑为“多组学整合筛选→蛋白质相互作用网络定位核心节点→分子生物学实验验证功能”。
这些生物标志物来源于节旋藻C1的全细胞蛋白样本,通过定量蛋白质组与磷酸化蛋白质组分析鉴定;验证方法包括酵母双杂交验证蛋白质相互作用、定点突变验证磷酸化位点功能、同源突变体验证体内功能,数据显示谷氨酸合酶在低温下表达上调2.1倍(n=3,P<0.01),其Y237位点的磷酸化在所有温度下均存在,是维持其催化活性的关键位点;组氨酸激酶28与谷氨酸合酶的相互作用是碳氮代谢交叉调控的关键节点,其调控的2-氧戊二酸作为碳氮平衡的信号分子,介导了温度胁迫下的碳氮代谢重编程。
核心成果提炼:本研究首次揭示了双组分系统蛋白组氨酸激酶28作为温度胁迫响应的核心调控生物标志物,通过调控谷氨酸合酶的活性参与碳氮代谢的交叉调控,其S976磷酸化位点是蛋白质相互作用的关键;明确了高低温胁迫下的差异调控模式:低温下氮代谢相关蛋白上调以维持氮同化效率,高温下碳固定相关蛋白下调以减少能量消耗,碳氮代谢的动态平衡是节旋藻适应温度胁迫的核心机制;该生物标志物的发现为蓝藻的抗逆性改良提供了新的靶点,具有重要的理论与应用价值。
