1. 领域背景与文献引入
文献英文标题:Insulin receptor activation and down-regulation by cationic lipid transfection reagents;发表期刊:BMC Cell Biology;影响因子:未公开;研究领域:细胞生物学-转染技术与胰岛素信号通路交叉领域
阳离子脂质转染试剂是细胞培养领域广泛应用的核酸递送工具,其发展始于20世纪80年代末,以阳离子脂质体首次成功介导细胞核酸转染为关键节点,后续LipofectAMINE、FuGENE等商业化试剂的推出,使其成为基因功能研究的常规技术。当前研究热点集中在优化转染效率、降低细胞毒性,以及拓展难转染细胞系的适用范围,但现有研究普遍忽略了转染试剂对细胞内源信号通路的非特异性干扰,尤其是代谢相关通路如胰岛素信号的影响尚未被系统揭示。胰岛素信号通路调控细胞葡萄糖摄取、蛋白合成等核心代谢过程,其功能异常会直接影响代谢相关研究的实验准确性,而此前未有研究关注转染试剂对该通路的潜在干扰。本研究针对细胞经阳离子脂质转染后对胰岛素刺激产生抗性的现象开展机制探索,旨在明确转染技术的未被关注的副效应,为代谢相关研究的细胞实验设计提供优化方案,具有重要的技术规范价值。
2. 文献综述解析
作者围绕阳离子脂质转染的作用机制、胰岛素受体信号调控两个核心维度构建综述逻辑,先系统梳理阳离子脂质转染的三大核心功能:通过静电作用浓缩核酸、介导复合物与带负电的细胞膜结合、破坏内体膜实现核酸胞内递送,再总结胰岛素受体激活与下调的经典调控机制——受体经胰岛素结合后发生自磷酸化激活信号通路,长期激活则会诱导受体内化降解,实现通路负反馈调控。
现有研究中,阳离子脂质转染的优势在于操作简便、适用多种细胞系,被广泛用于基因过表达、敲低等功能研究,但多数研究仅聚焦转染效率的优化,对其非特异性细胞信号干扰的报道极为有限;胰岛素受体的调控研究多围绕配体依赖的激活与下调,未涉及非配体依赖的受体激活现象。本研究的创新价值在于首次揭示阳离子脂质转染试剂可通过非配体依赖的方式激活胰岛素受体,并诱导其后续下调,填补了转染技术副效应在代谢信号通路领域的研究空白,为代谢相关实验的转染方案优化提供了理论依据。
3. 研究思路总结与详细解析
本研究以“转染后细胞胰岛素抗性现象→机制验证→优化方案探索”为核心技术路线,研究目标是明确阳离子脂质转染试剂导致细胞胰岛素抗性的分子机制,并探索可规避该效应的转染条件;核心科学问题是阳离子脂质如何调控胰岛素受体的激活与表达水平,通过多细胞系验证、分子水平检测、剂量效应分析的递进实验,形成完整的逻辑闭环。
3.1 细胞胰岛素抗性现象验证
实验目的是确认阳离子脂质转染处理本身会导致细胞对胰岛素刺激的响应异常,排除重组蛋白表达的干扰。方法细节:选用3T3L1脂肪细胞、L6肌细胞、SHSY5Y神经母细胞瘤细胞三类内源表达胰岛素受体的细胞系,经LipofectAMINE 2000(LF2000)模拟转染(无外源核酸)后培养2天,检测胰岛素刺激后的葡萄糖摄取能力;同时在过表达人胰岛素受体的中国仓鼠卵巢(CHO.hIR)细胞中,检测未加胰岛素刺激的转染组中蛋白激酶B(PKB)的磷酸化水平。结果解读:
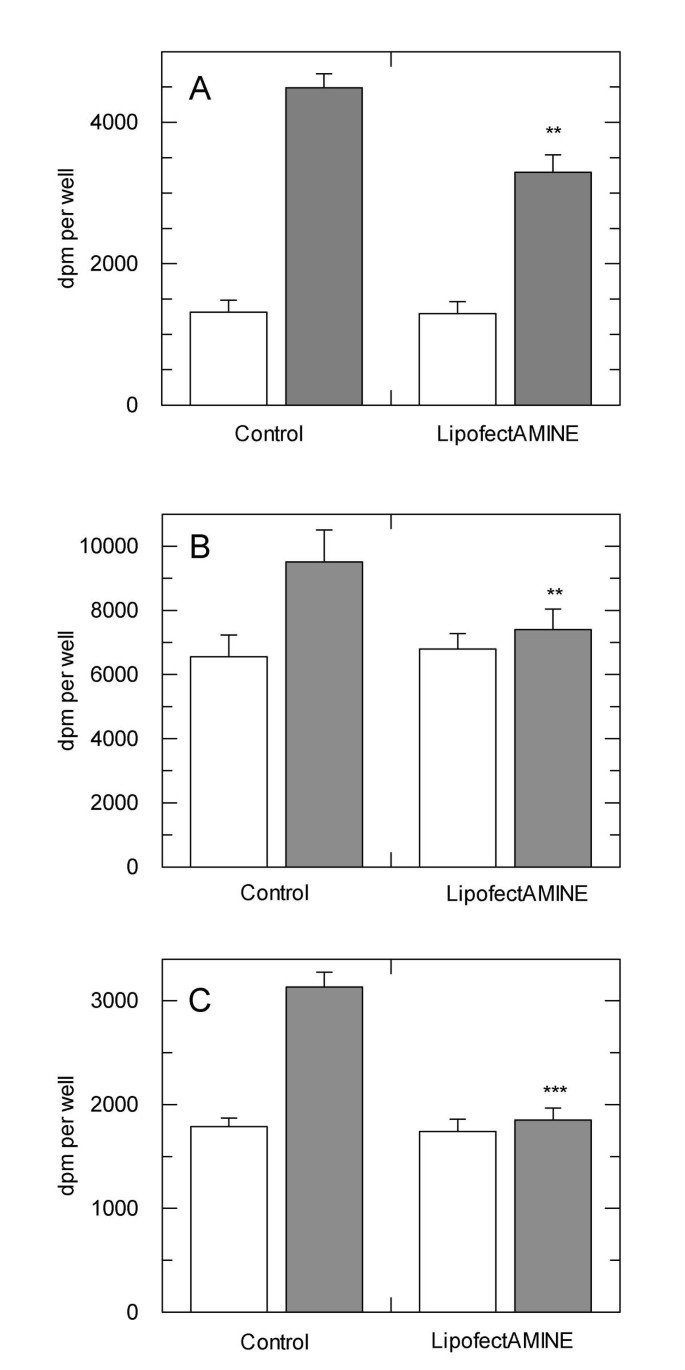
图1显示,经LF2000处理的三类细胞中,胰岛素诱导的葡萄糖摄取均显著降低,其中3T3L1细胞与对照组差异极显著(P<0.0005,n=6),L6细胞差异显著(P<0.005,n=6);CHO.hIR细胞在未加胰岛素的转染组中,PKB磷酸化水平显著升高,表明转染处理本身已激活胰岛素信号通路。实验所用关键产品:LipofectAMINE 2000™(Invitrogen)、FuGENE-6™(Roche)。
3.2 胰岛素受体激活与下调机制验证
实验目的是明确阳离子脂质对胰岛素受体磷酸化状态及表达水平的直接影响,揭示抗性现象的分子机制。方法细节:在CHO.hIR细胞中分别用LF2000和FuGENE处理4小时和24小时,通过免疫印迹(WB)检测胰岛素受体酪氨酸磷酸化水平及总受体表达量,以100nM胰岛素刺激10分钟作为受体激活的阳性对照。结果解读:
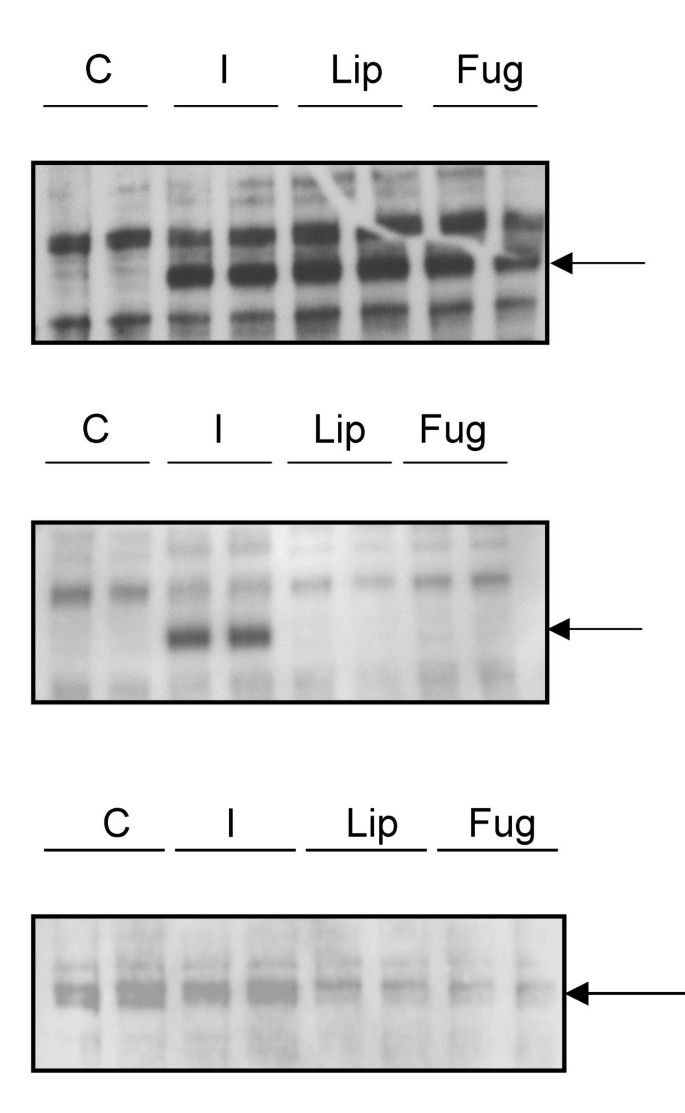
图2显示,处理4小时后,两种阳离子脂质试剂均使胰岛素受体酪氨酸磷酸化达到峰值,与胰岛素刺激组的磷酸化水平相当;处理24小时后,受体磷酸化信号完全消失,且总受体表达量较未处理对照组及胰岛素刺激组显著降低,表明阳离子脂质先完全激活胰岛素受体,随后诱导其发生下调,最终导致细胞对胰岛素刺激无响应。
3.3 转染试剂剂量效应分析与优化方案探索
实验目的是明确胰岛素受体激活的剂量依赖性,并探索低剂量转染条件下的效率与信号干扰平衡。方法细节:在CHO.hIR细胞中加入不同体积的LF2000(0.5μl至10μl)处理4小时,通过免疫印迹检测胰岛素受体磷酸化水平;同时用绿色荧光蛋白(GFP)质粒作为报告基因,评估不同剂量LF2000的转染效率,通过流式细胞术分析GFP阳性细胞比例。结果解读:
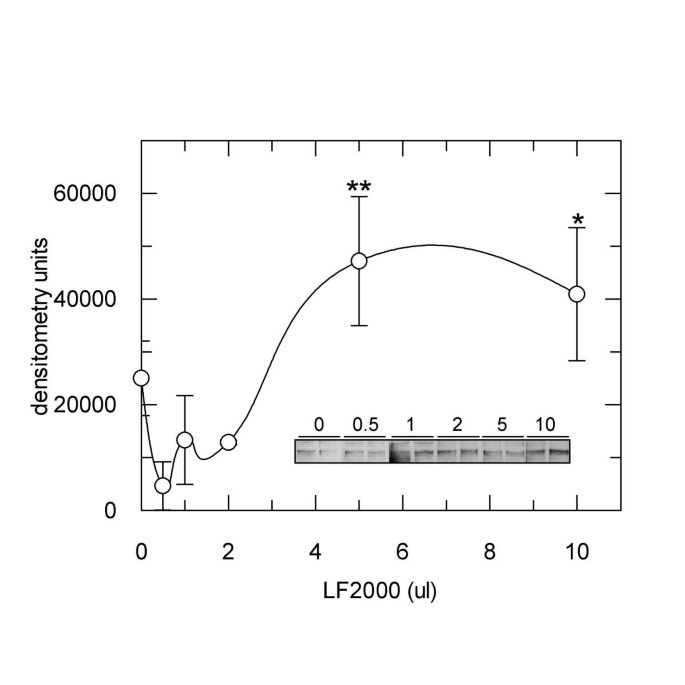
图3显示,当LF2000体积≥2μl时,胰岛素受体磷酸化水平显著高于对照组(2μl组P<0.05,5μl及以上组P<0.01,n=2),呈现明显的剂量依赖性;
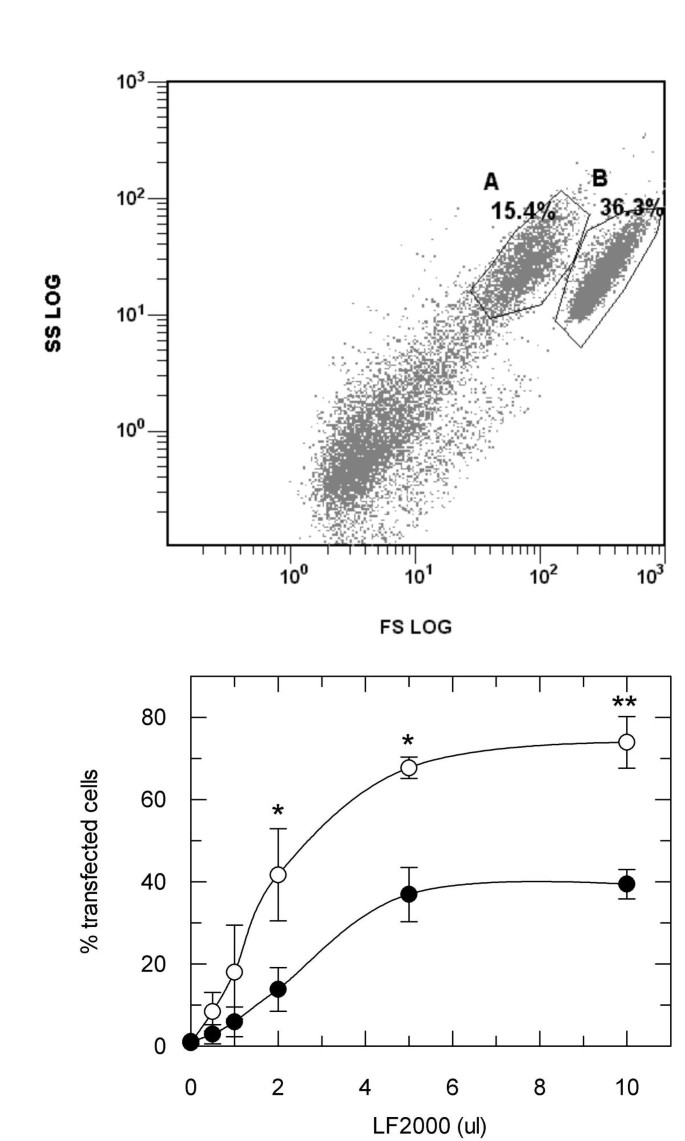
图4显示,转染效率随LF2000剂量增加而升高,但当剂量降至厂商推荐量的1/5(0.6μl LF2000对应1μg DNA)时,仍可实现较高转染效率,且此时胰岛素受体的激活被显著抑制,细胞可保留对胰岛素的响应能力。
4. Biomarker研究及发现成果
本研究未涉及疾病诊断或预后相关的传统生物标志物(Biomarker),但聚焦转染技术副效应的功能性标志物——胰岛素受体的磷酸化水平与总表达量,其筛选与验证逻辑为“现象关联→机制验证→剂量优化”的完整链条。
该功能性标志物的来源为培养细胞的细胞膜蛋白(胰岛素受体),验证方法为免疫印迹检测受体的酪氨酸磷酸化位点(激活状态)及总受体蛋白表达量(下调状态),特异性表现为仅在阳离子脂质处理组出现非配体依赖的受体激活,与胰岛素刺激的配体依赖激活形成明确区分;敏感性方面,低至2μl的LF2000即可诱导受体磷酸化水平显著升高。核心成果为明确胰岛素受体的异常激活与下调是阳离子脂质转染导致细胞胰岛素抗性的核心机制,首次建立了低剂量转染优化方案(LF2000与DNA比例为0.24-0.6μl/μg),在保持可接受转染效率的同时,有效避免转染试剂对胰岛素信号通路的干扰;该成果无疾病预后相关统计学数据,但其为代谢相关研究的细胞转染实验提供了关键技术规范,可显著降低实验结果的假阴性风险。
