1. 领域背景与文献引入
文献英文标题:Characterization of placental and decidual cell development in early pregnancy loss by single-cell RNA sequencing;发表期刊:Cell & Bioscience;影响因子:未公开;研究领域:生殖医学-早期妊娠丢失机制研究
早期妊娠丢失(EPL)涵盖偶发性流产与复发性流产,占临床确认妊娠的10%~15%,是生殖医学领域的常见疾病。偶发性流产主要与胚胎染色体异常相关,约半数病例为胚胎非整倍体;复发性流产指连续2次及以上妊娠丢失,占EPL的1%~3%,发病机制涉及子宫内膜或胎盘发育异常、母体免疫紊乱等多因素。领域共识:当前EPL研究热点聚焦于胎盘-蜕膜界面的细胞互作、免疫调控及多因素致病机制,但传统 bulk RNA测序技术无法解析细胞异质性,导致对EPL中细胞特异性转录组变化的认识存在空白,难以精准揭示不同细胞类型在EPL发病中的作用。针对这一核心问题,本研究采用单细胞RNA测序(scRNA-seq)技术,系统对比不同类型EPL(偶发性、复发性)与正常早孕期组织中绒毛和蜕膜的细胞发育特征,旨在解析细胞异质性对EPL发病的影响,为寻找EPL特异性生物标志物提供实验依据。
2. 文献综述解析
作者按EPL的致病类型(胚胎染色体异常、胎盘侵袭异常、母胎界面功能异常)对现有研究进行分类评述,梳理领域内研究的核心结论、技术优势与局限性。现有研究已明确EPL的主要致病因素分为三类:一是胚胎染色体异常导致的胚胎发育失败,二是滋养层细胞侵袭缺陷引发的胎盘发育异常,三是母胎界面炎症或功能紊乱导致的妊娠维持障碍。传统转录组研究发现细胞因子-趋化因子通路、线粒体超氧化物歧化酶(SOD2)等分子与EPL相关,但这类研究基于 bulk 测序技术,仅能获取细胞群体的平均转录组信号,无法区分不同细胞类型的特异性变化,存在细胞异质性解析不足的局限性。部分单细胞研究已解析正常胎盘的细胞亚型组成,但针对EPL的单细胞研究仍较为匮乏,缺乏不同类型EPL之间的细胞特征对比分析。本研究的创新价值在于首次采用scRNA-seq技术,系统解析偶发性流产(含有无胎心两种亚型)、复发性流产与正常早孕期组织的细胞簇组成与基因表达差异,聚焦绒毛与蜕膜细胞的发育异质性,填补了EPL细胞特异性转录组研究的空白,为EPL的机制研究与生物标志物筛选提供了新的技术视角。
3. 研究思路总结与详细解析
本研究的核心目标是解析不同类型EPL中胎盘与蜕膜细胞的发育特征及细胞异质性,核心科学问题为EPL中细胞簇组成、基因表达及细胞互作的异常如何参与发病,技术路线遵循“样本分组→单细胞制备→测序分析→细胞聚类与功能解析→结论”的闭环逻辑,通过scRNA-seq技术全面解析EPL的细胞层面致病机制。
3.1 样本分组与单细胞悬液制备
实验目的是建立不同类型EPL与正常对照的样本队列,制备符合scRNA-seq要求的高质量单细胞悬液。方法细节上,研究纳入4组样本,每组5例:A组为无胎心的早期偶发性流产,B组为有胎心后丢失的早期偶发性流产,C组为复发性流产,D组为正常早孕期人工流产对照。收集绒毛与蜕膜组织后,采用含0.125%胰蛋白酶、0.05%IV型胶原酶和0.04%DNase的混合酶液在37℃条件下分阶段消化,经40μm细胞筛过滤、红细胞裂解后,制备单细胞悬液,通过台盼蓝染色计数检测细胞活力。结果显示,四组的平均细胞数与活力分别为33.9/89.8、52.4/86.6、73.6/88、38.1/83(×10^4/活力%),均满足10×Genomics scRNA-seq平台的实验要求。实验所用关键产品:Miltenyi Biotec的MACS组织保存液,Sigma-Aldrich的胰蛋白酶、IV型胶原酶、DNase,Corning的40μm细胞筛。
3.2 scRNA-seq测序与数据处理
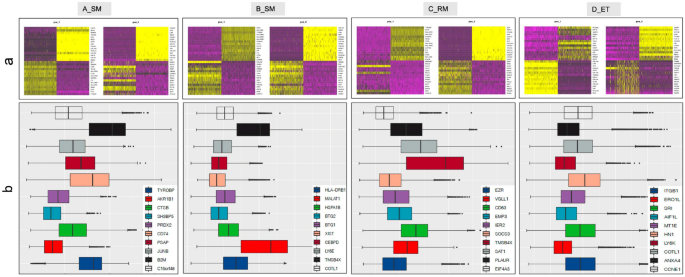
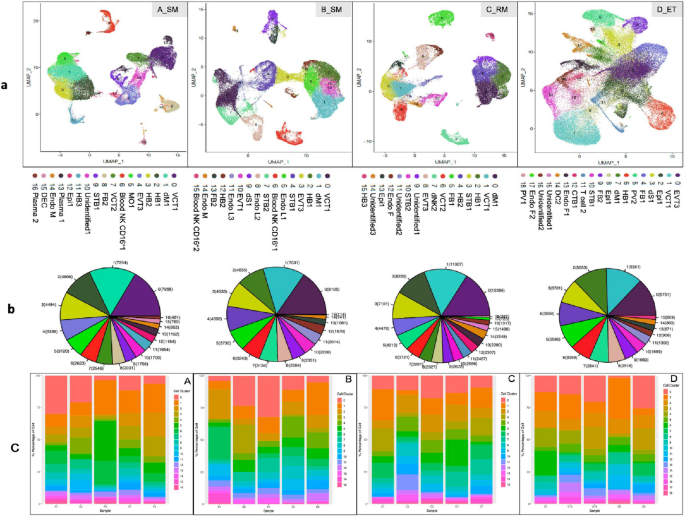
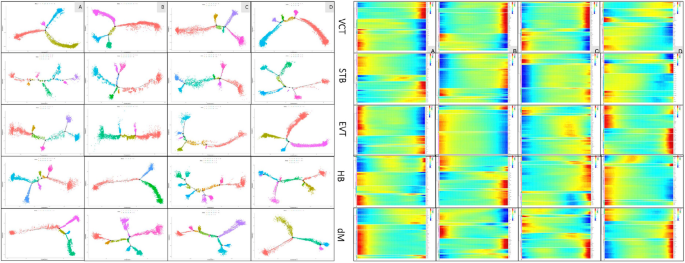
实验目的是获取单细胞转录组数据并完成标准化处理与初步分析。方法细节上,采用10×Genomics Chromium单细胞3’试剂试剂盒构建测序文库,在Illumina PE150平台完成测序;原始数据通过CellRanger V3.0.2处理后,采用Seurat V3.0进行细胞聚类与标记基因分析,Monocle进行细胞发育拟时序分析,WGCNA进行基因共表达网络分析,Cyclone分析细胞周期阶段,Scanpy分析细胞-细胞互作,DAVID、KEGG、GO数据库进行功能注释与通路富集,PCA和UMAP用于数据可视化。结果显示,研究共测序得到217649个基因,其中A组40705个、B组51506个、C组43755个、D组75683个;通过PCA分析与标记基因表达特征,可有效区分四组样本的分子特征,UMAP可视化结果显示四组的细胞簇组成存在显著差异。
实验所用关键产品:10×Genomics的Chromium单细胞3’试剂试剂盒、CellRanger软件,Illumina PE150测序平台,Seurat、Monocle等生物信息学分析工具。
3.3 细胞簇组成与差异分析
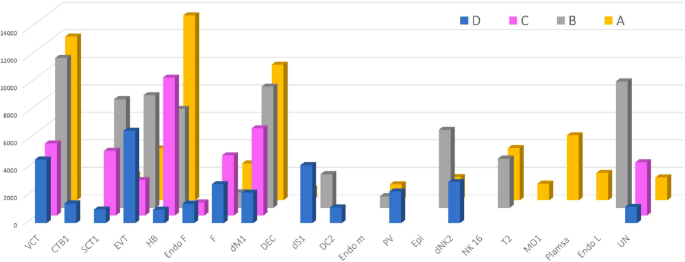
实验目的是解析不同组别中细胞簇的组成差异,明确EPL中异常富集的细胞类型。方法细节上,基于已报道的胎盘细胞标记基因,对细胞簇进行注释,对比四组样本的细胞簇比例与亚型分布特征。结果显示,EPL组(A、B、C)中最富集的三类细胞为绒毛细胞滋养层1(VCT1)、蜕膜巨噬细胞1(dM1)和霍夫鲍尔细胞1(HB1),而正常对照组(D)中最富集的细胞为绒毛外滋养层3(EVT3)。具体比例数据:VCT1在A、B、C、D组分别为16.68%、15.74%、12.25%、14.54%;dM1分别为15.21%、13.65%、13.14%、4.35%;HB1分别为10.07%、9.04%、11.55%、4.92%;EVT3分别为6.99%、8.80%、5.75%、16.23%。统计分析显示,EPL组中巨噬细胞(dM1和HB1)的比例显著高于对照组(P<0.001),提示免疫反应在EPL发病中起关键作用;A、B组中VCT1比例高于EVT3,提示偶发性流产中滋养层细胞从VCT向EVT的分化存在延迟(P<0.005)。此外,D组特有的细胞簇包括CTB1、PV1、PV2、树突状细胞、T细胞,而A组特有的细胞簇包括浆细胞、部分单核细胞。
3.4 细胞标记基因与功能通路分析
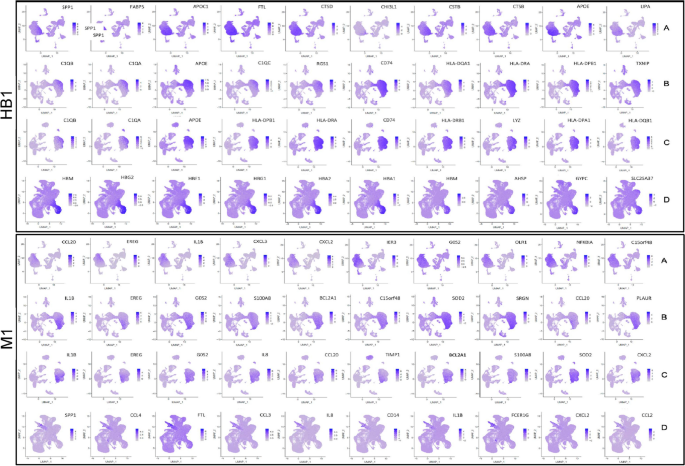
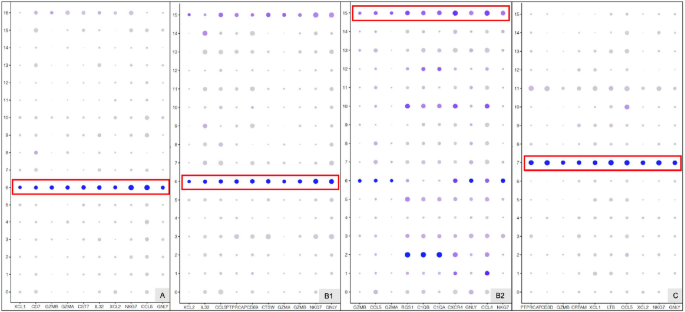
实验目的是鉴定不同细胞簇的特异性标记基因,解析EPL中异常激活的功能通路。方法细节上,通过RidgePlot、DotPlot分析各细胞簇的Top10标记基因,采用GSVA进行通路富集分析,Monocle进行细胞发育拟时序分析。结果显示,滋养层细胞中,VCT1的标记基因PAGE4、PEG10等在所有组中均有表达,PHLDA2、NGFRAP1仅在EPL组表达;STB1的标记基因具有组特异性;EVT3的标记基因HLA-G在C、D组表达,A、B组不表达。巨噬细胞中,HB1的标记基因ApoE在EPL组表达,对照组HB1的标记基因主要与红细胞相关;dM1的标记基因CCL20在EPL组表达,CCL2、CCL3、CCL4仅在对照组表达。通路富集分析显示,EPL组中滋养层细胞的代谢通路(如类萜骨架生物合成、糖酵解)、巨噬细胞的糖鞘脂生物合成等通路显著富集;拟时序分析显示,EPL组中滋养层细胞的分化分支点更多,巨噬细胞的发育状态更复杂。此外,SOD2在EPL组的滋养层细胞和巨噬细胞中表达显著升高,提示氧化应激参与EPL发病。

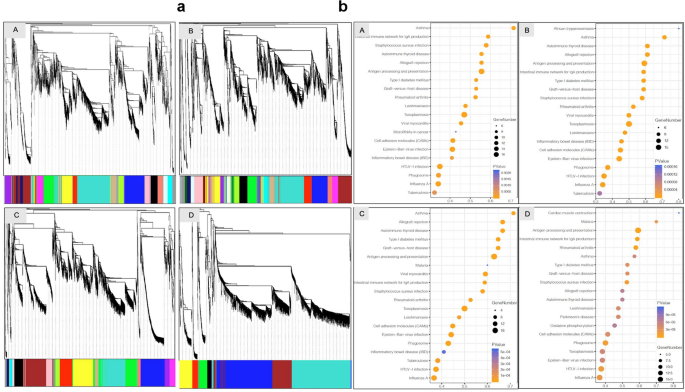
3.5 细胞互作与细胞周期分析
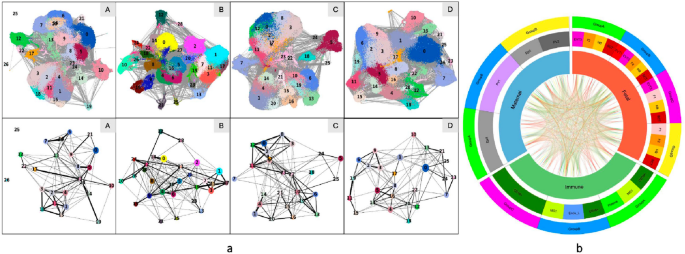
实验目的是解析不同组别中细胞间的互作差异及细胞周期状态。方法细节上,采用Scanpy分析细胞-细胞互作,Cyclone分析细胞周期阶段(G1、S、G2M)。结果显示,细胞互作分析显示,A组中VCT与单核细胞、NK细胞等存在互作,而C组中VCT与HB细胞存在直接互作;细胞周期分析显示,对照组中多数细胞处于G1期,EPL组中多数细胞处于S期,提示EPL中细胞增殖状态存在异常。此外,NK细胞标记基因GZMA仅在偶发性流产组(A、B)表达,可用于区分偶发性与复发性流产。
4. Biomarker研究及发现成果
Biomarker定位
本研究中潜在的Biomarker包括细胞类型特异性标记基因与差异表达基因,筛选逻辑为:基于scRNA-seq数据鉴定不同EPL组与对照组的差异表达基因→结合细胞簇注释明确基因的细胞特异性→分析基因与EPL发病的功能关联,形成“数据库筛选→单细胞转录组验证→功能关联分析”的完整逻辑链条。
研究过程详述
研究中Biomarker的来源为临床早孕期绒毛与蜕膜组织样本,验证方法为scRNA-seq转录组分析及标记基因的可视化验证(RidgePlot、DotPlot)。特异性与敏感性数据显示,滋养层细胞中,PHLDA2、NGFRAP1仅在EPL组表达,具有EPL特异性;巨噬细胞中,ApoE在EPL组的HB1中高表达,CCL20在EPL组的dM1中高表达;NK细胞标记基因GZMA仅在偶发性流产组(A、B)表达,可作为偶发性与复发性流产的区分标记。此外,SOD2在EPL组的滋养层细胞和巨噬细胞中表达显著升高,其表达水平与氧化应激反应直接相关。
核心成果提炼
本研究首次鉴定了不同类型EPL中特异性的细胞簇标记基因,包括PHLDA2、NGFRAP1(EPL滋养层细胞)、ApoE(EPL霍夫鲍尔细胞)、CCL20(EPL蜕膜巨噬细胞)、GZMA(偶发性流产NK细胞),这些基因可作为EPL的潜在Biomarker。功能关联分析显示,这些Biomarker参与免疫调控、细胞分化、氧化应激等关键通路,提示EPL的发病与细胞特异性免疫激活、滋养层分化延迟、氧化应激增强密切相关。其中GZMA可有效区分偶发性与复发性流产,为EPL的精准分型提供了分子依据。目前研究未提供ROC曲线、敏感性与特异性的临床验证数据,需进一步在大样本临床队列中验证这些Biomarker的诊断效能。
