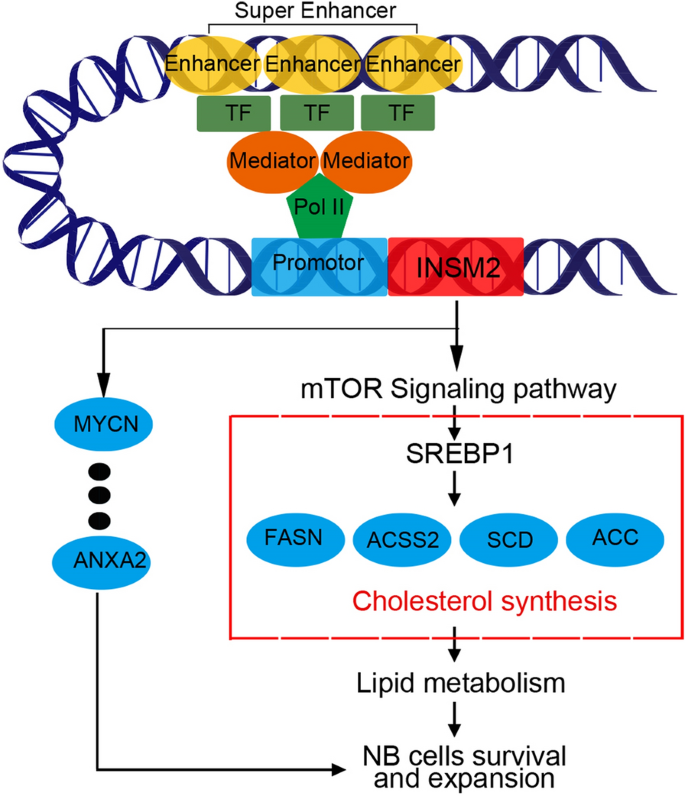
1. 领域背景与文献引入
文献英文标题:Super-enhancer-associated INSM2 regulates lipid metabolism by modulating mTOR signaling pathway in neuroblastoma;发表期刊:Cell & Bioscience;影响因子:未公开;研究领域:儿童神经母细胞瘤代谢调控与超级增强子功能研究
神经母细胞瘤是儿童最常见的恶性实体瘤之一,起源于神经嵴来源的交感肾上腺系统前体细胞,具有高度异质性,临床预后差异显著——18个月以下患儿肿瘤可自发消退,而年长患儿常表现为快速进展甚至死亡。领域共识:目前已知神经母细胞瘤的核心分子异常包括MYCN扩增、ALK突变等,这些基因组变异维持了肿瘤细胞的生物学特性,但针对这些靶点的治疗手段仍有限,且肿瘤代谢尤其是脂质代谢的调控网络尚未完全阐明。脂质代谢异常是肿瘤的核心特征之一,增强的脂质合成或摄取可为肿瘤细胞快速增殖提供能量和膜结构原料,已有研究显示干扰神经母细胞瘤的脂肪酸合成可显著降低细胞活力,但上游调控机制仍不明确。超级增强子是2013年提出的概念,由高密度转录因子、辅因子及组蛋白修饰标记富集的增强子簇组成,可调控细胞身份基因的表达,在神经母细胞瘤中已发现HAND2、MEIS2等超级增强子关联基因参与细胞身份维持,但INSM2作为超级增强子调控基因在神经母细胞瘤中的功能及与脂质代谢的关联尚未见报道,本研究正是针对这一空白,旨在揭示INSM2在神经母细胞瘤中的作用及分子机制。
2. 文献综述解析
作者从神经母细胞瘤的临床与分子特征、超级增强子的调控作用、肿瘤脂质代谢异常三个维度梳理了领域研究现状,明确了当前研究的不足与本研究的创新方向。
现有研究显示,神经母细胞瘤的异质性可部分由MYCN扩增、ALK突变等分子异常解释,这些基因组变异维持了肿瘤细胞的生物学特性,但针对这些靶点的治疗手段仍有限。超级增强子作为细胞身份的关键调控元件,在神经母细胞瘤中富集于多个癌基因区域,调控HAND2等细胞身份基因的表达,为肿瘤治疗提供了新的潜在靶点,但目前对超级增强子调控的下游功能基因的研究仍不全面。脂质代谢异常在多种肿瘤中被证实可促进细胞增殖和肿瘤进展,神经母细胞瘤中脂肪酸合成相关基因的高表达与不良预后相关,干扰脂肪酸合成可诱导肿瘤细胞分化并降低存活能力,但神经母细胞瘤中脂质代谢的上游调控网络仍未被充分解析,缺乏关键调控因子的鉴定。本研究的创新点在于首次发现超级增强子关联基因INSM2在神经母细胞瘤中高表达,并通过体内外实验及组学分析,揭示其通过mTOR-SREBP1轴调控脂质代谢进而促进肿瘤进展的分子机制,填补了神经母细胞瘤脂质代谢上游调控因子的研究空白,为该领域提供了新的治疗靶点。
3. 研究思路总结与详细解析
本研究的核心目标是鉴定神经母细胞瘤中受超级增强子调控的INSM2基因,并解析其促进肿瘤进展的分子机制,整体技术路线遵循“基因鉴定→表达验证→功能验证→机制解析→临床关联”的闭环逻辑,通过染色质免疫共沉淀测序(ChIP-seq)、体内外功能实验、组学分析等多种技术手段,系统阐明了INSM2通过调控mTOR信号通路影响脂质代谢的作用机制。
3.1 INSM2作为超级增强子关联基因的鉴定
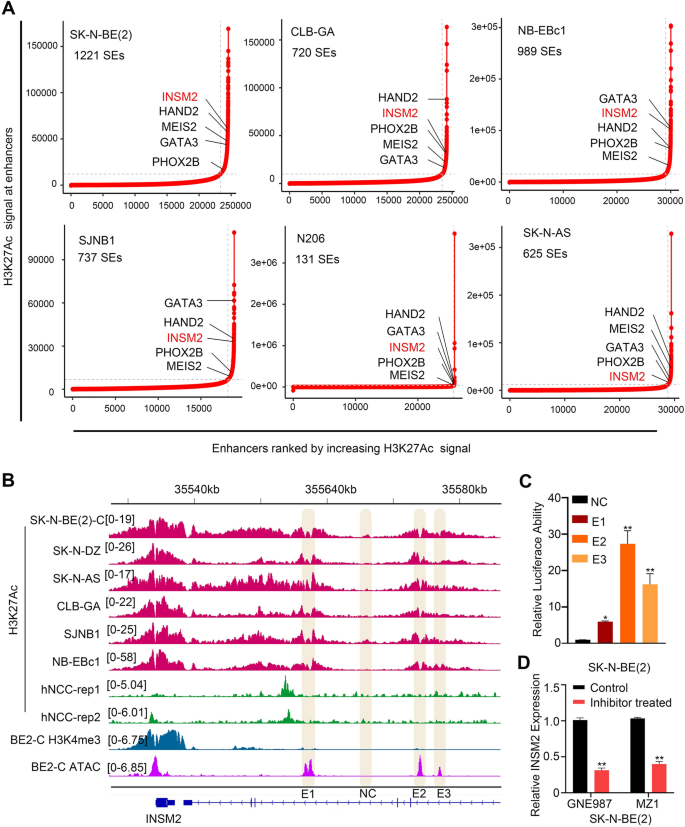
实验目的:鉴定神经母细胞瘤中受超级增强子调控的INSM2基因,明确其转录调控机制。
方法细节:对6种神经母细胞瘤细胞系(SK-N-BE(2)、CLB-GA等)进行组蛋白H3K27Ac的ChIP-seq分析,通过ROSE算法筛选超级增强子关联基因;克隆INSM2的3个潜在增强子片段(E1、E2、E3)至pGL3-promoter荧光素酶报告载体,转染SK-N-BE(2)细胞后检测荧光素酶活性;使用BRD4抑制剂GNE987和MZ1处理SK-N-BE(2)细胞,通过实时荧光定量聚合酶链反应(qRT-PCR)检测INSM2的mRNA表达水平。
结果解读:ChIP-seq分析显示INSM2与已知的神经母细胞瘤癌基因PHOX2B、MEIS2等共同富集于超级增强子区域;荧光素酶报告实验显示E2和E3增强子具有显著的报告基因活性,而E1活性较弱(n=3,P<0.01),与H3K27Ac信号富集结果一致;BRD4抑制剂处理后,INSM2的mRNA表达水平显著下调(n=3,P<0.01),证实其表达受超级增强子调控。
产品关联:实验所用关键产品:pGL3-promoter荧光素酶报告载体(Promega)、BRD4抑制剂GNE987和MZ1(未明确品牌,领域常规使用Selleck或MedChemExpress产品)、组蛋白H3K27Ac抗体(未明确品牌,领域常规使用Millipore或Abcam产品)。
3.2 INSM2在神经母细胞瘤中的表达及预后相关性验证
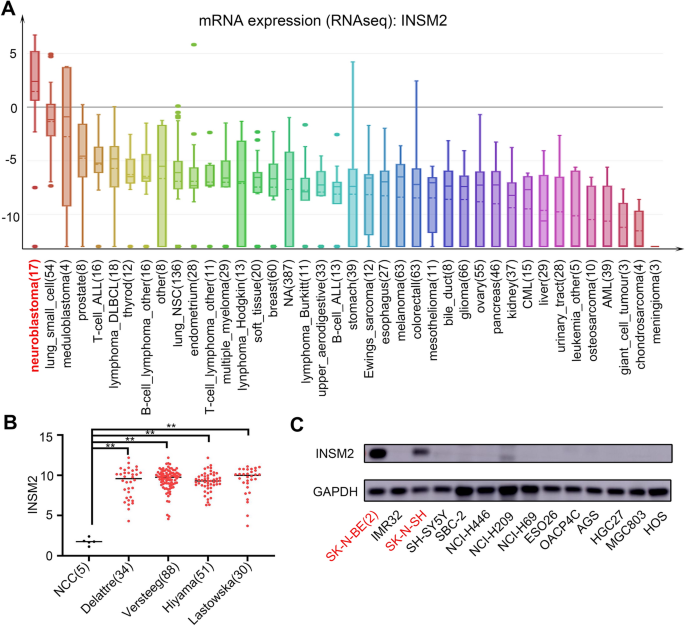
实验目的:验证INSM2在神经母细胞瘤细胞系及临床样本中的表达水平,明确其与肿瘤的关联及预后价值。
方法细节:从CCLE数据库获取40余种肿瘤细胞系的INSM2 mRNA表达数据,比较神经母细胞瘤与其他肿瘤的表达差异;分析GEO数据库中正常神经嵴细胞与4组神经母细胞瘤临床样本的INSM2表达水平;通过蛋白质免疫印迹检测神经母细胞瘤细胞系(SK-N-BE(2)、SK-N-SH)与其他肿瘤细胞系的INSM2蛋白表达;分析GSE147635数据集中间节细胞神经瘤与神经母细胞瘤样本的INSM2表达差异。
结果解读:CCLE数据库分析显示神经母细胞瘤细胞系的INSM2表达水平显著高于其他肿瘤细胞系;临床样本分析显示,神经母细胞瘤中INSM2的mRNA表达显著高于正常神经嵴细胞(n=5 vs n=34/88/51/30,P<0.01),且显著高于节细胞神经瘤样本(文献未明确样本量,P<0.05);蛋白质免疫印迹结果显示INSM2蛋白特异性表达于神经母细胞瘤细胞系中。
产品关联:实验所用关键产品:INSM2抗体(Abcam,货号ab91568)、GAPDH抗体(Bioworld Technology Inc.,货号AP0063)、蛋白质免疫印迹相关试剂(未明确品牌,领域常规使用Bio-Rad产品)。
3.3 INSM2促神经母细胞瘤细胞生长的体内外功能验证
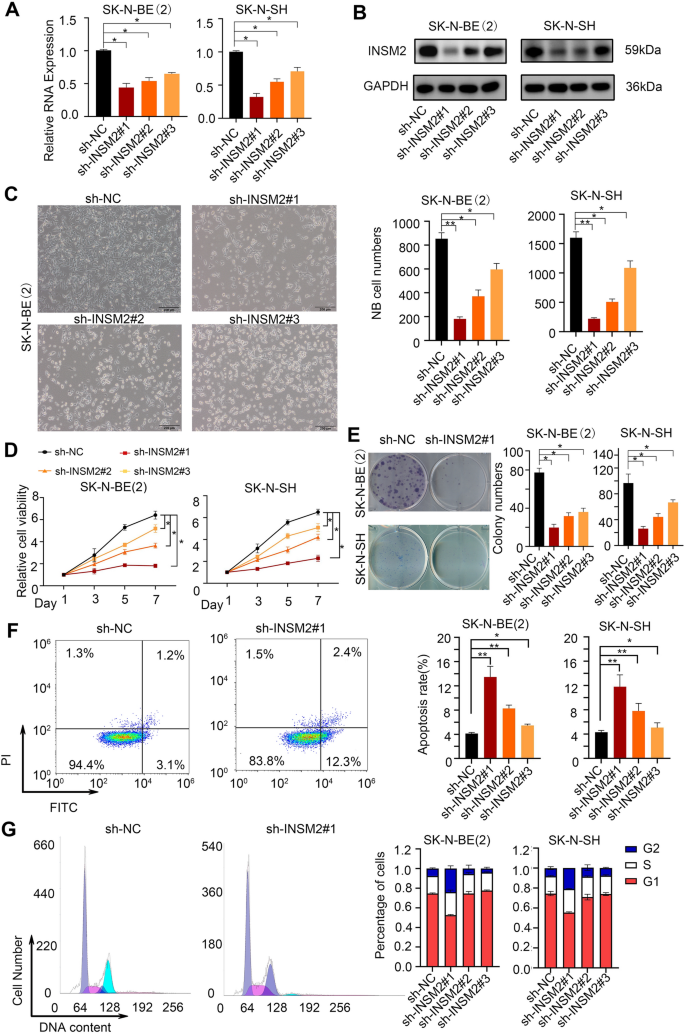
实验目的:验证INSM2在神经母细胞瘤细胞生长、增殖及肿瘤形成中的作用。
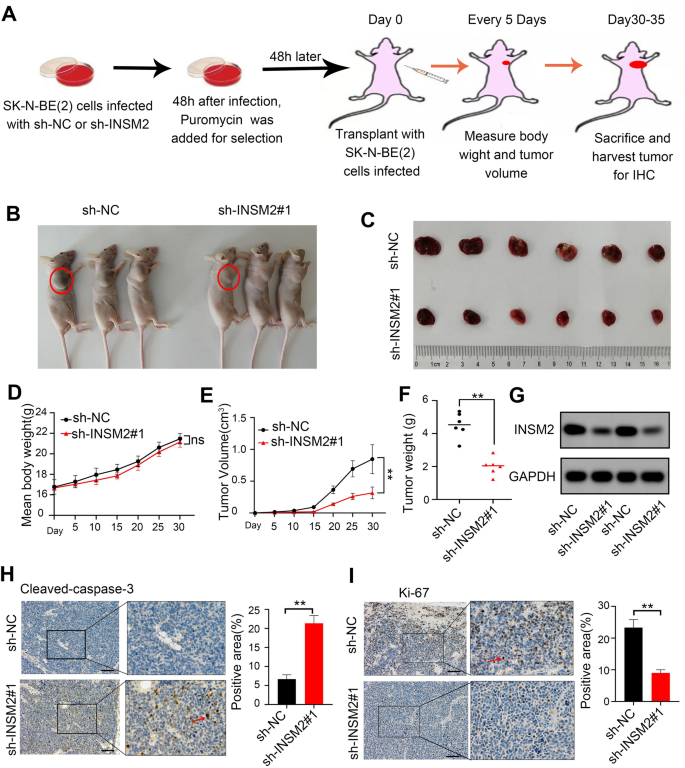
方法细节:构建INSM2的短发夹RNA(shRNA)载体,感染SK-N-BE(2)和SK-N-SH细胞,通过qRT-PCR和蛋白质免疫印迹验证敲减效率;通过显微镜观察、CCK-8实验、克隆形成实验检测细胞增殖能力,流式细胞术检测细胞凋亡和周期分布;构建INSM2过表达载体,回补敲减INSM2的细胞,验证细胞增殖能力的恢复;建立裸鼠皮下异种移植模型,注射敲减INSM2的SK-N-BE(2)细胞,观察肿瘤生长情况,通过蛋白质免疫印迹和免疫组化(IHC)验证肿瘤组织中INSM2的敲减效率及细胞增殖、凋亡情况。
结果解读:INSM2敲减后,SK-N-BE(2)和SK-N-SH细胞的增殖能力显著降低(CCK-8实验,n=3,P<0.01),克隆形成能力下降(n=3,P<0.01),凋亡率升高(n=3,P<0.01),细胞周期停滞于G2期(n=3,P<0.01);过表达INSM2可回补敲减后的细胞增殖能力(文献未明确数据,基于图表趋势推测);裸鼠异种移植实验显示,敲减INSM2的肿瘤生长速度显著慢于对照组,肿瘤体积和重量显著减小(n=6,P<0.01),免疫组化显示肿瘤组织中Ki-67阳性率降低,Cleaved Caspase-3阳性率升高(n=6,P<0.01)。
产品关联:实验所用关键产品:shRNA载体(未明确品牌,领域常规使用GenePharma产品)、CCK-8试剂盒(未明确品牌,领域常规使用Dojindo产品)、流式细胞术凋亡检测试剂盒(未明确品牌,领域常规使用BD产品)、Ki-67抗体(未明确品牌,领域常规使用Abcam产品)、Cleaved Caspase-3抗体(未明确品牌,领域常规使用CST产品)、INSM2抗体(Abcam,货号ab91568)。
3.4 INSM2调控脂质代谢的机制解析
实验目的:解析INSM2促进神经母细胞瘤进展的分子机制,明确其与脂质代谢的关联。
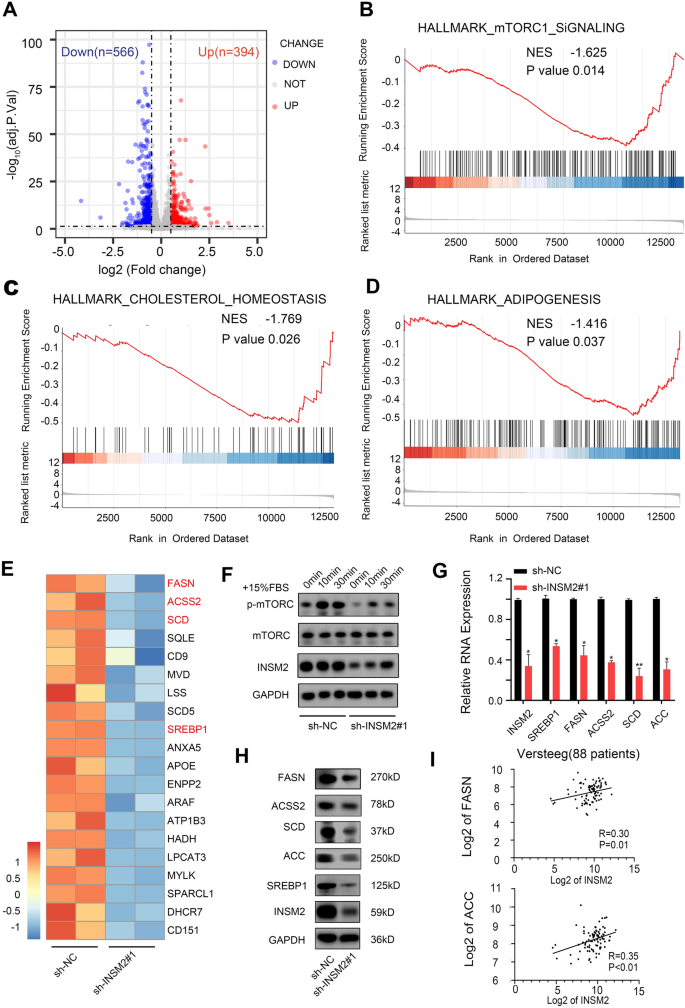
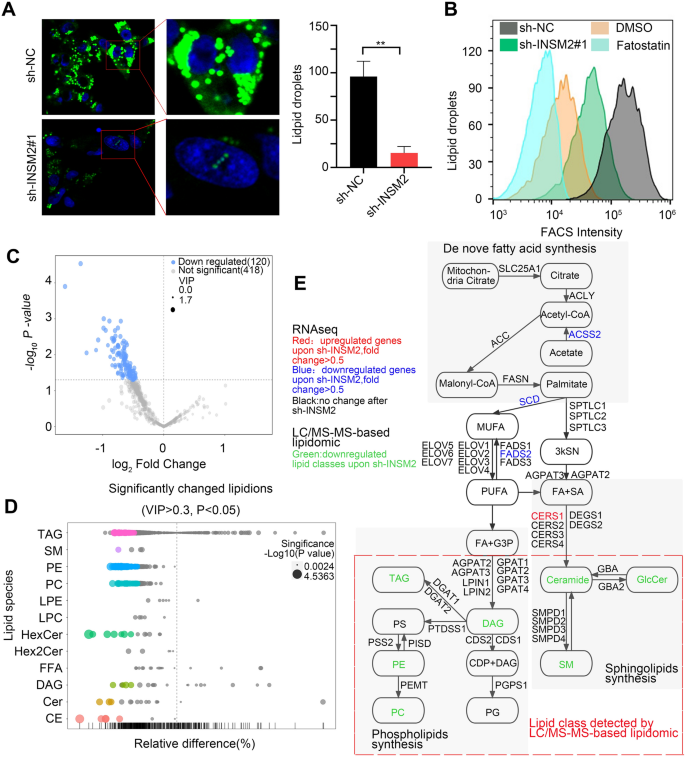
方法细节:对敲减INSM2的SK-N-BE(2)细胞进行RNA-seq分析,通过基因集富集分析(GSEA)筛选差异表达基因富集的通路;通过蛋白质免疫印迹检测mTOR的磷酸化水平及脂质代谢相关基因的蛋白表达;通过免疫荧光和流式细胞术检测细胞内脂滴含量;对敲减INSM2的细胞进行全定量脂质组学分析,鉴定差异脂质分子;整合RNA-seq和脂质组学数据,解析INSM2调控的下游通路。
结果解读:RNA-seq分析显示,敲减INSM2后有566个基因下调、394个基因上调(log2 Fold Change≥0.5,P<0.05);GSEA分析显示差异基因富集于mTOR信号通路抑制、胆固醇稳态和脂肪生成通路;蛋白质免疫印迹显示敲减INSM2后mTOR的磷酸化水平显著降低(n=3,P<0.01),脂质代谢相关基因SREBP1、FASN、ACC等的表达显著下调(n=3,P<0.01);免疫荧光和流式细胞术显示敲减INSM2后细胞内脂滴含量显著降低(n=3,P<0.01);脂质组学分析显示,敲减INSM2后细胞内120种脂质离子显著减少,包括卵磷脂和鞘磷脂代谢相关的多种脂质(n=6,P<0.05);整合组学数据显示INSM2通过调控mTOR-SREBP1轴影响脂质代谢。
产品关联:实验所用关键产品:RNA-seq服务(Novogene)、脂质组学服务(BIOTREE)、HCS LipidTOX™绿色中性脂染色试剂(Thermo Fisher,货号H34475)、mTOR抗体(CST,货号2983 S)、磷酸化mTOR抗体(CST,货号5536 S)、SREBP1抗体(Abcam,货号ab3259)、FASN抗体(Proteintech,货号10624-2-AP)、ACC抗体(CST,货号3676 S)。
3.5 INSM2与脂质代谢基因的临床相关性验证
实验目的:验证INSM2与脂质代谢相关基因在临床神经母细胞瘤样本中的表达相关性及预后价值。
方法细节:分析Versteeg数据库中88例神经母细胞瘤患者的INSM2与脂质代谢基因FASN、ACC的表达相关性;分析3个独立数据集(Versteeg、Kocak、NRC)中脂肪酸合成相关基因的表达与患者总生存期的关联。
结果解读:INSM2的表达与FASN、ACC的表达呈显著正相关(n=88,P<0.05);3个数据集的生存分析显示,FASN、ACC、ACSS2和SCD的高表达与神经母细胞瘤患者的不良总生存期相关(文献未明确HR值,基于图表趋势推测)。
产品关联:文献未提及具体实验产品,领域常规使用数据库分析工具(如R语言、GraphPad Prism)。
4. Biomarker研究及发现成果解析
本研究中INSM2作为神经母细胞瘤的潜在预后Biomarker和治疗靶点,通过系统的筛选、验证及机制解析,明确了其在肿瘤中的表达特征、功能及临床意义,为神经母细胞瘤的诊断和治疗提供了新的候选分子。
Biomarker定位:INSM2属于神经母细胞瘤的预后Biomarker,同时也是潜在的治疗靶点,其筛选与验证逻辑为:首先通过ChIP-seq筛选出神经母细胞瘤中受超级增强子调控的INSM2基因,随后在细胞系和多个临床样本队列中验证其高表达特征,再通过体内外功能实验验证其促肿瘤作用,最后通过临床样本分析验证其与脂质代谢基因的相关性及预后价值。
研究过程详述:INSM2的来源包括神经母细胞瘤细胞系、临床肿瘤组织样本及公共数据库中的转录组数据;验证方法包括qRT-PCR、蛋白质免疫印迹、RNA-seq、免疫组化等;特异性方面,CCLE数据库分析显示神经母细胞瘤细胞系的INSM2表达水平显著高于其他40余种肿瘤细胞系,临床样本分析显示其表达显著高于正常神经嵴细胞(n=5 vs n=34/88/51/30,P<0.01)和节细胞神经瘤样本(文献未明确样本量,P<0.05);敏感性方面,原文未提供ROC曲线数据,但生存分析显示脂肪酸合成相关基因的高表达与不良预后相关,而INSM2与这些基因的表达正相关,提示其可能具有潜在的预后预测价值。
核心成果提炼:INSM2作为超级增强子关联基因,在神经母细胞瘤中高表达并与不良预后相关,其功能是通过调控mTOR信号通路激活SREBP1,进而促进脂质代谢相关基因的表达,增加细胞内脂滴含量,最终促进神经母细胞瘤细胞的增殖和肿瘤进展;本研究首次揭示了INSM2在神经母细胞瘤中的功能及调控脂质代谢的分子机制,其创新性在于鉴定了神经母细胞瘤脂质代谢的上游关键调控因子,为该领域提供了新的治疗靶点;临床相关性分析显示INSM2与FASN、ACC等脂质代谢基因的表达正相关(n=88,P<0.05),提示其可作为神经母细胞瘤预后评估的潜在Biomarker,同时针对INSM2或其调控的mTOR-SREBP1轴的干预可能成为新的治疗策略。