1. 领域背景与文献引入
文献英文标题:Metastatic tumor evolution and organoid modeling implicate TGFBR2 as a cancer driver in diffuse gastric cancer;发表期刊:Genome Biology;影响因子:未明确提供;研究领域:弥漫性胃癌转移机制与肿瘤驱动基因研究
全球范围内,胃腺癌是第四大常见恶性肿瘤,也是男女癌症死亡的第二大原因,根据组织病理学特征可分为弥漫型和肠型两个亚型。弥漫性胃癌通常未分化,常伴有印戒细胞特征,呈浸润性生长,相较于肠型胃癌,其转移发生率更高,预后更差。遗传性弥漫性胃癌(HDGC)由CDH1(E-钙粘蛋白)基因的种系突变驱动,携带者终身患癌风险高达70%,而散发性弥漫性胃癌中也有50%存在CDH1突变或启动子甲基化。目前,虽然癌症基因组图谱(TCGA)等项目已解析了弥漫性胃癌的基因组特征,但针对转移灶与原发灶的配对遗传分析仍较为缺乏,转移进化的分子机制尚未完全阐明,尤其是TGFBR2(转化生长因子β受体2)在胃癌中的功能尚未得到功能性验证。在此背景下,本研究通过对一位HDGC患者的原发胃癌灶和卵巢转移灶进行深度基因组测序,结合小鼠胃类器官模型,旨在鉴定转移相关的驱动基因并验证其功能,为弥漫性胃癌的转移机制研究提供新的视角。
2. 文献综述解析
作者对现有研究的分类维度主要包括研究对象(原发灶vs转移灶)、研究技术(基因组分析vs功能验证)以及研究结论(已知驱动基因vs候选驱动基因)。现有研究的关键结论显示,CDH1和TP53是弥漫性胃癌发生的核心驱动基因,FGFR2(成纤维细胞生长因子受体2)扩增在部分弥漫型胃癌中存在并具有致癌潜能;技术方法上,TCGA等大样本数据库分析为胃癌的基因组特征提供了全景式视角,但其局限性在于缺乏配对的原发与转移灶样本分析,且多数研究仅停留在基因组关联层面,缺乏对候选驱动基因的功能性验证,尤其是针对转移过程的功能研究。本研究的创新价值在于,首次对HDGC患者的原发灶与转移灶进行深度配对测序分析,揭示了转移灶特有的TGFBR2双等位失活事件,并利用小鼠胃类器官模型成功验证了TGFBR2的转移抑制功能,建立了“基因组分析-候选基因筛选-类器官功能验证”的整合研究范式,弥补了现有研究在转移灶遗传分析和功能验证方面的不足。
3. 研究思路总结与详细解析
本研究的整体研究目标是鉴定弥漫性胃癌转移过程中的关键驱动基因,并通过体内外实验验证其功能;核心科学问题在于明确弥漫性胃癌原发灶与转移灶的遗传异质性,以及TGFBR2缺失在转移发生中的作用;技术路线遵循“临床样本发现-实验室功能验证”的闭环逻辑,首先通过患者样本的基因组测序筛选转移相关候选基因,再利用小鼠胃类器官模型对候选基因的功能进行验证。
3.1 临床样本收集与基因组测序分析
实验目的:通过对HDGC患者的原发胃癌灶、卵巢转移灶及正常组织进行基因组测序,解析原发灶与转移灶的遗传差异,筛选转移相关的候选驱动基因。方法细节:收集一位37岁HDGC女性患者的原发胃癌组织、卵巢转移灶(Krukenberg瘤)及外周血、正常胃组织样本,分别进行全基因组测序(原发灶平均覆盖度>60×,转移灶>30×)、外显子组测序(平均覆盖度>100×),并采用Affymetrix 6.0单核苷酸多态性(SNP)芯片进行基因型验证;针对候选突变位点,设计靶向深度测序引物(覆盖突变位点周围300bp),平均覆盖度达251×(原发灶)、152×(转移灶),以验证突变的真实性及特异性。结果解读:测序结果显示,原发灶与转移灶共享CDH1的种系剪接位点突变(c.1565+2insT)及体细胞77bp外显子9缺失,同时均存在TP53的剪接供体位点突变(c.559+1G>A)及17p臂的杂合性缺失(LOH),提示两者具有共同的遗传起源;差异分析发现,原发灶存在FGFR2基因所在的10q臂1.66Mb区间扩增,而转移灶则存在TGFBR2基因的外显子3缺失及3p臂的杂合性缺失,形成双等位失活,且该突变仅存在于转移灶中。
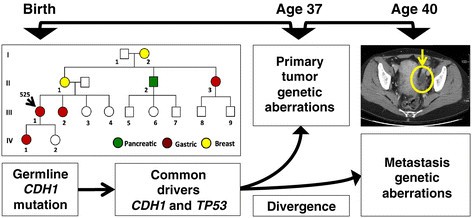
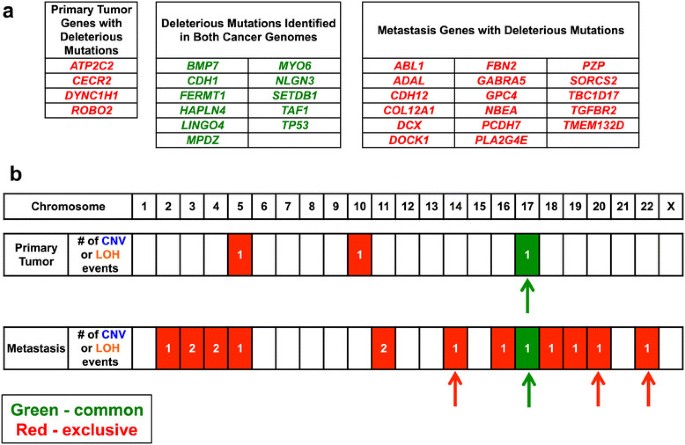
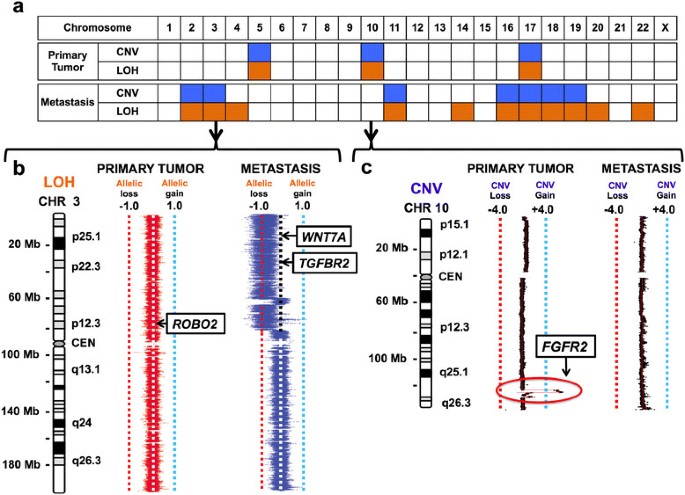
产品关联:实验所用关键产品:Omega Bio-Tek的E.Z.N.A. SQ DNA/RNA Protein Kit、Illumina的TruSeq Paired End文库构建试剂盒、Roche-Nimblegen的SeqCap EZ外显子捕获试剂盒、Affymetrix 6.0 SNP芯片、Bio-Rad的QX100数字PCR系统。
3.2 FGFR2扩增的功能验证
实验目的:验证FGFR2扩增在弥漫性胃癌中的致癌潜能及靶向治疗敏感性。方法细节:采用数字PCR技术检测37例弥漫型胃癌和27例肠型胃癌样本的FGFR2拷贝数;选取携带CDH1突变、TP53缺失及FGFR2扩增的KatoIII弥漫性胃癌细胞系,以及FGFR2野生型的AGS细胞系,分别用不同浓度的FGFR抑制剂(AZD4547、TKI258等)处理,通过WST-1增殖实验检测细胞存活率。结果解读:数字PCR结果显示,FGFR2扩增在11%的弥漫型胃癌样本中存在,而肠型胃癌样本中未检测到;细胞实验结果显示,KatoIII细胞对AZD4547的半抑制浓度(IC50)为2nM,远低于AGS细胞的39580nM,在各测试浓度下,两组细胞存活率的差异均具有统计学意义(P<0.05),提示FGFR2扩增是弥漫性胃癌的致癌驱动因素,且对FGFR抑制剂敏感。
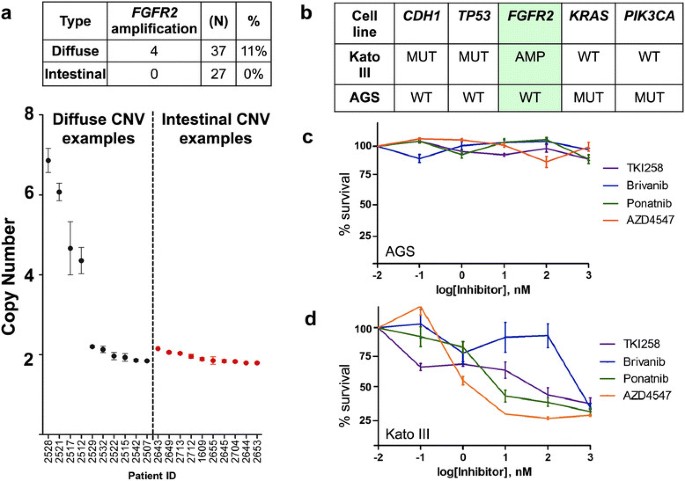
产品关联:实验所用关键产品:Selleck Chemical的AZD4547等FGFR抑制剂、Roche的WST-1细胞增殖检测试剂盒、Life Technology的FGFR2 TaqMan引物探针。
3.3 TGFBR2缺失的小鼠胃类器官模型验证
实验目的:验证TGFBR2缺失在CDH1和TP53失活背景下对弥漫性胃癌转移的促进作用。方法细节:构建Cdh1flox/flox;Trp53flox/flox小鼠的原代胃类器官,通过腺病毒Ad Cre-GFP敲除Cdh1和Trp53基因,再用慢病毒介导的shRNA敲低Tgfbr2表达;对类器官进行组织学分析,并将敲低Tgfbr2的类器官及对照组类器官分别皮下注射到免疫缺陷NOG小鼠体内,观察肿瘤生长及转移情况。结果解读:组织学分析显示,Tgfbr2敲低的类器官出现严重异型增生、印戒细胞形成及侵袭性生长,而对照组类器官无此表现;体内实验结果显示,Tgfbr2敲低组的肿瘤体积显著大于对照组(P<0.01),且在小鼠肺部检测到印戒细胞癌转移灶,对照组未出现转移,证实Tgfbr2具有转移抑制功能。
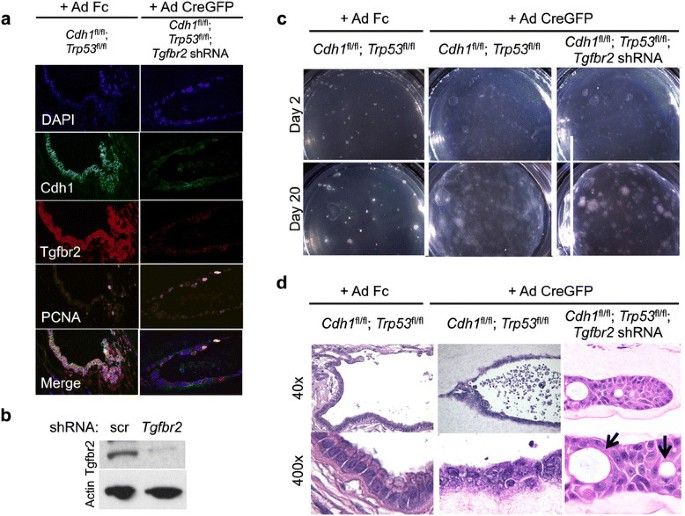
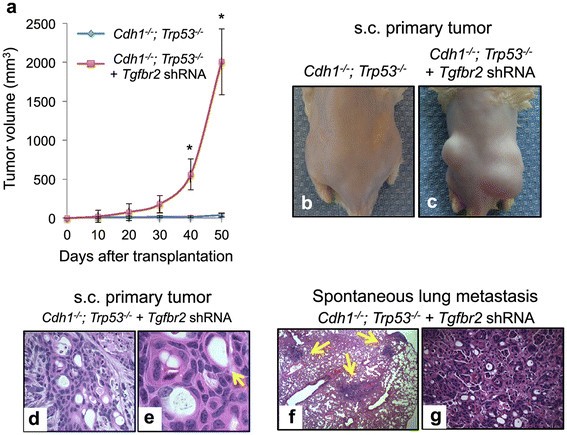
产品关联:实验所用关键产品:Origene的Tgfbr2 shRNA、Invitrogen的Lipofectamine2000转染试剂、BD Biosciences的CDH1抗体、Abbiotech的TGFBR2抗体。
4. Biomarker研究及发现成果解析
本研究鉴定的核心Biomarker为TGFBR2,属于转移抑制性肿瘤标志物,其筛选与验证遵循“临床样本测序发现-大样本数据库验证-体内外功能验证”的完整逻辑链条。Biomarker定位:TGFBR2是弥漫性胃癌转移的抑制性生物标志物,其双等位失活仅存在于转移灶中,而原发灶及正常组织中无此改变;筛选逻辑为:通过配对样本的深度基因组测序,发现转移灶特有的TGFBR2双等位失活事件,随后在TCGA数据库中验证该突变存在于部分弥漫型胃癌样本中,最后通过小鼠类器官模型验证其转移抑制功能。研究过程详述:该Biomarker来源于HDGC患者的卵巢转移灶组织,验证方法包括全基因组测序、靶向深度测序、数字PCR等,其中靶向深度测序的平均覆盖度达152×,确保突变检测的准确性;特异性方面,TGFBR2的双等位失活仅存在于转移灶中,原发灶及正常组织中未检测到;敏感性方面,数字PCR技术可检测到低丰度的突变位点。核心成果:TGFBR2双等位失活与弥漫性胃癌的转移密切相关,在CDH1和TP53失活的背景下,TGFBR2缺失可促进胃癌细胞的体外侵袭及体内转移,其作为转移抑制基因的功能在胃癌中首次得到验证;统计学结果显示,类器官模型中Tgfbr2敲低组的肿瘤体积显著大于对照组(P<0.01),且转移灶的组织学特征与患者样本一致。此外,本研究还发现FGFR2扩增可作为弥漫性胃癌的潜在治疗靶点,其在11%的弥漫型胃癌样本中存在,且对FGFR抑制剂敏感。
