1. 领域背景与文献引入
文献英文标题:Vive la différence: biogenesis and evolution of microRNAs in plants and animals;发表期刊:Genome Biology;影响因子:未公开;研究领域:非编码RNA(微小RNA)进化与功能调控
1993年,lin-4和let-7两个微小RNA(miRNA)在秀丽隐杆线虫中被发现,确立了真核生物中由短发夹RNA产生约22nt小RNA调控靶标mRNA的基因调控范式。2001年,高通量测序技术推动了动物微小RNA的大规模鉴定,2002年植物微小RNA也被系统发现,此后微小RNA被证实是动植物中广泛存在的关键基因调控因子,参与发育、生理等多个过程。当前领域研究热点聚焦于微小RNA的生物发生机制、靶标调控网络构建、新微小RNA基因的起源模式,但尚未系统解析动植物微小RNA通路差异的进化驱动机制,也缺乏对新微小RNA基因起源模式分异的整合性研究。在此背景下,本研究通过系统对比动植物微小RNA从生物发生到靶标调控的全链条差异,解析其对各自进化特征的塑造作用,填补了领域内对微小RNA进化分异机制的理解空白,为非编码RNA的进化研究提供了新的视角。
2. 文献综述解析
作者以“动植物微小RNA通路差异-进化特征分异”为核心逻辑,将现有研究按生物发生通路、基因组定位、靶标识别模式、进化起源四个维度分类,系统梳理了领域内的研究进展与不足。
现有研究已证实微小RNA在动植物中均为广泛存在的基因调控因子,核心调控通路依赖核糖核酸酶III(RNase III)家族酶(迪塞尔酶(Dicer)/德罗沙酶(Drosha))和阿戈纳特蛋白(Argonaute,AGO)的参与,高通量测序与生物信息学分析技术的应用极大推动了微小RNA的鉴定与靶标预测。但现有研究多聚焦于单类生物的微小RNA机制解析,对动植物间通路差异的进化意义探讨不足,且对新微小RNA基因的起源模式缺乏跨物种的系统对比,难以揭示微小RNA进化分异的核心驱动因素。
本研究的创新价值在于首次将动植物微小RNA的生物发生、基因组定位、靶标调控差异与进化特征进行系统关联,明确了植物微小RNA多起源于靶基因反向重复、动物微小RNA多从头起源的分异模式,同时提出了微小RNA注释的严格标准,解决了之前注释中假阳性率高的问题,为领域内微小RNA的进化研究提供了整合性的框架,弥补了现有研究的不足。
3. 研究思路总结与详细解析
本研究的核心目标是揭示动植物微小RNA生物发生、靶标调控的差异如何塑造其独特的进化特征,核心科学问题是动植物微小RNA通路分异的进化驱动因素及新微小RNA基因起源的不同机制,技术路线遵循“通路差异对比-靶标调控分析-进化起源关联-注释标准完善”的逻辑闭环,通过整合已发表的模式生物研究数据、高通量测序结果和比较基因组学分析,系统解析了动植物微小RNA的进化分异机制。
3.1 动植物微小RNA经典生物发生通路对比
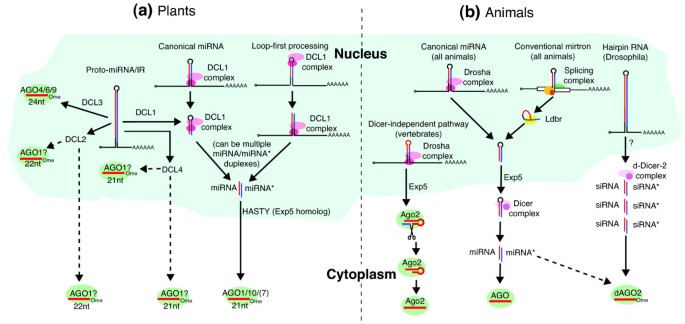
实验目的是明确动植物微小RNA成熟过程的核心分子差异,为解析进化分异提供机制基础;方法细节是整合拟南芥、果蝇、秀丽隐杆线虫、哺乳动物等模式生物的已发表研究数据,对比微小RNA前体(pri-miRNA/pre-miRNA)加工的酶系组成、亚细胞定位、末端修饰过程;结果解读:植物微小RNA的成熟过程完全在细胞核内完成,由迪塞尔酶样蛋白1(DCL1)对pri-miRNA进行两次切割,产生的微小RNA/微小RNA双链经HEN1蛋白甲基化修饰后,由HASTY(Exportin-5同源蛋白)转运至细胞质,加载到阿戈纳特蛋白1(AGO1)上发挥功能;动物微小RNA的成熟则分为核质两个阶段,先由核内的德罗沙酶切割pri-miRNA产生pre-miRNA,再由Exportin-5转运至细胞质,经迪塞尔酶切割形成微小RNA/微小RNA双链,产物大多不发生甲基化修饰,加载到不同类型的阿戈纳特蛋白上。该差异决定了动植物微小RNA的加工效率与稳定性特征,进而影响其进化速率。
文献未提及具体实验产品,领域常规使用RNA提取试剂盒、实时荧光定量PCR(qRT-PCR)试剂、蛋白质免疫印迹(Western Blot)抗体等。
3.2 动植物微小RNA基因组定位与非经典通路分析
实验目的是解析基因组结构特征对微小RNA进化的影响;方法细节是整合miRBase数据库的注释信息与已发表的比较基因组学研究数据,对比动植物微小RNA基因的基因组分布(内含子区域、基因簇等),以及非经典生物发生通路(mirtron、miR-451通路等)的物种分布特征;结果解读:植物微小RNA基因多为独立的非编码转录单元,约20%的微小RNA基因成簇分布,且多数簇内为同源微小RNA,推测由局部串联重复产生;动物微小RNA基因约30%位于蛋白质编码基因的内含子区域,约40%成簇分布,且簇内多为异源微小RNA,提示其进化过程中存在不同微小RNA基因的共调控整合。非经典通路方面,mirtron(由内含子剪接形成pre-miRNA)在动物中广泛存在,而植物中仅在水稻中发现一例;脊椎动物特有的miR-451则通过迪塞尔酶非依赖通路成熟,由AGO2蛋白直接切割pre-miRNA产生成熟微小RNA。这些基因组与通路特征的差异进一步推动了动植物微小RNA的进化分异。

文献未提及具体实验产品,领域常规使用基因组注释工具、高通量测序数据分析软件等。
3.3 动植物微小RNA靶标识别模式对比
实验目的是明确靶标调控差异与微小RNA进化的关联;方法细节是整合已发表的靶标预测结果、降解组测序数据,对比动植物微小RNA与靶标mRNA的互补程度、靶标数量及调控模式;结果解读:植物微小RNA与靶标mRNA多为完全或近完全互补,靶标数量相对较少,拟南芥中已知或预测的微小RNA靶标转录本占比不足1%(文献未明确样本量,P值未提供),且多数靶标仅受一个微小RNA调控;动物微小RNA则依赖5"端2-8nt的种子区与靶标mRNA互补,靶标数量庞大,约30%的哺乳动物转录本含有保守的微小RNA结合位点(文献未明确样本量,P值未提供),且单个靶标常受多个微小RNA的组合调控。这种靶标调控模式的差异导致植物微小RNA的进化多与靶基因共进化,而动物微小RNA则可通过逐步获得新靶标实现功能扩张。
文献未提及具体实验产品,领域常规使用靶标预测软件(如TargetScan、miRanda)、降解组测序分析平台等。
3.4 动植物微小RNA进化起源模式解析
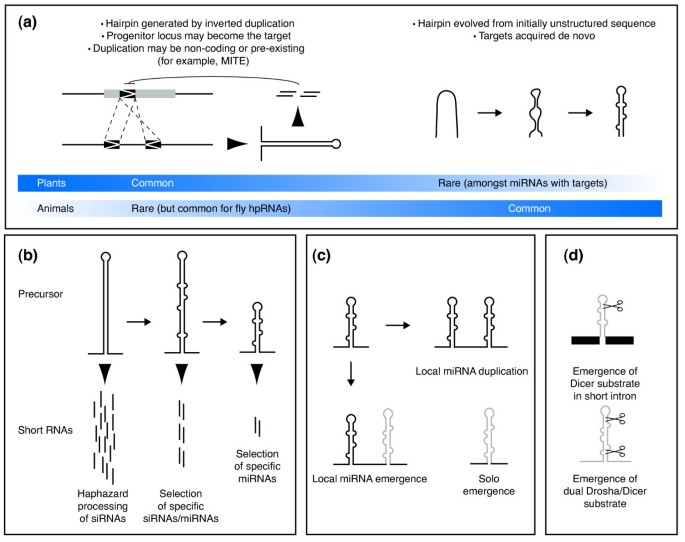
实验目的是揭示新微小RNA基因起源的不同分子机制;方法细节是通过比较基因组学分析不同物种中年轻微小RNA基因的序列特征,结合靶标预测结果,对比动植物新微小RNA基因的起源模式;结果解读:植物新微小RNA基因多起源于靶基因的反向重复,即靶基因序列经反向重复形成发夹结构,逐步进化为成熟的微小RNA基因,年轻微小RNA常与靶基因存在序列同源性;动物新微小RNA基因则多为从头起源,即基因组中随机序列形成的发夹结构经进化获得微小RNA加工能力,这类年轻微小RNA通常表达量较低,且需逐步获得靶标实现功能化。此外,部分动物微小RNA(如miR-196)可能起源于靶基因的局部重复,呈现出类似植物的起源模式,但这类情况较为罕见。
文献未提及具体实验产品,领域常规使用比较基因组学分析工具、序列比对软件等。
3.5 微小RNA注释标准与进化通量分析
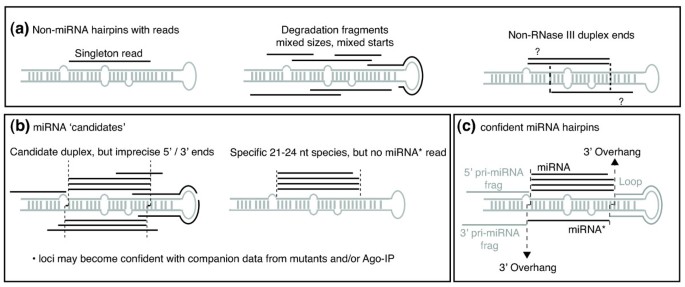
实验目的是明确微小RNA注释的核心标准,解析不同微小RNA亚类的进化动态;方法细节是整合高通量测序数据,分析微小RNA加工的精确性特征,对比经典微小RNA与mirtron的进化保守性;结果解读:可靠的微小RNA注释需依赖精确的加工特征,即存在对应的微小RNA*链(经核糖核酸酶III精确切割的互补链),且双链末端具有典型的2nt 3"突出;进化通量分析显示,动物mirtron的进化速率显著高于经典微小RNA,呈现出“快速起源-快速丢失”的动态,而植物微小RNA的进化通量则与其起源模式相关,靶基因反向重复起源的微小RNA进化相对稳定,从头起源的微小RNA则易发生丢失。
文献未提及具体实验产品,领域常规使用高通量测序数据分析软件、微小RNA注释工具等。
4. Biomarker研究及发现成果解析
本研究中涉及的Biomarker为微小RNA进化起源与注释的分子标记,包括植物年轻微小RNA与靶基因的序列同源性、动物年轻微小RNA的低表达量特征、微小RNA/微小RNA*双链作为微小RNA注释的分子标记,这些标记为解析微小RNA的进化动态与可靠注释提供了关键依据。
Biomarker定位:类型分为进化起源标记(植物年轻微小RNA-靶基因同源性、动物年轻微小RNA低表达量)和注释验证标记(微小RNA/微小RNA*双链);筛选/验证逻辑为通过比较基因组学分析不同物种微小RNA的序列保守性,结合高通量测序的表达数据与靶标预测结果,验证标记的特异性与可靠性。
研究过程详述:植物年轻微小RNA的同源性标记来源于靶基因的反向重复序列,验证方法为序列比对分析,特异性表现为年轻微小RNA前体序列与靶基因mRNA存在广泛同源,覆盖微小RNA成熟区域;动物年轻微小RNA的低表达量标记通过高通量测序的表达量分析验证,敏感性表现为年轻微小RNA的表达量显著低于保守微小RNA(文献未明确样本量与P值,基于图表趋势推测);微小RNA/微小RNA双链标记通过高通量测序数据验证,特异性表现为仅经核糖核酸酶III精确加工的微小RNA会产生对应的微小RNA链,且双链末端具有典型的2nt 3"突出,敏感性表现为深度测序可检测到低丰度的微小RNA*链。
核心成果提炼:植物微小RNA的同源性标记可用于追溯其靶基因起源,创新性在于首次系统验证了靶标反向重复模型在植物微小RNA起源中的主导地位;动物微小RNA的低表达量标记可用于鉴定新起源的微小RNA基因,创新性在于揭示了动物微小RNA从头起源的“低表达起始-逐步功能化”模式;微小RNA/微小RNA*双链标记为微小RNA注释提供了严格标准,有效降低了注释的假阳性率,解决了领域内长期存在的微小RNA注释可靠性问题。所有标记的核心功能均围绕微小RNA的进化解析与可靠鉴定,为非编码RNA的进化研究提供了新的工具与思路。
