1. 领域背景与文献引入
文献英文标题:Subretinal gene delivery using helper-dependent adenoviral vectors;发表期刊:Cell & Bioscience;影响因子:未公开;研究领域:视网膜基因治疗(眼科学与分子医学交叉领域)
视网膜作为基因治疗的理想靶器官,具有结构分隔化、局部免疫反应弱、疾病动物模型成熟等独特优势。2008年起,腺相关病毒(AAV)载体在Leber先天性黑蒙等单基因视网膜营养不良疾病的临床试验中取得突破性疗效,成为当前视网膜基因治疗的主流载体。但AAV载体仅4.7kb的克隆容量是核心技术瓶颈,无法携带ABCA4(6.8kb)、CEP290(7.4kb)等大尺寸治疗基因,这类基因缺陷导致的视网膜疾病仍缺乏有效治疗手段。领域共识:开发具有大容量克隆能力、低免疫原性、长期表达特性的新型载体是视网膜基因治疗的关键发展方向。本文针对这一研究空白,系统探索辅助依赖型腺病毒(HD-Ad)载体在小鼠视网膜下腔的递送可行性,为大基因视网膜基因治疗提供新的载体选择。
2. 文献综述解析
作者以“载体类型”为核心分类维度,系统对比了当前视网膜基因治疗领域的主流载体(AAV)与潜在新型载体(HD-Ad)的研究现状。
现有研究中,AAV载体的核心优势在于免疫原性低、转导效率稳定,已在多项临床试验中证实对单基因视网膜疾病的治疗效果,但其4.7kb的克隆容量限制了大基因或长调控元件的递送,即使尝试通过共感染策略递送大基因,也存在依赖靶细胞内重组、表达稳定性不足的局限性。HD-Ad载体则通过删除所有病毒编码基因,仅保留复制和包装必需的ITR和ψ序列,大幅降低了细胞毒性T淋巴细胞(CTL)免疫反应,在肝脏基因治疗中可实现终身稳定表达,但其在视网膜组织尤其是视网膜下腔的递送研究十分有限,转导效率、表达时长及安全性均未得到系统验证。
本文针对HD-Ad载体在视网膜基因治疗中的研究空白,首次系统开展小鼠视网膜下腔HD-Ad递送的实验研究,通过报告基因的长期表达检测、剂量反应分析及组织安全性评估,填补了HD-Ad在视网膜应用领域的关键数据空白,为大基因视网膜疾病的基因治疗提供了新的技术路径。
3. 研究思路总结与详细解析
本文的研究目标是验证HD-Ad载体在小鼠视网膜下腔的递送效率、长期表达能力及安全性,核心科学问题是HD-Ad能否有效转导视网膜色素上皮和光感受器细胞并实现长期稳定表达,技术路线遵循“假设提出→体内实验验证→多维度检测分析→结论总结”的闭环逻辑。
3.1 实验载体制备与动物模型建立
实验目的:构建携带报告基因的HD-Ad载体,并建立符合伦理规范的视网膜基因治疗动物模型。
方法细节:采用HD-Ad-CMV-LacZ载体,该载体以巨细胞病毒(CMV)启动子驱动LacZ报告基因表达,通过pC4HSU载体骨架制备病毒颗粒;选用1月龄雌性CD-1小鼠,严格遵循ARVO动物实验伦理规范,经腹腔注射ketamine与xylazine混合液麻醉,散瞳后进行视网膜下腔注射,每只小鼠右眼注射1μL病毒液,左眼作为阴性对照。
结果解读:成功制备高纯度HD-Ad-CMV-LacZ载体,动物模型麻醉及注射操作规范,术后视网膜脱离可在1周内恢复,为后续实验提供了可靠的载体与模型基础。
实验所用关键产品:Wyeth Animal Health的ketamine、Bayer HealthCare的xylazine、Alcon的散瞳药物组合(0.2% Cyclogyl、0.5% Mydfrin、0.1% Tropicamide)、Charles River Laboratories International的CD-1小鼠。
3.2 报告基因表达的组织学时间-course检测
实验目的:验证HD-Ad载体在视网膜组织中的表达时长及细胞靶向性。
方法细节:在注射后1周、2周、1个月、2个月四个时间点处死小鼠,摘取眼球进行固定、X-gal染色,制作6μm连续切片并经中性红复染,通过光学显微镜观察LacZ报告基因的表达位置与强度。
结果解读:注射后1周即可在视网膜色素上皮层检测到强烈的LacZ表达,少量表达见于光感受器细胞外节近端;至2个月时,表达强度与分布模式仍与1周时无明显差异,阴性对照眼无β-半乳糖苷酶活性。推测:若延长观察时间,HD-Ad载体在视网膜组织的转导表达可能实现更长期的稳定存在,需进一步实验验证。
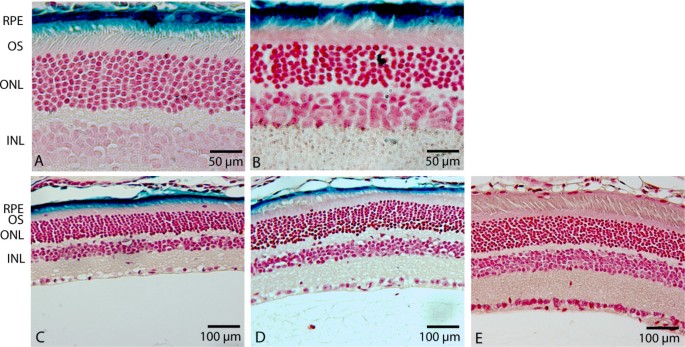
实验所用关键产品:Leica的DM IRB光学显微镜、Fisher Scientific的Permount封片液。
3.3 报告基因表达的剂量反应分析
实验目的:明确HD-Ad载体剂量与视网膜转导效率的相关性。
方法细节:设置1×10^7 vp/μL、1×10^8 vp/μL、1×10^9 vp/μL三个剂量组,注射后2周处死小鼠,进行X-gal组织学染色及β-半乳糖苷酶活性定量检测,通过单因素方差分析(ANOVA)及Bonferroni校正t检验分析组间差异。
结果解读:组织学染色显示,1×10^7 vp/μL组仅在局部视网膜色素上皮细胞检测到零散表达;1×10^8 vp/μL组实现视网膜色素上皮层的广泛稳定表达;1×10^9 vp/μL组则在视网膜色素上皮层及光感受器细胞内外节均检测到强烈表达。定量分析显示,三个剂量组的β-半乳糖苷酶活性存在统计学显著差异(p<0.05),且不同时间点的活性无显著变化(p>0.05),证实HD-Ad载体的视网膜转导效率具有剂量依赖性,且表达水平在观察期内保持稳定,每个时间点每个剂量组样本量为4只小鼠(n=4)。
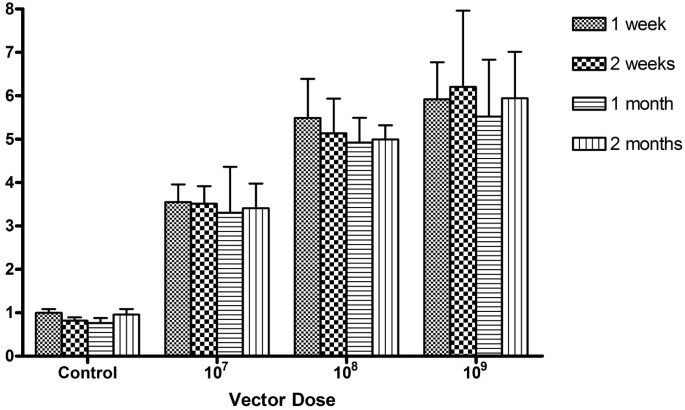
实验所用关键产品:Roche Diagnostics的蛋白酶抑制剂鸡尾酒、β-半乳糖苷酶化学发光检测试剂盒。
3.4 视网膜组织安全性评估
实验目的:验证不同剂量HD-Ad载体递送对视网膜组织的安全性。
方法细节:注射后1周处死小鼠,摘取眼球经X-gal染色后进行苏木精-伊红(H&E)染色,观察视网膜各层的组织形态,评估是否存在炎症、细胞死亡或组织坏死等损伤。
结果解读:三个剂量组的视网膜组织形态均与阴性对照眼无明显差异,未观察到视网膜折叠、颗粒化、细胞死亡或组织坏死等炎症损伤迹象,即使在最高剂量组,眼内空间也未检测到明显免疫反应,证实HD-Ad载体在实验剂量范围内具有良好的视网膜组织安全性。
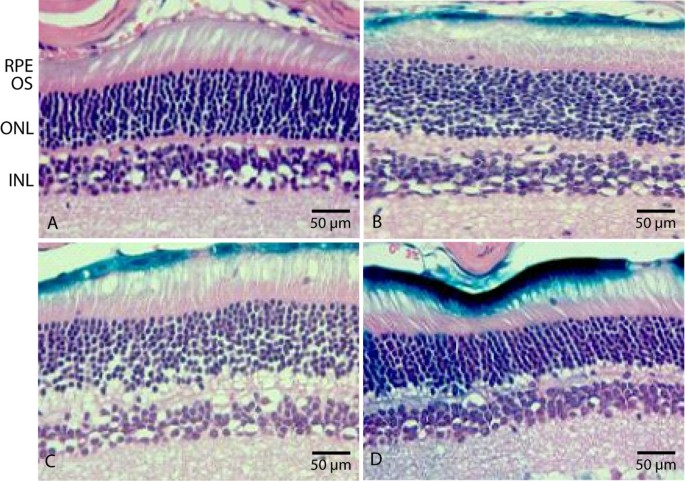
实验所用关键产品:Poly Scientific的苏木精和伊红染色液。
4. Biomarker研究及发现成果
本文以LacZ报告基因为Biomarker,用于指示HD-Ad载体在视网膜组织中的转导效率与表达稳定性,其筛选与验证逻辑遵循“组织学定性检测→酶活定量验证→安全性关联分析”的完整链条。
该Biomarker来源于HD-Ad转导后的小鼠视网膜组织,通过X-gal组织化学染色进行定性定位验证,通过β-半乳糖苷酶活性分析进行定量检测;特异性表现为仅在转导的视网膜色素上皮细胞及部分光感受器细胞中表达,阴性对照组织无活性;敏感性方面,可区分不同剂量组的转导效率差异,三个剂量组的酶活水平均具有统计学显著差异(p<0.05),每个时间点每个剂量组样本量为4只小鼠(n=4)。
核心成果提炼:该Biomarker的检测结果证实,HD-Ad载体可在视网膜组织实现至少2个月的长期稳定表达,转导效率具有剂量依赖性,且无明显组织损伤;其创新性在于首次通过系统的Biomarker检测数据,明确了HD-Ad载体在视网膜下腔递送的可行性与优势,为大基因视网膜疾病的基因治疗提供了关键实验依据;该Biomarker未涉及功能关联的风险比(HR)数据,相关功能研究需进一步开展。
