1. 领域背景与文献引入
文献英文标题:Co-Packaged PARP inhibitor and photosensitizer for targeted photo-chemotherapy of 3D ovarian cancer spheroids;发表期刊:Cell & Bioscience;影响因子:未公开;研究领域:卵巢癌靶向治疗、纳米药物递送、光动力疗法联合治疗
聚ADP核糖聚合酶抑制剂(PARPi)是近十年肿瘤治疗领域的重要突破,2014年首款PARP抑制剂奥拉帕利获FDA批准用于晚期卵巢癌治疗,随后卢卡帕利、尼拉帕利、他拉唑帕利(talazoparib)等相继获批,用于卵巢癌、乳腺癌等多种恶性肿瘤的治疗。其中他拉唑帕利是目前临床活性最强的PARP抑制剂,对PARP-1/2/3/4的半数抑制浓度(IC₅₀)最低,且PARP捕获能力最强,但同时其毒性也最高,最大耐受剂量比其他临床PARP抑制剂低至少300倍,限制了其临床应用。光动力疗法(PDT)通过光激活光敏剂产生活性氧诱导细胞死亡,与PARP抑制剂联合具有协同效应,因为PDT诱导的DNA损伤会被PARP抑制剂放大,进一步抑制DNA修复通路。目前已有研究探索了两者的联合治疗,但多数基于2D细胞模型,无法模拟肿瘤微环境中的耐药演化,且联合递送的纳米制剂制备参数对疗效的影响尚未系统优化,缺乏针对耐药共培养模型的疗效评估。
针对上述领域空白,本研究聚焦于他拉唑帕利的低剂量递送需求与光动力疗法的联合优化,开发了共载他拉唑帕利的聚合物纳米粒,并与表皮生长因子受体(EGFR)靶向的光敏剂-抗体偶联物(PIC)连接,构建靶向共载纳米制剂;同时建立了亲本卵巢癌细胞与耐药亚系的3D荧光共培养模型,系统评估了不同治疗方案的疗效及对耐药细胞亚系演化的选择压力,为卵巢癌的靶向联合治疗提供了新的制剂优化思路和耐药评估模型。
2. 文献综述解析
本文献综述部分按治疗策略的维度,将现有研究分为PARP抑制剂单药治疗、光动力疗法单药治疗、两者联合治疗、纳米药物递送策略四类,系统评述了各策略的优势与局限性,并明确了本研究的创新定位。
PARP抑制剂单药治疗方面,现有研究已证实其在BRCA突变肿瘤中的合成致死效应,他拉唑帕利的抑制活性最强但毒性问题突出,剂量限制毒性成为临床应用的主要障碍;光动力疗法单药治疗方面,其具有时空选择性,可精准诱导局部细胞死亡,但单独应用对实体瘤的穿透性有限,疗效不足;两者联合治疗方面,临床前研究显示协同效应,可增强DNA损伤和细胞毒性,但多数研究基于2D细胞模型,未考虑肿瘤微环境中的耐药演化;纳米药物递送策略方面,现有纳米制剂可提高PARP抑制剂的靶向性、降低毒性,但联合递送PARP抑制剂与光敏剂的制剂设计参数尚未系统优化,且缺乏在3D耐药模型中的疗效评估数据。现有研究的优势在于明确了PARP抑制剂与光动力疗法的协同机制,纳米递送可改善药物药代动力学;局限性在于多数研究未关注治疗对耐药细胞亚系的选择压力,联合递送制剂的疗效可能受制备参数影响,且3D模型的应用不足。
与现有研究相比,本研究的创新点在于首次建立了荧光标记的3D卵巢癌亲本/耐药亚系共培养模型,可实时追踪治疗后的细胞生长动态与耐药演化;系统优化了他拉唑帕利纳米粒的制备参数,包括药物负载量、聚合物比例等,为纳米制剂的规模化制备提供了参考;同时评估了共载制剂与游离联合治疗在3D模型中的疗效差异,揭示了联合递送方式对耐药选择压力的影响,弥补了现有研究在3D耐药模型评估方面的不足,为卵巢癌的靶向联合治疗提供了更贴近临床的实验依据。
3. 研究思路总结与详细解析
本研究的整体研究目标是开发靶向共载他拉唑帕利与光敏剂的纳米制剂,并在3D卵巢癌耐药共培养模型中评估其疗效及对耐药演化的影响;核心科学问题包括纳米制剂制备参数如何影响药物负载与活性,以及联合治疗在3D模型中是否能增强疗效同时避免耐药选择;技术路线遵循“制剂优化→模型建立→疗效评估→耐药分析”的闭环逻辑,先优化纳米制剂的制备参数,再建立3D共培养模型,随后分别评估单药与联合治疗的疗效,最后分析治疗对耐药细胞亚系的选择压力。
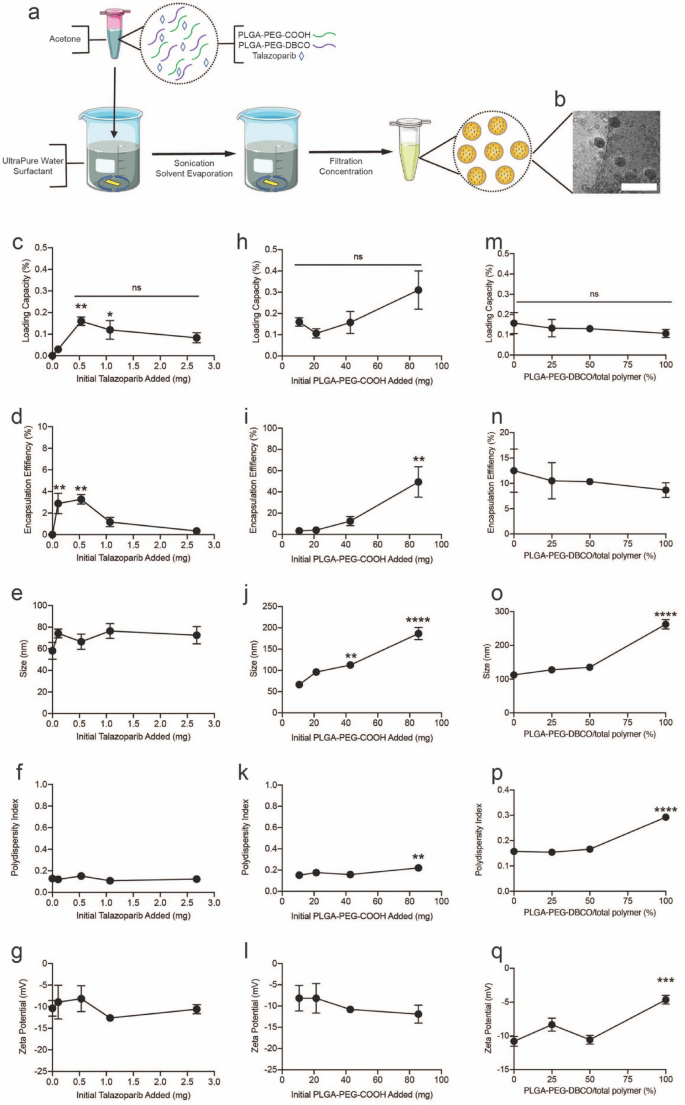
3.1 他拉唑帕利负载纳米粒的制备与优化
实验目的:确定他拉唑帕利负载纳米粒(NP-Tal)的最佳制备参数,提高药物负载率、包封率及制剂稳定性,为后续功能化修饰奠定基础。
方法细节:采用纳米沉淀法制备NP-Tal,分别改变他拉唑帕利初始质量(0、0.107、0.535、1.070、2.675mg)、PLGA-PEG-COOH聚合物质量(10.7、21.4、42.8、85.6mg)、PLGA-PEG-DBCO与PLGA-PEG-COOH的混合比例(0%、25%、50%、100%),总聚合物质量固定为42.8mg;通过荧光法测定纳米粒中他拉唑帕利的浓度,计算负载率(%)、包封率(%);用动态光散射(DLS)测定纳米粒的粒径、多分散性指数(PdI)和zeta电位,并追踪制剂在24周内的稳定性。
结果解读:当他拉唑帕利初始质量为0.535mg时,负载率达到平台期,包封率稳定在约3%(n=3,P<0.01),继续增加药物质量会导致包封率下降;聚合物质量为42.8mg时,包封率最高且PdI稳定在0.16左右,而85.6mg聚合物会导致PdI显著升高至0.22(n=3,P<0.01),稳定性下降;PLGA-PEG-DBCO比例为50%时,纳米粒的粒径、PdI和zeta电位均保持稳定,而100% PLGA-PEG-DBCO组的粒径和PdI在24周内出现显著变化,稳定性较差。最终确定的最佳制备参数为:他拉唑帕利初始质量0.535mg,聚合物质量42.8mg,PLGA-PEG-DBCO比例50%。
实验所用关键产品:PLGA-PEG-COOH、PLGA-PEG-DBCO(PolySciTech),他拉唑帕利(MedChemExpress),Nanobrook Omni动态光散射仪(Brookhaven Instruments),NanoSight LM10纳米颗粒追踪分析仪(Malvern Instruments)。
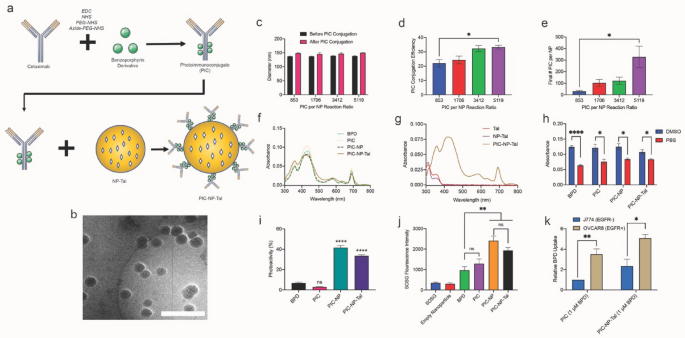
3.2 光敏剂-抗体偶联物的制备与纳米粒功能化表征
实验目的:制备EGFR靶向的光敏剂-抗体偶联物(PIC),并将其连接到NP-Tal表面构建PIC-NP-Tal共载制剂,表征其光物理、光化学性能及靶向摄取能力。
方法细节:采用碳二亚胺法将苯并卟啉衍生物(BPD)与西妥昔单抗(Cetuximab)偶联,制备PIC;通过无铜点击化学将PIC连接到DBCO修饰的NP-Tal表面,优化PIC与纳米粒的体积比(0.5:1、1:1、2:1、3:1);测定制剂的吸收光谱、光活性(水溶液中荧光发射强度与DMSO中的比值)、单线态氧生成量(用Singlet Oxygen Sensor Green探针检测);通过EGFR阳性的OVCAR8细胞与EGFR阴性的J774细胞评估靶向摄取能力,处理30分钟后测定细胞内BPD的荧光强度。
结果解读:PIC-NP-Tal保留了BPD的特征吸收峰(435nm、700nm)和他拉唑帕利的特征吸收峰(312nm);与游离BPD和PIC相比,PIC-NP-Tal的光活性显著提高,分别为33%和42%(PIC-NP),而游离BPD和PIC的光活性均低于7%;单线态氧生成量方面,PIC-NP-Tal的荧光发射强度显著高于游离BPD(n=3,P<0.01),表明其光动力活性更强;靶向摄取实验显示,OVCAR8细胞对PIC-NP-Tal的摄取量是J774细胞的2倍以上(n=3,P<0.05),而PIC的摄取量是J774细胞的3.5倍(n=3,P<0.01),证实了EGFR靶向性。
实验所用关键产品:西妥昔单抗,BPD N-羟基琥珀酰亚胺酯(BPD-NHS),azide-PEG4-NHS(Thermo Scientific),Singlet Oxygen Sensor Green(SOSG,Invitrogen),Pierce™ BCA蛋白检测试剂盒(ThermoFisher Scientific)。
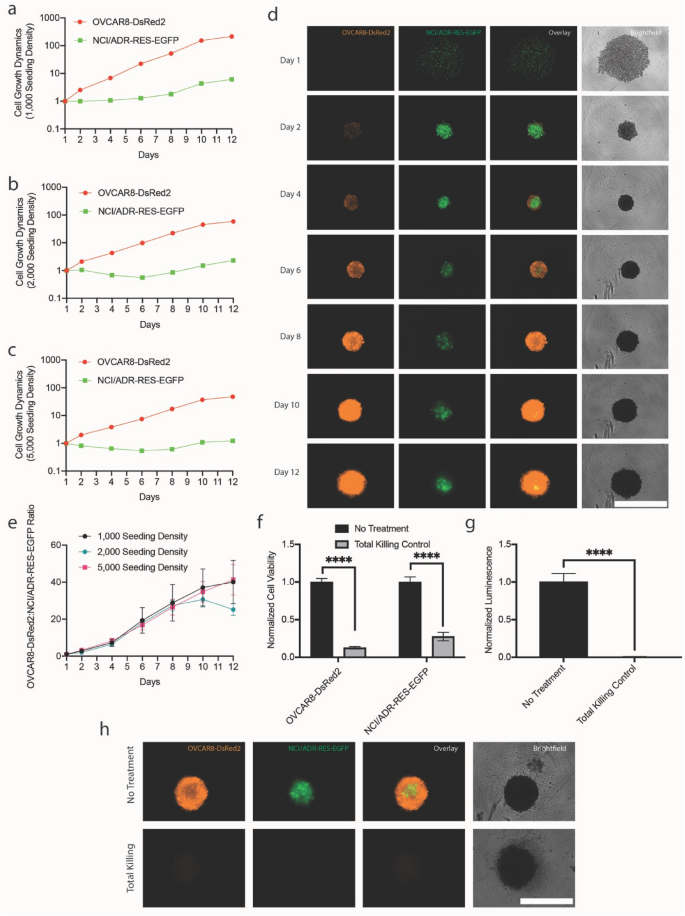
3.3 3D卵巢癌亲本/耐药共培养模型的建立与验证
实验目的:建立可实时追踪的3D荧光共培养模型,模拟卵巢癌的肿瘤微环境,评估治疗对亲本细胞与耐药亚系生长动态的影响。
方法细节:将红色荧光标记的亲本OVCAR8-DsRed2细胞与绿色荧光标记的耐药NCI/ADR-RES-EGFP细胞按1:1比例接种于超低吸附96孔板,接种密度分别为1000、2000、5000细胞/孔;使用Lionheart FX自动显微镜在第1、2、4、6、8、10、12天进行纵向成像,追踪荧光强度变化;用CellTiter-Glo®细胞活力检测试剂盒验证荧光法的活力评估准确性,设置5% bleach处理的总杀伤对照组。
结果解读:亲本细胞的生长速度显著快于耐药亚系,在2000细胞/孔密度下,第12天亲本细胞的荧光强度是第1天的58倍,而耐药亚系仅为2倍;不同接种密度下,亲本与耐药细胞的生长比例(亲本荧光倍数/耐药荧光倍数)保持稳定,第12天分别为40、25、41(1000、2000、5000细胞/孔,n=3,P>0.4);总杀伤对照组中,荧光法检测亲本细胞残留活力为13%,耐药亚系为28%,而CellTiter-Glo®检测活力均低于1%,提示荧光法可用于相对活力评估,残留荧光可能来自自发荧光。最终选择2000细胞/孔的接种密度用于后续治疗实验。
实验所用关键产品:OVCAR8-DsRed2、NCI/ADR-RES-EGFP细胞(来自Dr. Michael M. Gottesman),RPMI-1640培养基(Corning),Lionheart FX Automated Microscope(Biotek),CellTiter-Glo®细胞活力检测试剂盒(Promega)。
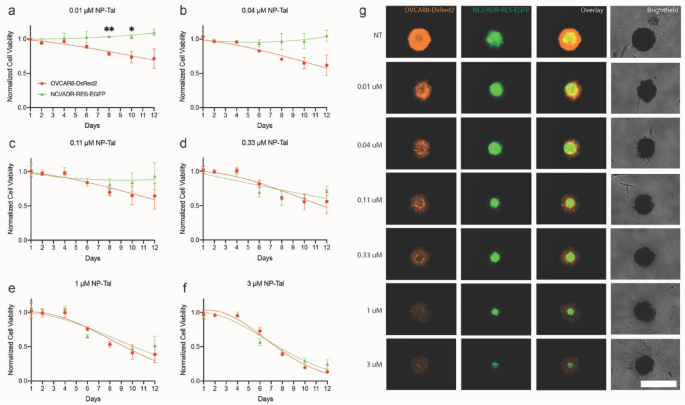
3.4 NP-Tal单药在3D共培养模型中的剂量效应评估
实验目的:评估不同剂量NP-Tal对3D共培养球状体的细胞毒性及对耐药亚系的选择压力。
方法细节:在球状体形成第4天,用0.01、0.04、0.11、0.33、1、3μM的NP-Tal处理,纵向成像至第12天,将各时间点的荧光强度归一化至未处理组,计算亲本细胞与耐药亚系的相对活力;用CellTiter-Glo®检测第12天的总活力。
结果解读:低剂量NP-Tal(0.01μM)仅显著降低亲本细胞的活力,第12天亲本细胞活力约为未处理组的20%,而耐药亚系活力仍保持在80%以上(n=3,P<0.0001),显示出对耐药亚系的选择压力;随着剂量升高,NP-Tal对亲本和耐药细胞的毒性均增强,0.33μM及以上剂量对两者的活力抑制程度相似,3μM处理后第12天亲本细胞活力为14%,耐药亚系为25%(n=3,P<0.0001),无显著选择压力。
实验所用关键产品:NP-Tal(自制),CellTiter-Glo®细胞活力检测试剂盒(Promega)。
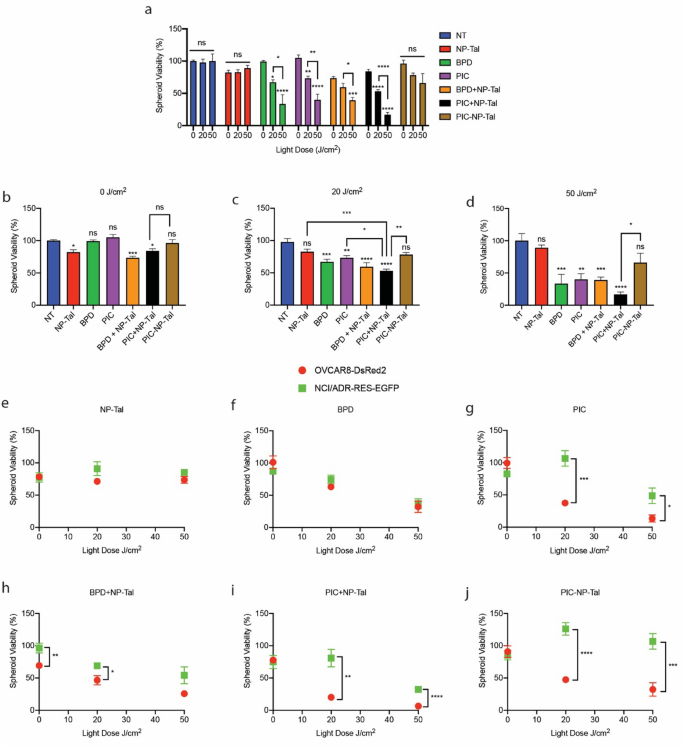
3.5 PIC-NP-Tal及联合治疗在3D模型中的疗效与耐药评估
实验目的:比较PIC-NP-Tal共载制剂与游离联合治疗(PIC+NP-Tal)、单药治疗的疗效,评估各治疗方案对耐药亚系的选择压力。
方法细节:在球状体形成第4天,分别用PIC-NP-Tal、PIC+NP-Tal、BPD+NP-Tal、PIC、BPD、NP-Tal处理,第5天用0、20、50 J/cm²的690nm光照射;第12天用CellTiter-Glo®检测总活力,荧光法检测亲本与耐药细胞的相对活力。
结果解读:总活力分析显示,PIC+NP-Tal联合治疗的疗效显著优于PIC-NP-Tal,在20 J/cm²光剂量下,PIC+NP-Tal处理后球状体活力为53%(n=3,P<0.0001),而PIC-NP-Tal无显著活力降低;在50 J/cm²光剂量下,PIC+NP-Tal处理后球状体活力为17%(n=3,P<0.0001),显著优于PIC-NP-Tal;耐药选择压力分析显示,PIC、BPD+NP-Tal、PIC+NP-Tal、PIC-NP-Tal在20和50 J/cm²光剂量下,耐药亚系的活力均显著高于亲本细胞(n=3,P<0.01),显示出对耐药亚系的选择压力,而NP-Tal和BPD单药在各光剂量下均无显著选择压力。
实验所用关键产品:PIC、PIC-NP-Tal(自制),Modulight 690nm光源(Modulight, Inc.),CellTiter-Glo®细胞活力检测试剂盒(Promega)。
4. Biomarker研究及发现成果
本研究涉及两类Biomarker,一类是作为靶向递送靶点的EGFR,另一类是作为耐药标志物的MDR1(P-糖蛋白),通过3D共培养模型系统评估了各Biomarker与治疗疗效及耐药演化的关联。
EGFR作为靶向Biomarker,基于卵巢癌细胞(OVCAR8)高表达EGFR的特征,通过制备西妥昔单抗偶联的PIC,实现纳米制剂的靶向递送;研究过程中,通过EGFR阳性与阴性细胞的摄取实验,验证了EGFR靶向性,结果显示OVCAR8细胞对PIC-NP-Tal的摄取量显著高于EGFR阴性的J774细胞(n=3,P<0.05)。MDR1作为耐药Biomarker,耐药亚系NCI/ADR-RES-EGFP高表达MDR1,通过3D共培养模型评估不同治疗方案对亲本与耐药细胞的活力影响;研究过程中,低剂量NP-Tal处理后,耐药细胞活力显著高于亲本细胞(n=3,P<0.0001),而联合治疗方案(PIC+NP-Tal、PIC-NP-Tal等)在光激活后,耐药细胞活力也显著高于亲本细胞(n=3,P<0.01),显示出对MDR1高表达细胞的选择压力。
核心成果提炼:EGFR作为靶向Biomarker,可显著提高纳米制剂在卵巢癌细胞中的摄取效率,增强治疗的靶向性,降低对正常细胞的毒性;MDR1作为耐药Biomarker,其高表达的细胞亚系在低剂量PARP抑制剂或光动力联合治疗下会被选择性保留,提示联合治疗可能驱动耐药演化,而高剂量PARP抑制剂可同时杀伤亲本与耐药细胞,无显著选择压力;本研究首次在3D共培养模型中揭示了联合递送方式对耐药选择的影响,共载制剂(PIC-NP-Tal)的疗效不如游离联合治疗,且同样会驱动耐药亚系的选择,为后续联合制剂的优化提供了重要依据。
