1. 领域背景与文献引入
文献英文标题:17-DMAG diminishes hemorrhage-induced small intestine injury by elevating Bcl-2 protein and inhibiting iNOS pathway, TNF-α increase, and caspase-3 activation;发表期刊:Cell & Bioscience;影响因子:未公开;研究领域:创伤与出血性损伤的分子机制及干预策略
出血性休克是临床急危重症,可引发全身炎症反应综合征、多器官功能障碍综合征甚至多器官衰竭,肠道作为对缺血缺氧最敏感的器官之一,出血后易出现黏膜屏障破坏、细胞凋亡等病理改变,进而加重全身炎症反应。现有研究表明,诱导型一氧化氮合酶(iNOS)通路的激活是出血性组织损伤的关键机制,抑制iNOS可减少氧化应激、细胞凋亡及组织损伤;格尔德霉素作为热休克蛋白90(HSP-90)抑制剂,能诱导热休克蛋白70(HSP-70)并抑制iNOS通路,从而减轻出血诱导的器官损伤,但格尔德霉素存在水溶性差、代谢不稳定、需注射给药等局限性,严重限制了其临床转化应用。在此背景下,本文聚焦格尔德霉素的水溶性类似物17-DMAG,探讨其对出血诱导小肠损伤的保护作用及分子机制,旨在为出血性损伤的预防性干预提供安全有效的候选药物。
2. 文献综述解析
作者围绕出血性损伤的分子机制及现有干预策略展开综述,按“损伤机制-现有干预药物的优势与局限”的维度分类评述。现有研究显示,出血通过激活iNOS通路,上调一氧化氮(NO)生成及脂质过氧化,引发氧化应激损伤,同时激活caspase-3介导的细胞凋亡通路,导致组织损伤;iNOS基因敲除或特异性抑制剂处理可显著减轻出血损伤,格尔德霉素通过抑制iNOS通路、诱导HSP-70发挥保护作用,但格尔德霉素的水溶性差、毒性及给药方式限制了其临床应用;此外,HSP-70的诱导可通过抑制iNOS及凋亡通路保护细胞,但出血会显著抑制内源性HSP-70的表达。
本文的创新价值在于,首次验证口服17-DMAG对出血诱导小肠损伤的保护作用,解决了格尔德霉素水溶性差的核心局限,同时明确其通过上调抗凋亡蛋白Bcl-2、抑制iNOS通路、TNF-α释放及caspase-3激活的多靶点保护机制,为出血性损伤的预防性干预提供了新的药物选择及理论依据。
3. 研究思路总结与详细解析
本文的研究目标是明确17-DMAG对出血诱导小鼠小肠损伤的保护作用及分子机制,核心科学问题为17-DMAG如何通过调控iNOS通路、凋亡相关蛋白及细胞因子减轻小肠损伤,技术路线遵循“剂量效应验证-通路分子调控-功能指标检测-组织形态验证”的闭环逻辑,通过体内实验系统验证17-DMAG的保护作用及机制。
3.1 17-DMAG诱导HSP-70的剂量效应验证
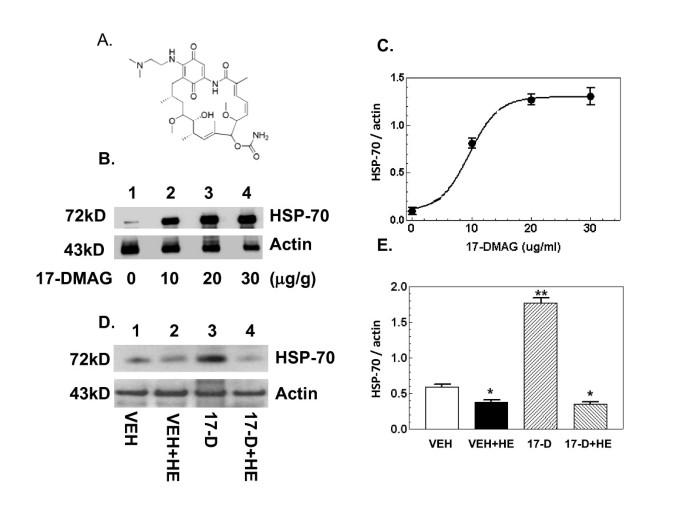
实验目的是确定17-DMAG诱导HSP-70的有效剂量,为后续实验提供给药依据。方法细节为:选取雄性瑞士Webster小鼠,口服给予不同剂量的17-DMAG或溶媒,16小时后进行假出血处理,6小时后取小肠组织,通过蛋白免疫印迹(Western blot)检测HSP-70蛋白表达水平,同时设置单纯出血组及17-DMAG处理后出血组进行对比。结果解读:蛋白免疫印迹结果显示,17-DMAG以剂量依赖方式诱导HSP-70表达,半数有效剂量为10±1μg/g(n=5);单纯出血组的HSP-70水平显著低于假手术组,而17-DMAG处理后出血组的HSP-70水平与单纯出血组无显著差异,提示出血可抑制17-DMAG诱导的HSP-70表达。实验所用关键产品:Bio-Rad蛋白定量试剂、Santa Cruz Biotechnology的HSP70抗体、Amersham Life Science的增强化学发光检测试剂盒。
3.2 17-DMAG对iNOS通路相关分子的调控作用
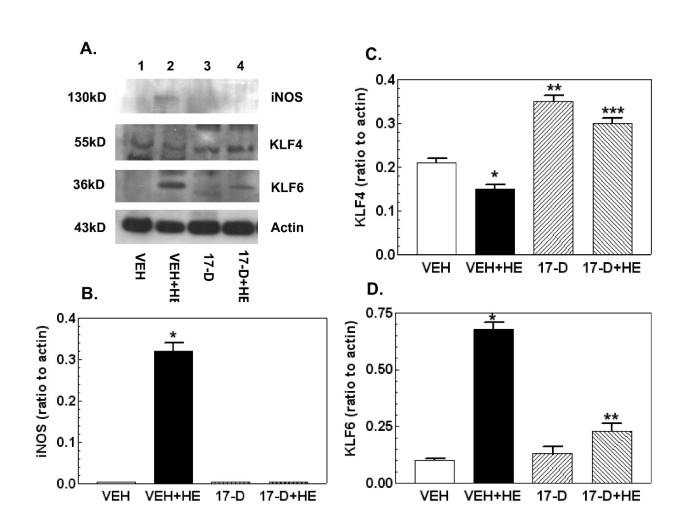
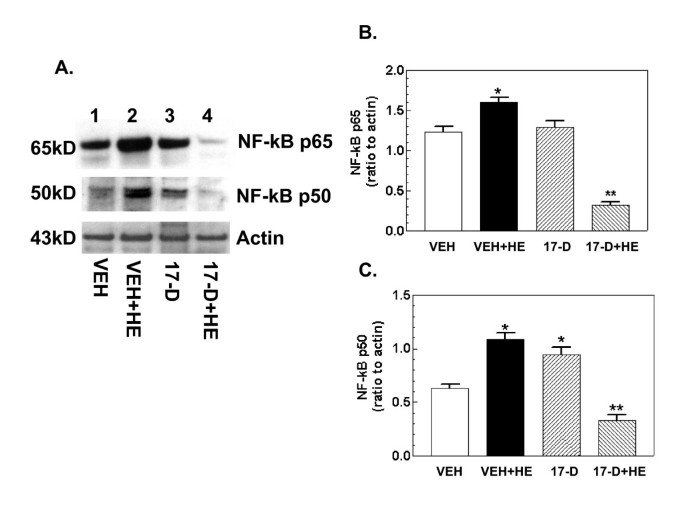
实验目的是验证17-DMAG对出血诱导的iNOS通路激活的抑制作用,明确其上游调控机制。方法细节为:小鼠口服给予10mg/kg 17-DMAG或溶媒,16小时后进行出血处理,6小时后取小肠组织,通过蛋白免疫印迹检测iNOS、Kruppel样因子4(KLF4)、Kruppel样因子6(KLF6)、核因子κB(NF-κB)p65及p50的蛋白表达水平。结果解读:出血处理显著上调iNOS、KLF6、NF-κB p65及p50的蛋白表达,同时下调KLF4表达(n=4-5,P<0.05);17-DMAG处理可完全逆转上述变化,使各分子表达恢复至假手术组水平,提示17-DMAG通过调控iNOS通路的转录因子(NF-κB、KLF4、KLF6)抑制iNOS的激活。实验所用关键产品:BD Signal Transduction的iNOS抗体、Santa Cruz Biotechnology的KLF4、KLF6、NF-κB抗体。
3.3 17-DMAG对氧化应激、能量代谢及细胞因子的影响
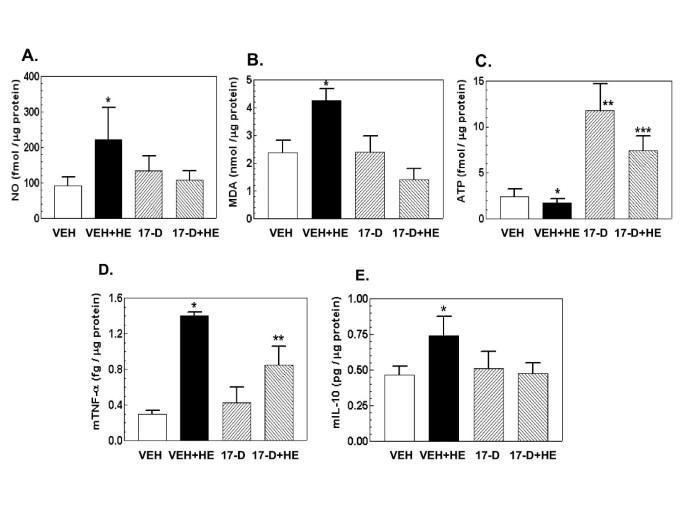
实验目的是检测17-DMAG对出血诱导的氧化应激、能量耗竭及炎症因子释放的调控作用,明确其功能效应。方法细节为:采用试剂盒检测小肠组织中的NO水平、丙二醛(MDA,脂质过氧化产物)水平及细胞ATP含量,通过酶联免疫吸附试验(ELISA)检测肿瘤坏死因子-α(TNF-α)、白细胞介素-10(IL-10)及白细胞介素-6(IL-6)的浓度。结果解读:出血处理显著升高NO、MDA水平,降低细胞ATP含量,同时上调TNF-α、IL-10及IL-6的浓度(n=4-5,P<0.05);17-DMAG处理可显著抑制NO、MDA的升高,恢复细胞ATP水平,降低TNF-α及IL-10的浓度,但对IL-6的浓度无显著影响,提示17-DMAG可减轻出血诱导的氧化应激及能量耗竭,同时调控炎症因子的释放。实验所用关键产品:NO检测试剂盒、CalBiochem的脂质过氧化检测试剂盒、Roche的ATP检测试剂盒、Biocompare的细胞因子ELISA试剂盒。
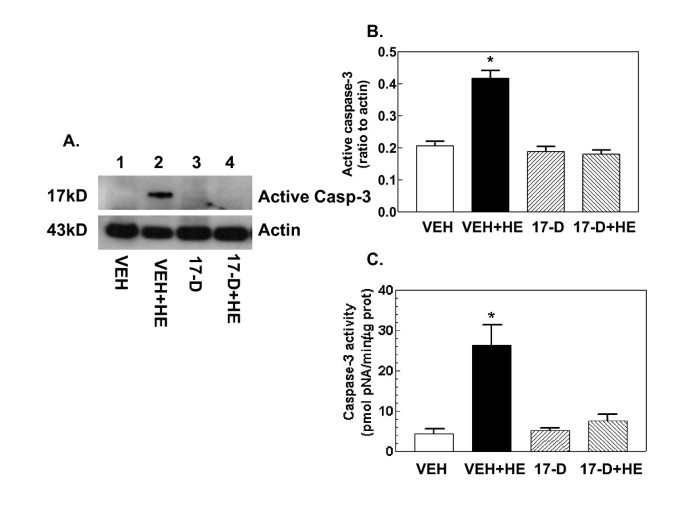
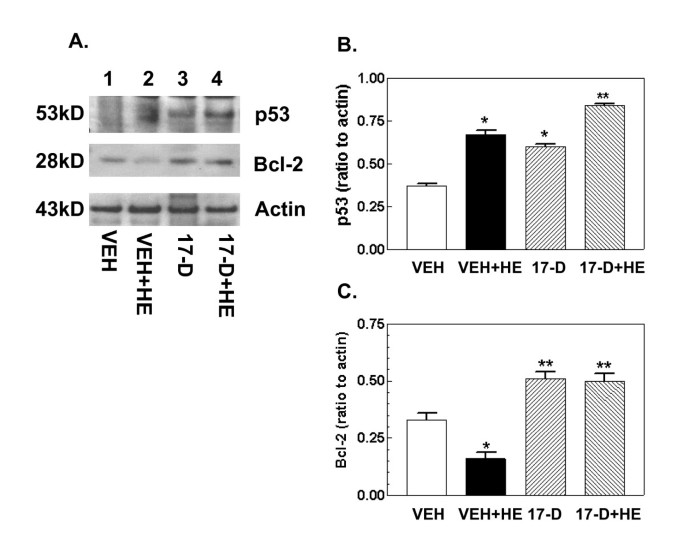
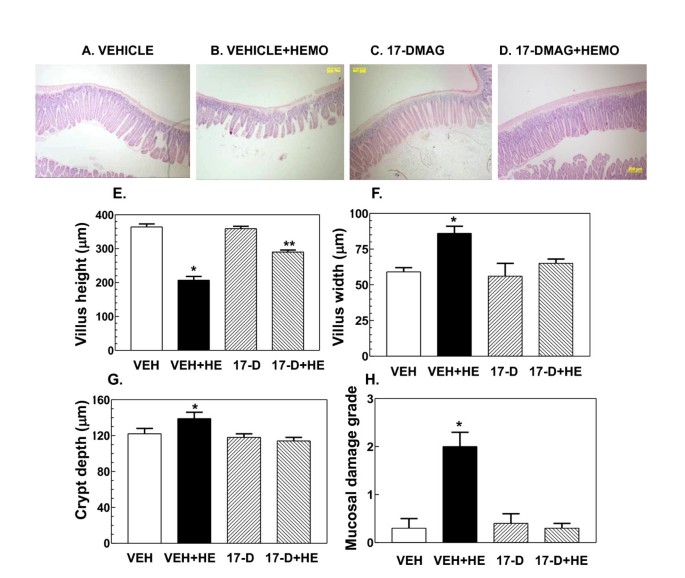
3.4 17-DMAG对凋亡相关蛋白及小肠组织形态的影响
实验目的是验证17-DMAG对出血诱导的细胞凋亡及小肠黏膜损伤的保护作用,明确其最终效应。方法细节为:通过蛋白免疫印迹检测caspase-3、Bcl-2及p53的蛋白表达,采用酶活性检测试剂盒检测caspase-3的活性,同时对小肠组织进行苏木精-伊红(H&E)染色,分析绒毛高度、宽度及黏膜损伤评分。结果解读:出血处理显著激活caspase-3的活性及蛋白表达,下调Bcl-2的表达,上调p53的表达,同时导致小肠绒毛缩短增宽、黏膜损伤评分升高(n=4-5,P<0.05);17-DMAG处理可完全抑制caspase-3的激活,上调Bcl-2的表达,同时显著改善小肠绒毛形态,降低黏膜损伤评分,恢复至假手术组水平,但对p53的上调无显著影响,提示17-DMAG通过上调抗凋亡蛋白Bcl-2、抑制caspase-3激活减轻细胞凋亡,从而保护小肠黏膜结构。实验所用关键产品:Epitomics的caspase-3抗体、Santa Cruz Biotechnology的Bcl-2抗体、苏木精-伊红染色试剂。
4. Biomarker研究及发现成果
本文涉及的Biomarker包括iNOS、KLF4、KLF6、NF-κB p65/p50、Bcl-2、caspase-3、TNF-α等,筛选逻辑基于出血诱导的信号通路及功能变化,通过体内实验验证17-DMAG对这些Biomarker的调控作用,明确其与小肠损伤的关联。
Biomarker的来源为出血及17-DMAG处理后的小鼠小肠组织样本,验证方法包括蛋白免疫印迹(检测蛋白表达水平)、ELISA(检测细胞因子浓度)、酶活性检测(caspase-3活性)及组织病理学分析,特异性方面,17-DMAG可特异性逆转出血诱导的iNOS、KLF6、NF-κB、TNF-α、caspase-3的异常上调及KLF4、Bcl-2的异常下调,敏感性方面,各Biomarker的变化在n=4-5的样本中均具有统计学显著性(P<0.05)。
核心成果为,明确Bcl-2的上调及iNOS通路、caspase-3的抑制是17-DMAG保护小肠损伤的关键机制,首次证明口服17-DMAG可作为出血性小肠损伤的预防性干预药物,为出血性损伤的临床防治提供了新的Biomarker靶点及药物选择,其中Bcl-2可作为出血性损伤的保护型Biomarker,iNOS、caspase-3可作为损伤型Biomarker及干预靶点。
