1. 领域背景与文献引入
文献英文标题:Induction of ER stress-mediated apoptosis by ceramide via disruption of ER Ca²⁺ homeostasis in human adenoid cystic carcinoma cells;发表期刊:Cell Bioscience;影响因子:未公开;研究领域:肿瘤学-头颈部肿瘤-腺样囊性癌治疗机制
腺样囊性癌是头颈部常见的高度侵袭性恶性肿瘤,具有易复发、远处转移率高的特点,传统手术联合放化疗的治疗方案难以有效改善患者长期预后,亟需探索新的治疗靶点与作用机制。内质网应激是细胞应对蛋白折叠异常、钙稳态失衡等内外界刺激的重要适应性反应,适度的内质网应激可通过未折叠蛋白反应(UPR)维持细胞稳态,而持续或严重的内质网应激则会激活凋亡信号通路诱导细胞死亡,近年来已成为肿瘤治疗的潜在干预靶点。神经酰胺作为鞘脂类家族的核心分子,已被证实可通过多种通路诱导肝癌、乳腺癌等多种肿瘤细胞凋亡,但其在腺样囊性癌中的具体作用机制尚未完全阐明,尤其是通过内质网应激途径调控细胞凋亡的分子机制仍存在研究空白,本研究正是针对这一问题展开系统探究。
2. 文献综述解析
作者围绕内质网应激的调控通路、神经酰胺与内质网应激的关联研究两大维度对现有研究进行综述,明确了内质网应激在肿瘤细胞命运调控中的双重作用,以及神经酰胺作为凋亡调控分子的研究现状。现有研究表明,内质网应激的UPR通路包含IRE1α、PERK、ATF6三个核心分支,适度激活可通过增强蛋白折叠能力、抑制蛋白合成等方式维持细胞存活,而过度激活则会通过下游CHOP、JNK等分子诱导细胞凋亡;神经酰胺作为细胞内重要的第二信使,可通过调控鞘脂代谢平衡影响细胞增殖与凋亡,部分研究发现内源性神经酰胺可通过ATF6/CHOP通路诱导内质网应激,但外源性神经酰胺对腺样囊性癌细胞内质网应激的调控作用及具体机制尚未见报道。现有研究的局限性在于,多数聚焦于内源性神经酰胺的调控效应,缺乏外源性神经酰胺在腺样囊性癌中的系统研究,且对其通过钙稳态调控内质网应激的机制探讨不足。本研究的创新价值在于首次明确外源性神经酰胺可通过抑制SERCA活性、破坏内质网钙稳态,进而激活PERK/eIF2α和IRE1α/XBP1通路诱导内质网应激介导的腺样囊性癌细胞凋亡,弥补了外源性神经酰胺在该领域的研究空白,为腺样囊性癌的治疗提供了新的潜在靶点。
3. 研究思路总结与详细解析
本研究的研究目标是明确外源性神经酰胺诱导人腺样囊性癌细胞凋亡的具体分子机制,核心科学问题为神经酰胺是否通过内质网应激途径诱导腺样囊性癌细胞凋亡,以及其调控内质网应激的关键分子机制,技术路线遵循“假设提出→细胞模型验证内质网应激激活→分子机制探究→凋亡通路验证→抑制剂干预验证”的完整闭环,通过多层面实验系统阐明了神经酰胺的作用机制。
3.1 内质网应激激活的初步验证
实验目的:验证外源性神经酰胺是否可时间和剂量依赖性诱导腺样囊性癌细胞的内质网应激。
方法细节:采用人腺样囊性癌细胞系ACC-M和ACC-2,分别用10μM、50μM、100μM的细胞渗透性短链C2-神经酰胺处理6h、12h,同时以经典内质网应激诱导剂衣霉素(3μg/ml)和毒胡萝卜素(1-10μM)作为阳性对照;通过逆转录聚合酶链反应(RT-PCR)结合PstI酶切检测XBP1 mRNA剪接情况,实时荧光定量聚合酶链反应(Real-time PCR)定量分析XBP1剪接体的表达变化,蛋白质免疫印迹(Western blot)检测磷酸化eIF2α(p-eIF2α)和内质网分子伴侣GRP78的表达水平。
结果解读:RT-PCR结果显示,100μM神经酰胺处理6h后,XBP1剪接体(XBP1_S)的表达显著增加,处理12h后该效应进一步增强;Real-time PCR证实XBP1剪接呈时间和剂量依赖性上调(n=3,P<0.05);蛋白质免疫印迹结果显示,100μM神经酰胺处理3h后p-eIF2α表达显著升高,处理6h后GRP78 mRNA表达显著增加,12h后表达进一步上调,表明神经酰胺可时间和剂量依赖性激活腺样囊性癌细胞的内质网应激。
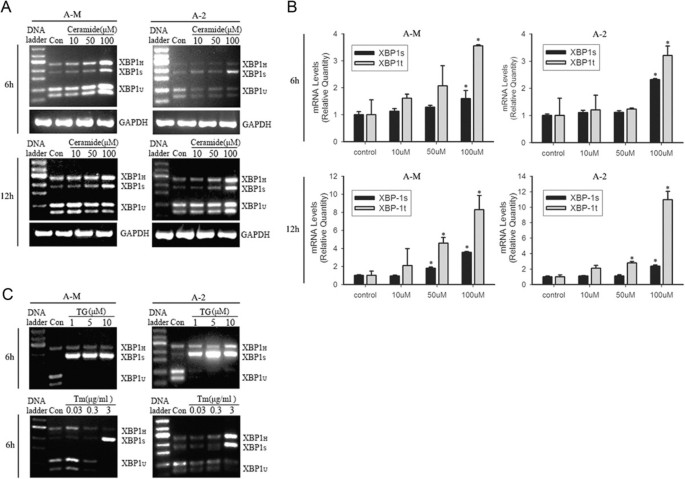
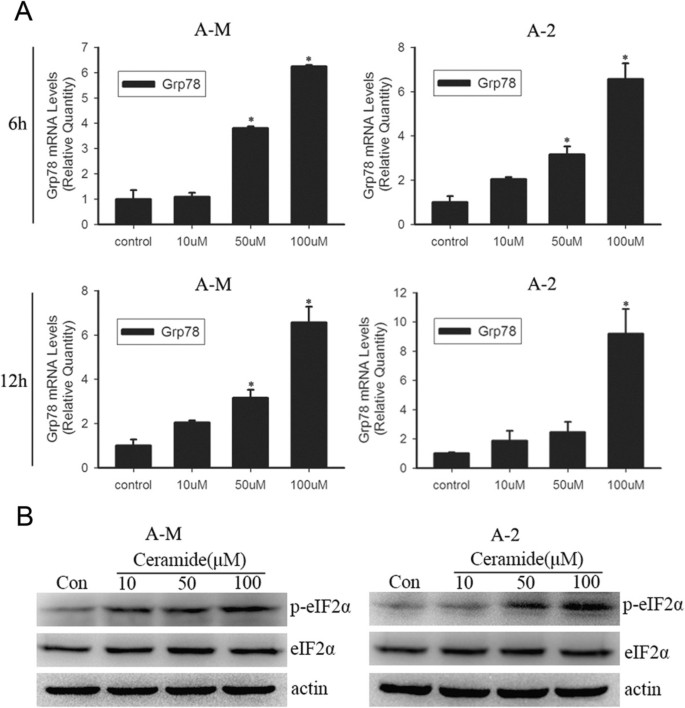
实验所用关键产品:C2-神经酰胺(Avanti Polar Lipid)、衣霉素、毒胡萝卜素(Sigma-Aldrich)、p-eIF2α抗体、eIF2α抗体(Cell Signaling Technology)、GRP78检测引物(定制合成)等。
3.2 神经酰胺合成酶抑制剂对内质网应激的干预验证
实验目的:验证神经酰胺诱导的内质网应激是否依赖内源性神经酰胺合成通路。
方法细节:用20μM神经酰胺合成酶抑制剂FB1预处理ACC-M和ACC-2细胞3h,随后加入100μM神经酰胺继续处理12h;通过RT-PCR检测XBP1 mRNA剪接情况,蛋白质免疫印迹检测p-eIF2α的表达水平。
结果解读:RT-PCR结果显示,FB1预处理可完全阻断神经酰胺诱导的XBP1剪接;蛋白质免疫印迹结果显示FB1可显著抑制神经酰胺诱导的eIF2α磷酸化,表明神经酰胺诱导的内质网应激依赖内源性神经酰胺合成通路,内源性神经酰胺的合成是该过程的必要环节。
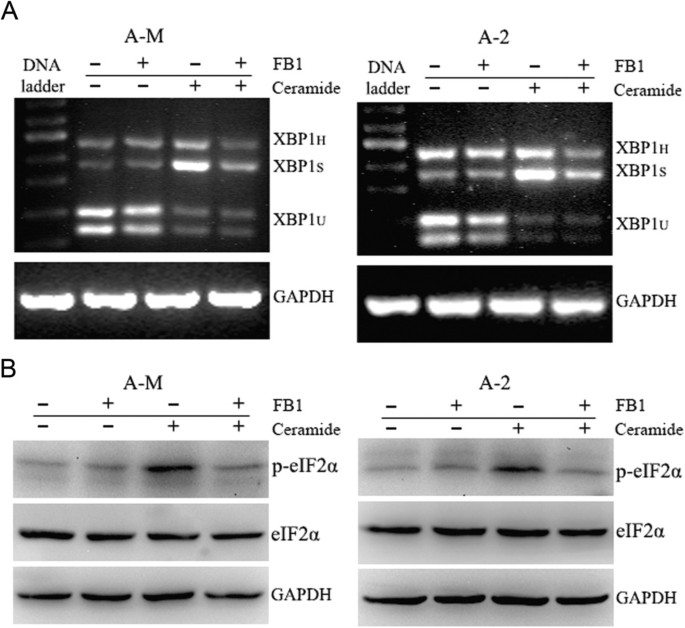
实验所用关键产品:FB1(Sigma-Aldrich)。
3.3 内质网钙稳态与SERCA调控机制探究
实验目的:明确神经酰胺诱导内质网应激的分子机制是否与内质网钙稳态破坏及SERCA活性抑制有关。
方法细节:采用钙敏感荧光探针Fluo 4-AM负载细胞,通过共聚焦激光扫描显微镜实时观察100μM神经酰胺处理后细胞内钙浓度的动态变化;用Real-time PCR检测100μM神经酰胺处理12h后SERCA2α、SERCA2β、SERCA3的mRNA表达水平。
结果解读:共聚焦显微镜结果显示,100μM神经酰胺处理后细胞内荧光强度显著升高,表明内质网中的钙离子大量释放至细胞质,内质网钙库耗竭;Real-time PCR结果显示,神经酰胺处理后SERCA2α、SERCA2β、SERCA3的mRNA表达均显著下调(n=3,P<0.05),表明神经酰胺通过抑制SERCA的表达,减少细胞质钙向内质网的转运,进而破坏内质网钙稳态,最终诱导内质网应激。
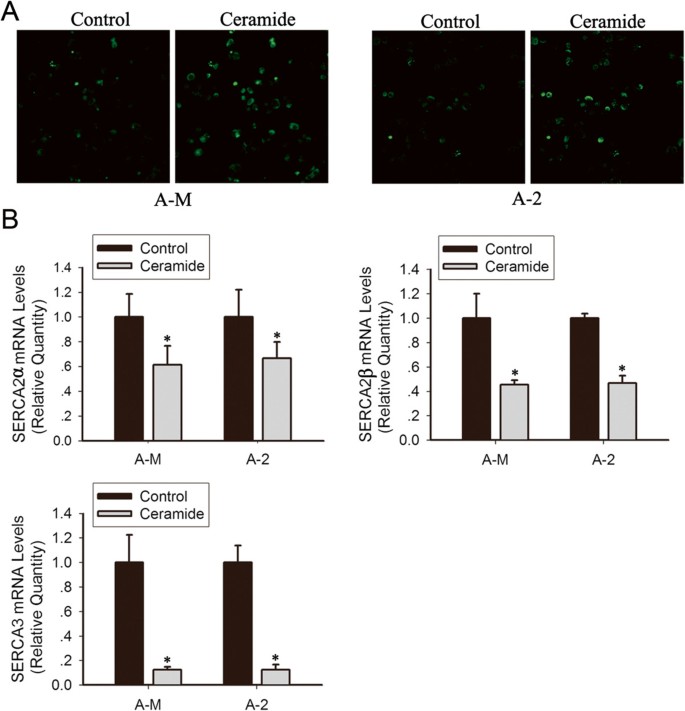
实验所用关键产品:Fluo 4-AM(Dojindo Laboratories)、SERCA家族检测引物(定制合成)等。
3.4 化学伴侣对内质网应激及细胞凋亡的干预验证
实验目的:验证内质网应激在神经酰胺诱导的腺样囊性癌细胞凋亡中的核心作用,并明确化学伴侣的干预效应。
方法细节:用5mM 4-苯基丁酸(4-PBA)或1mg/ml牛磺熊去氧胆酸(TUDCA)预处理细胞3h,随后加入100μM神经酰胺处理;通过RT-PCR检测XBP1 mRNA剪接情况,蛋白质免疫印迹检测p-eIF2α、磷酸化JNK(p-JNK)、切割的caspase-3的表达水平,克隆形成实验检测细胞存活情况。
结果解读:RT-PCR和蛋白质免疫印迹结果显示,TUDCA预处理可显著抑制神经酰胺诱导的XBP1剪接和eIF2α磷酸化,而4-PBA仅具有轻微抑制作用;蛋白质免疫印迹结果显示,100μM神经酰胺处理12h后p-JNK和切割的caspase-3表达显著增加,TUDCA预处理可显著逆转该效应;克隆形成实验显示,神经酰胺可显著诱导细胞死亡,TUDCA预处理可显著抑制神经酰胺的细胞毒性,表明神经酰胺通过内质网应激介导腺样囊性癌细胞凋亡,TUDCA可有效缓解该过程。
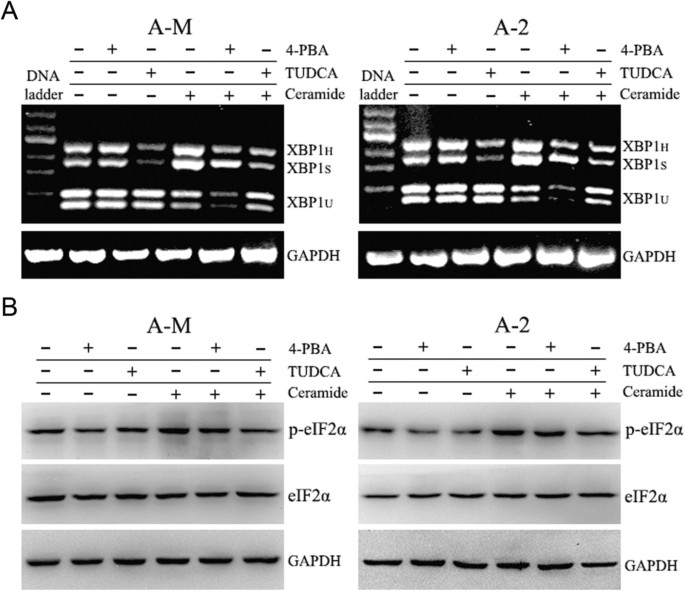
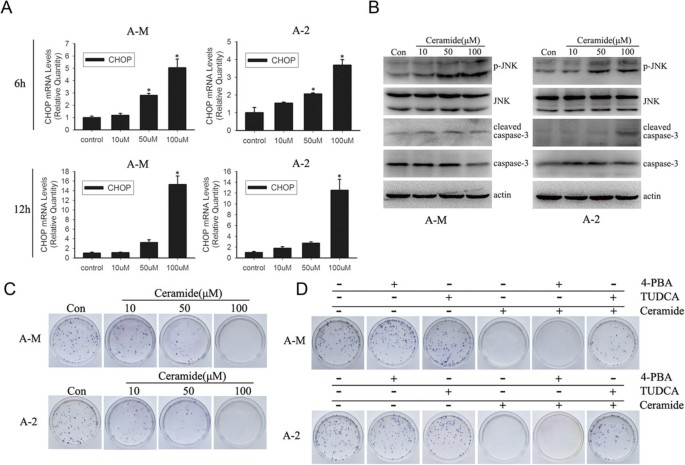
实验所用关键产品:TUDCA(Calbiochem)、4-PBA(Sigma-Aldrich)、p-JNK抗体(Abcam)、caspase-3抗体(Abgent)等。
3.5 神经酰胺下游代谢产物S1P的作用验证
实验目的:明确神经酰胺诱导的内质网应激是否依赖其下游代谢产物1-磷酸鞘氨醇(S1P)。
方法细节:用5μM、10μM的S1P处理ACC-M和ACC-2细胞,通过蛋白质免疫印迹检测p-eIF2α和磷酸化ERK(p-ERK)的表达水平。
结果解读:蛋白质免疫印迹结果显示,S1P处理可显著诱导ERK磷酸化,但对eIF2α磷酸化无显著影响,表明神经酰胺诱导的内质网应激独立于其下游代谢产物S1P,其效应由神经酰胺自身直接介导。
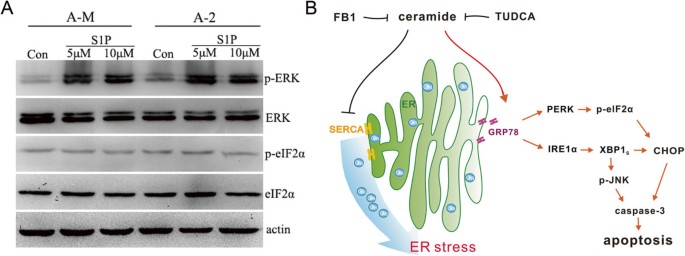
实验所用关键产品:S1P(Sigma-Aldrich)、p-ERK抗体、ERK抗体(Cell Signaling Technology)等。
4. Biomarker研究及发现成果
本研究未涉及传统意义上的疾病诊断或预后Biomarker筛选,而是鉴定了神经酰胺作为腺样囊性癌治疗的潜在靶点分子,同时明确了内质网应激通路相关分子(GRP78、p-eIF2α、XBP1_S、CHOP、p-JNK)可作为神经酰胺治疗效应的验证Biomarker。
Biomarker定位:神经酰胺作为潜在的治疗靶点Biomarker,其筛选逻辑基于已有的神经酰胺诱导肿瘤细胞凋亡的研究基础,通过细胞模型验证其在腺样囊性癌中的效应;内质网应激通路相关分子作为治疗效应验证Biomarker,其验证逻辑为“神经酰胺处理→内质网应激激活→分子表达变化→抑制剂干预后表达逆转”的完整链条。
研究过程详述:神经酰胺的来源为外源性细胞渗透性短链C2-神经酰胺,通过细胞模型验证其可时间和剂量依赖性诱导腺样囊性癌细胞的内质网应激及凋亡;内质网应激相关分子的验证方法包括Real-time PCR检测GRP78、CHOP的mRNA表达,蛋白质免疫印迹检测p-eIF2α、p-JNK的蛋白表达,RT-PCR检测XBP1_S的剪接情况,其中GRP78 mRNA在100μM神经酰胺处理12h后表达显著上调(n=3,P<0.05),CHOP mRNA表达显著上调(n=3,P<0.05),p-eIF2α蛋白表达显著上调(n=3,P<0.05),具有良好的特异性和敏感性。
核心成果提炼:本研究的核心成果在于首次明确外源性神经酰胺可通过抑制SERCA活性、破坏内质网钙稳态,进而激活PERK/eIF2α和IRE1α/XBP1通路诱导内质网应激介导的腺样囊性癌细胞凋亡,神经酰胺可作为腺样囊性癌治疗的潜在靶点;内质网应激通路相关分子可作为评估神经酰胺治疗效果的潜在Biomarker,其表达变化可直接反映神经酰胺的作用效应,为腺样囊性癌的治疗提供了新的方向和验证指标。
