1. 领域背景与文献引入
文献英文标题:Honokiol improved chondrogenesis and suppressed inflammation in human umbilical cord derived mesenchymal stem cells via blocking nuclear factor-κB pathway;发表期刊:BMC Cell Biol;影响因子:未公开;研究领域:骨关节炎的干细胞治疗与抗炎策略。
骨关节炎(OA)是一种以关节软骨进行性降解为核心特征的慢性炎症性疾病,其发病与炎症细胞因子(如白细胞介素-1β,IL-1β)诱导的软骨细胞凋亡、细胞外基质(ECM)降解密切相关。现有治疗以非甾体抗炎药(NSAIDs)或糖皮质激素缓解疼痛为主,但无法逆转软骨损伤;间充质干细胞(MSCs)因具备多向分化潜能(可分化为软骨细胞),成为软骨修复的潜在“种子细胞”。然而,OA病变部位的炎症微环境(如高浓度IL-1β)会显著抑制MSCs的存活能力,下调软骨分化相关基因(如SRY相关高迁移率族盒9,SOX-9;聚集蛋白聚糖,aggrecan;II型胶原α1链,col2α1)表达,并促进ECM降解酶(如基质金属蛋白酶,MMPs)分泌,导致干细胞治疗效果不佳。此外,传统抗炎药存在胃肠道、心血管副作用,限制了长期应用。和厚朴酚(Honokiol)是从木兰科植物中提取的天然化合物,既往研究表明其可通过抑制核因子-κB(NF-κB)通路发挥抗炎作用,且副作用较小,但尚未明确其对人脐带间充质干细胞(hUC-MSCs)在IL-1β刺激下的软骨分化能力及炎症反应的影响。
本研究针对“IL-1β诱导的炎症微环境抑制hUC-MSCs存活与软骨分化”这一核心问题,探讨和厚朴酚是否能通过阻断NF-κB通路改善hUC-MSCs的存活状态、保护其软骨分化潜能并抑制炎症反应,为OA的“干细胞+抗炎”联合治疗策略提供实验依据。
2. 文献综述解析
作者通过“干细胞治疗OA的挑战”“传统抗炎药的局限性”“和厚朴酚的抗炎机制”三大维度梳理现有研究:
现有研究表明,MSCs(包括hUC-MSCs)是软骨修复的理想种子细胞,但OA病灶的炎症微环境(如IL-1β)会诱导MSCs凋亡、抑制软骨分化基因表达、促进ECM降解酶分泌;传统抗炎药(如NSAIDs、糖皮质激素)虽能抑制炎症,但存在严重副作用;和厚朴酚作为天然产物,可通过抑制NF-κB通路发挥抗炎作用,但尚未在hUC-MSCs中研究。
现有研究的局限性:缺乏针对hUC-MSCs在炎症环境下的联合治疗研究,和厚朴酚对hUC-MSCs软骨分化的保护作用及机制不明确。
本研究的创新点:首次探讨和厚朴酚对IL-1β刺激下hUC-MSCs存活、软骨分化及炎症反应的影响,并揭示其通过NF-κB通路发挥作用的机制,填补了“天然抗炎产物对hUC-MSCs在炎症环境下功能调控”的研究空白。
3. 研究思路总结与详细解析
本研究以“和厚朴酚对IL-1β刺激下hUC-MSCs的保护作用及机制”为核心,采用“细胞分离鉴定→多分化潜能验证→剂量筛选→功能评估→机制探究”的闭环技术路线,逐步揭示和厚朴酚的作用及分子通路。
3.1 hUC-MSCs的分离与鉴定
实验目的:从人脐带组织中分离hUC-MSCs,并验证其干细胞特性(表面标志物及多分化潜能)。
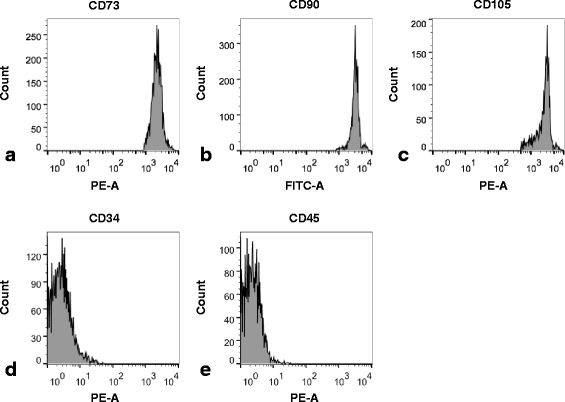
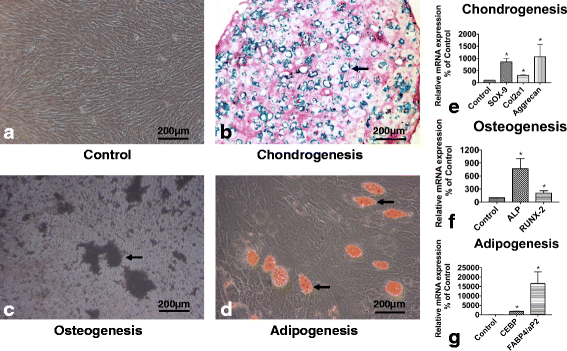
方法细节:收集健康足月新生儿脐带(n=6),去除血管后剪碎,用Liberase酶消化获得细胞悬液,采用α-MEM培养基培养至第2代;通过流式细胞术检测表面标志物(CD73、CD90、CD105阳性,CD34、CD45阴性);采用pellet培养法诱导软骨分化(阿尔新蓝染色)、von Kossa染色诱导成骨分化、油红O染色诱导成脂分化,并通过实时定量聚合酶链反应(qRT-PCR)检测分化相关基因(软骨分化:SOX-9、aggrecan、col2α1;成骨分化:碱性磷酸酶,ALP;Runt相关转录因子2,RUNX-2;成脂分化:CCAAT增强子结合蛋白,CEBP;脂肪酸结合蛋白4,FABP4)的表达。
结果解读:流式细胞术显示hUC-MSCs高表达CD73、CD90、CD105(阳性率均>95%),低表达CD34、CD45(阳性率<2%)(图1);多分化诱导结果显示,软骨分化组pellet经阿尔新蓝染色呈阳性,成骨组出现von Kossa阳性矿化结节,成脂组出现油红O阳性脂滴;qRT-PCR结果显示,软骨分化组SOX-9、aggrecan、col2α1的mRNA表达分别为对照组的8.6倍(n=9,P=9.65×10^-5)、10倍(n=9,P=6.4×10^-4)、3倍(n=9,P=2×10^-3)(图2)。
实验所用关键产品:流式抗体(CD73-PE、CD90-FITC等)来自Santa Cruz;Liberase酶来自Roche;qRT-PCR试剂来自Roche。
3.2 和厚朴酚的细胞毒性及抗炎剂量筛选
实验目的:确定和厚朴酚对hUC-MSCs的安全浓度范围,筛选抑制IL-1β诱导炎症反应的最佳剂量。
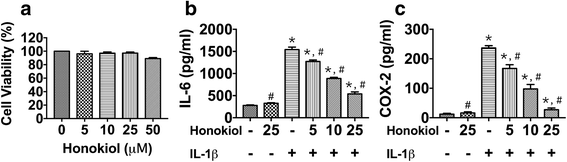
方法细节:将第2代hUC-MSCs接种于96孔板(2×10^4细胞/cm²),分别加入0、5、10、25、50μM和厚朴酚培养24小时,采用四甲基偶氮唑盐(MTT)法检测细胞活力;随后将细胞分为对照组、IL-1β组(10ng/ml IL-1β)、和厚朴酚处理组(5、10、25μM和厚朴酚+10ng/ml IL-1β),培养24小时后采用酶联免疫吸附试验(ELISA)检测上清液中IL-6、COX-2的分泌水平。
结果解读:MTT结果显示,5-25μM和厚朴酚对hUC-MSCs活力无显著影响(P>0.05),而50μM和厚朴酚会降低细胞活力(活力为对照组的75%,n=6,P<0.01);ELISA结果显示,IL-1β组IL-6、COX-2分泌水平显著高于对照组(分别为对照组的4.2倍、3.1倍,n=6,P<0.01),而和厚朴酚以剂量依赖方式抑制其分泌——25μM和厚朴酚处理后,IL-6分泌量仅为IL-1β组的34.9%(n=6,P=2.94×10^-11),COX-2为11.6%(n=6,P=2.42×10^-13)(图3)。
实验所用关键产品:和厚朴酚、IL-1β来自Sigma-Aldrich;MTT试剂来自Sigma-Aldrich;ELISA试剂盒来自R&D System。
3.3 和厚朴酚对hUC-MSCs存活的影响
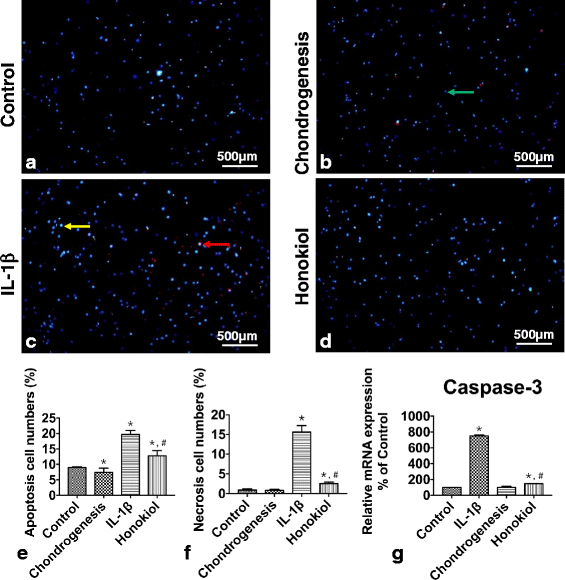
实验目的:评估和厚朴酚对IL-1β诱导的hUC-MSCs凋亡/坏死的保护作用。
方法细节:将hUC-MSCs分为对照组、软骨分化组(软骨诱导培养基)、IL-1β组(10ng/ml IL-1β)、和厚朴酚组(25μM和厚朴酚+10ng/ml IL-1β),培养2周后采用Hoechst 33342/碘化丙啶(PI)双染法检测细胞凋亡/坏死(凋亡细胞呈蓝色荧光,坏死细胞呈红色荧光),并通过qRT-PCR检测caspase-3的mRNA表达。
结果解读:双染结果显示,IL-1β组凋亡细胞(19.71%)和坏死细胞(15.63%)显著高于对照组(8.99%、0.91%,n=3,P<0.01);而和厚朴酚组凋亡(12.75%)和坏死(2.5%)显著降低(n=3,P<0.01)(图4);qRT-PCR结果显示,IL-1β组caspase-3表达为对照组的7.5倍(n=9,P=5.15×10^-9),而和厚朴酚组仅为IL-1β组的19%(n=9,P=3.06×10^-9)。
实验所用关键产品:Hoechst 33342/PI试剂盒来自Beyotime;qRT-PCR试剂来自Roche。
3.4 和厚朴酚对hUC-MSCs软骨分化的保护作用
实验目的:检测和厚朴酚对IL-1β抑制的hUC-MSCs软骨分化潜能的恢复作用。
方法细节:采用qRT-PCR检测各组细胞中SOX-9、aggrecan、col2α1的mRNA表达,通过免疫荧光染色检测col2α1蛋白的表达(一抗为兔抗人collagen II单抗,二抗为Alexa Fluor 488标记的羊抗兔IgG)。
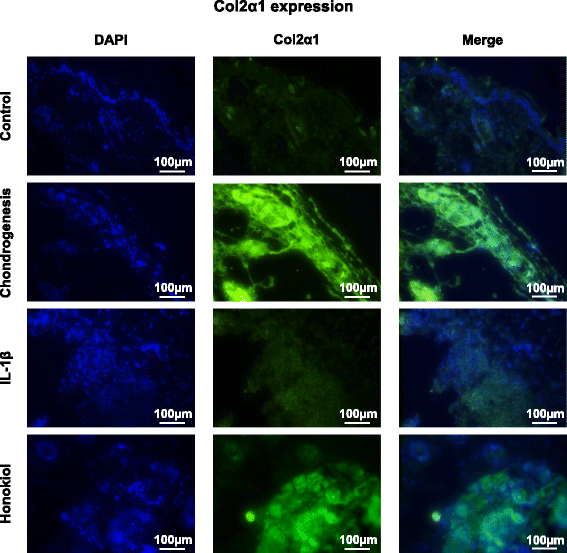
结果解读:qRT-PCR结果显示,软骨分化组SOX-9、aggrecan、col2α1表达显著高于对照组(分别为对照组的1.8倍、1.7倍、3.7倍,n=9,P<0.01);IL-1β组上述基因表达显著降低(SOX-9为软骨分化组的61%,n=9,P<0.01);而和厚朴酚组SOX-9、aggrecan、col2α1表达较IL-1β组分别上调30%、10%、30%(n=9,P<0.05);免疫荧光结果显示,col2α1蛋白在和厚朴酚组呈强绿色荧光(图6)。
实验所用关键产品:collagen II单抗来自Abcam;Alexa Fluor 488二抗来自Molecular Probes。
3.5 和厚朴酚对炎症及ECM降解的抑制作用
实验目的:探究和厚朴酚对IL-1β诱导的炎症因子及ECM降解酶的抑制效果。
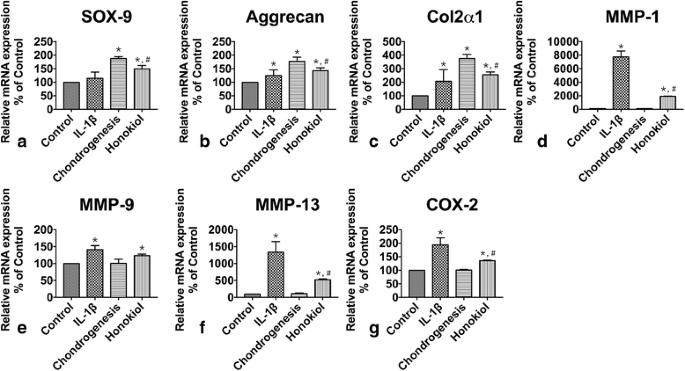
方法细节:采用qRT-PCR检测各组细胞中MMP-1、MMP-9、MMP-13及COX-2的mRNA表达。
结果解读:IL-1β组MMP-1、MMP-13表达显著高于对照组(分别为对照组的77倍、13倍,n=9,P<0.01),MMP-9表达为对照组的1.4倍(n=9,P<0.05);和厚朴酚组MMP-1、MMP-13表达较IL-1β组分别降低76%、61%(n=9,P<0.01),MMP-9表达降低13%(P>0.05);此外,IL-1β组COX-2表达为对照组的1.9倍(n=9,P<0.01),和厚朴酚组COX-2表达较IL-1β组降低30%(n=9,P<0.01)(图5)。
实验所用关键产品:qRT-PCR引物根据文献设计(表2)。
3.6 和厚朴酚对NF-κB通路的抑制作用
实验目的:验证和厚朴酚是否通过抑制NF-κB通路发挥保护作用。
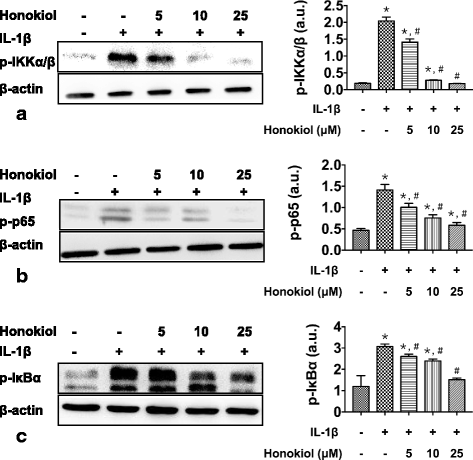
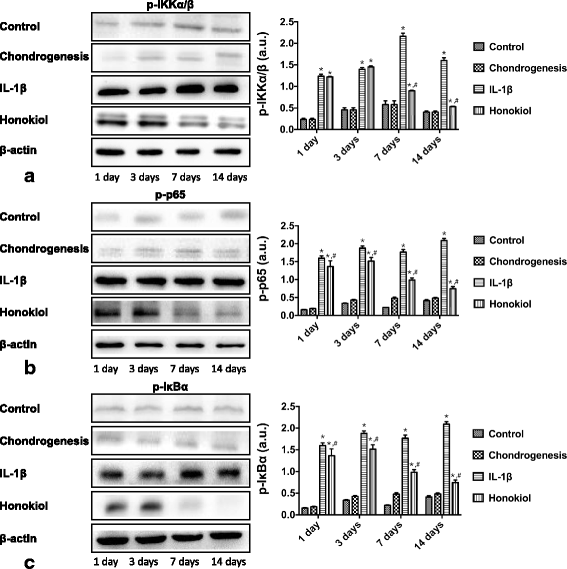
方法细节:设置剂量依赖实验(0、5、10、25μM和厚朴酚+10ng/ml IL-1β)和时间依赖实验(25μM和厚朴酚+10ng/ml IL-1β,培养1、3、7、14天),采用蛋白质免疫印迹法(Western blot)检测细胞中磷酸化IKKα/β(p-IKKα/β)、磷酸化IκBα(p-IκBα)、磷酸化p65(p-p65)的蛋白水平(内参为β-actin)。
结果解读:Western blot结果显示,IL-1β组p-IKKα/β、p-IκBα、p-p65水平显著高于对照组(分别为对照组的3.5倍、2.8倍、2.1倍,n=9,P<0.01);和厚朴酚以剂量依赖方式降低上述蛋白的磷酸化水平——25μM和厚朴酚处理后,p-IKKα/β、p-IκBα、p-p65水平分别为IL-1β组的20%、25%、30%(n=9,P<0.01)(图7);时间依赖实验显示,和厚朴酚处理后,上述蛋白水平随时间延长逐渐降低,14天处理后仅为IL-1β组的15%、18%、22%(n=9,P<0.01)(图8)。
实验所用关键产品:Western blot抗体(p-IKKα/β、p-IκBα、p-p65、β-actin)来自Santa Cruz;ECL底物来自Thermo-Fisher Scientific。
4. Biomarker研究及发现成果解析
本研究围绕OA病理中的关键分子,鉴定了一系列与和厚朴酚作用相关的Biomarker,并揭示其调控逻辑:
Biomarker定位与筛选逻辑
① 软骨分化相关Biomarker:SOX-9、aggrecan、col2α1(基因/蛋白层面),基于“软骨分化是hUC-MSCs修复软骨的核心能力”筛选;
② 炎症反应相关Biomarker:IL-6、COX-2(蛋白分泌/基因表达),基于“IL-1β诱导的炎症反应是抑制hUC-MSCs功能的关键因素”筛选;
③ ECM降解相关Biomarker:MMP-1、MMP-9、MMP-13(基因层面),基于“ECM降解是OA软骨损伤的核心病理”筛选;
④ NF-κB通路Biomarker:p-IKKα/β、p-IκBα、p-p65(蛋白磷酸化层面),基于“NF-κB通路是炎症反应的关键信号通路”筛选。
研究过程与结果
Biomarker均来自hUC-MSCs细胞样本(n=6-9):
- 软骨分化Biomarker:SOX-9在和厚朴酚组的表达较IL-1β组上调30%(n=9,P<0.05),col2α1蛋白通过免疫荧光显示在和厚朴酚组呈强阳性;
- 炎症Biomarker:IL-6在和厚朴酚组的分泌量较IL-1β组降低65.1%(n=6,P<0.01),COX-2基因表达降低30%(n=9,P<0.01);
- ECM降解Biomarker:MMP-1、MMP-13基因表达较IL-1β组分别降低76%、61%(n=9,P<0.01);
- NF-κB通路Biomarker:p-IKKα/β在25μM和厚朴酚处理后较IL-1β组降低80%(n=9,P<0.01),p-p65降低70%(n=9,P<0.01)。
核心成果
这些Biomarker的变化共同表明:和厚朴酚通过抑制NF-κB通路,同步实现三大功能——① 保护hUC-MSCs的存活能力(降低凋亡/坏死率);② 维持hUC-MSCs的软骨分化潜能(上调SOX-9、col2α1等基因表达);③ 抑制炎症反应及ECM降解(降低IL-6、COX-2分泌,抑制MMPs表达)。其创新性在于:首次在hUC-MSCs中揭示和厚朴酚通过调控NF-κB通路,为OA的“干细胞+天然抗炎产物”联合治疗提供了直接的分子证据。例如,和厚朴酚对MMP-1的抑制率高达76%,表明其能有效减少ECM降解,为hUC-MSCs的软骨分化提供适宜微环境;而p-IKKα/β等通路Biomarker的显著降低,明确了和厚朴酚的作用机制,为后续药物靶点研究奠定基础。
