1. 领域背景与文献引入
文献英文标题:Mutant Fam20c knock-in mice recapitulate both lethal and non-lethal human Raine Syndrome;发表期刊:BMC Molecular and Cell Biology;影响因子:未明确;研究领域:骨骼发育与代谢异常(雷恩综合征病理机制)。
雷恩综合征(Raine Syndrome,OMIM:259775)是由FAM20C基因缺陷引起的罕见常染色体隐性遗传病,核心特征是骨骼发育异质性——部分患者表现为致命性骨硬化性骨发育不良(出生后数周内死亡,伴严重骨密度增加),另一部分则为非致命性低磷血症佝偻病(存活至成年,伴骨矿化障碍)。FAM20C是定位于高尔基体的丝氨酸激酶,负责磷酸化约70%的分泌型磷蛋白(如骨基质蛋白DMP1、代谢因子FGF23),其缺陷会破坏骨骼矿化与全身磷代谢平衡。然而,现有小鼠模型仅模拟了非致命性低磷血症佝偻病表型,无法重现致命性骨硬化,导致FAM20C缺陷引发表型异质性的机制始终未明——这是领域未解决的核心问题。本研究通过构建携带非致命性雷恩综合征Fam20c突变(D446N)的敲入小鼠模型,首次同时重现了两种表型,为解析雷恩综合征的表型异质性提供了关键工具。
2. 文献综述解析
文献综述的核心评述逻辑为“功能-疾病-模型局限-研究需求”:
作者首先综述FAM20C的基础功能——作为分泌通路的关键激酶,通过识别“S-X-E”基序磷酸化分泌型磷蛋白,参与骨骼形成、矿化及全身代谢;接着阐述人类雷恩综合征的表型异质性,强调FAM20C缺陷是致病根源,但两种表型的分子机制差异未知;随后总结现有研究的局限性:传统Fam20c敲除或转基因小鼠仅能模拟低磷血症佝偻病,且随机转基因插入可能导致副作用,无法准确反映人类突变的真实影响;最后提出本研究的必要性——构建条件性Fam20cD446N敲入小鼠模型(避免随机插入副作用),探索Fam20c缺陷对骨骼的局部(Col1a1-Cre介导骨骼特异性敲入)和整体(Hprt-Cre介导全身性敲入)影响,解析表型异质性的机制。
现有研究的关键结论包括:①FAM20C缺陷通过增加FGF23半衰期(抑制其 cleavage)和降低DMP1表达(破坏骨基质矿化),共同导致低磷血症佝偻病;②致命性骨硬化的机制未被探讨,且缺乏在体模型验证。文献的创新价值在于:首次构建了贴近人类突变的Fam20cD446N敲入模型,同时重现了致命性骨硬化和非致命性佝偻病两种表型,突破了传统模型的局限性。
3. 研究思路总结与详细解析
本研究的整体框架为“模型构建-表型分析-机制验证”:研究目标是构建Fam20cD446N敲入小鼠,模拟人类雷恩综合征的两种表型;核心科学问题是Fam20cD446N突变如何导致表型异质性;技术路线为“构建条件性敲入allele→生成两种敲入小鼠→多维度表型分析→验证FGF23/DMP1通路作用”。
3.1 条件性Fam20cD446N敲入allele构建
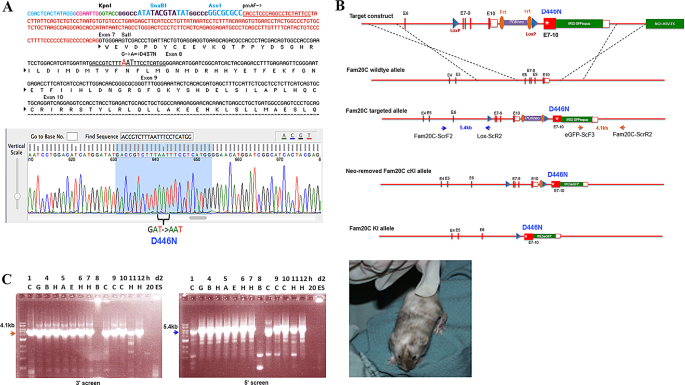
实验目的是构建携带D446N突变的Fam20c条件性敲入allele,避免传统转基因的随机插入副作用。
方法细节:通过基因靶向技术,将Fam20c外显子7-10替换为含D446N突变(编码序列“gat”→“aat”,天冬氨酸→天冬酰胺)的cDNA序列,两侧插入loxP位点(用于后续Cre介导的组织特异性敲入);靶向载体包含5.4kb 5’同源臂、4.1kb 3’同源臂(确保同源重组准确性)、Frt-flanked neo cassette(阳性筛选)和MC1-HSV-TK cassette(阴性筛选,排除随机整合);线性化后转染W4 ES细胞,通过PCR筛选正确靶向的克隆(5’端扩增5.4kb片段,3’端扩增4.1kb片段),再通过Flp重组酶去除neo cassette,最终注射到C57BL/6囊胚生成嵌合鼠。
结果解读:PCR验证13个ES克隆发生正确靶向,其中2个克隆(5A、10C)获得种系传递,成功构建Fam20cD446N-flox allele(基因型PCR显示527bp片段,野生型为432bp)。
实验所用关键产品:pCAGGS-flpEpuro载体(Addgene,用于去除neo cassette)、W4 ES细胞、C57BL/6囊胚。
3.2 条件性与常规性敲入小鼠生成
实验目的是生成组织特异性(骨骼)和全身性Fam20cD446N敲入小鼠,分别模拟局部和整体Fam20c缺陷。
方法细节:①条件性敲入小鼠:将Fam20cD446N-flox/+小鼠与3.6Kb Col1a1-Cre转基因小鼠(Col1a1启动子驱动Cre在成骨细胞中表达)交配,获得Col1a1-Cre; Fam20cD446N-flox/+,再与Fam20cD446N-flox/+交配,得到Col1a1-Cre; Fam20cD446N-flox/flox(骨骼特异性敲入);②常规性敲入小鼠:将Fam20cD446N-flox/+雄性与Hprt-Cre雌性(Jackson Laboratory,货号004302,Cre在受精卵中表达)交配,利用Cre重组酶去除loxP侧翼序列,获得Fam20cD446N-KI allele,再交配得到Fam20cD446N-KI/KI(全身性敲入)。
结果解读:基因型PCR显示,条件性敲入allele为527bp,常规性敲入allele为374bp,成功生成两种敲入小鼠。
实验所用关键产品:Col1a1-Cre转基因小鼠、Hprt-Cre小鼠(Jackson Laboratory)。
3.3 小鼠生长发育与骨骼影像学分析
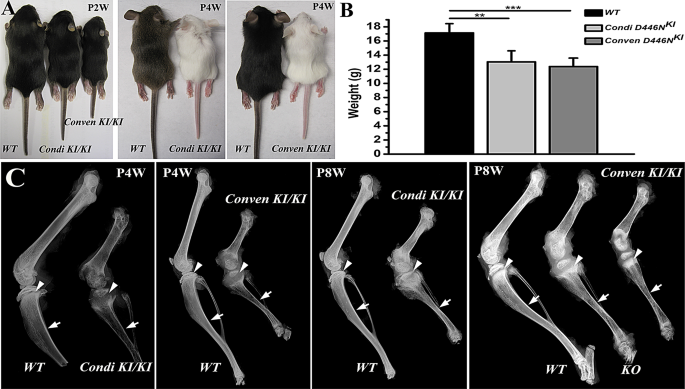
实验目的是评估敲入小鼠的生长迟滞和骨骼表型差异。
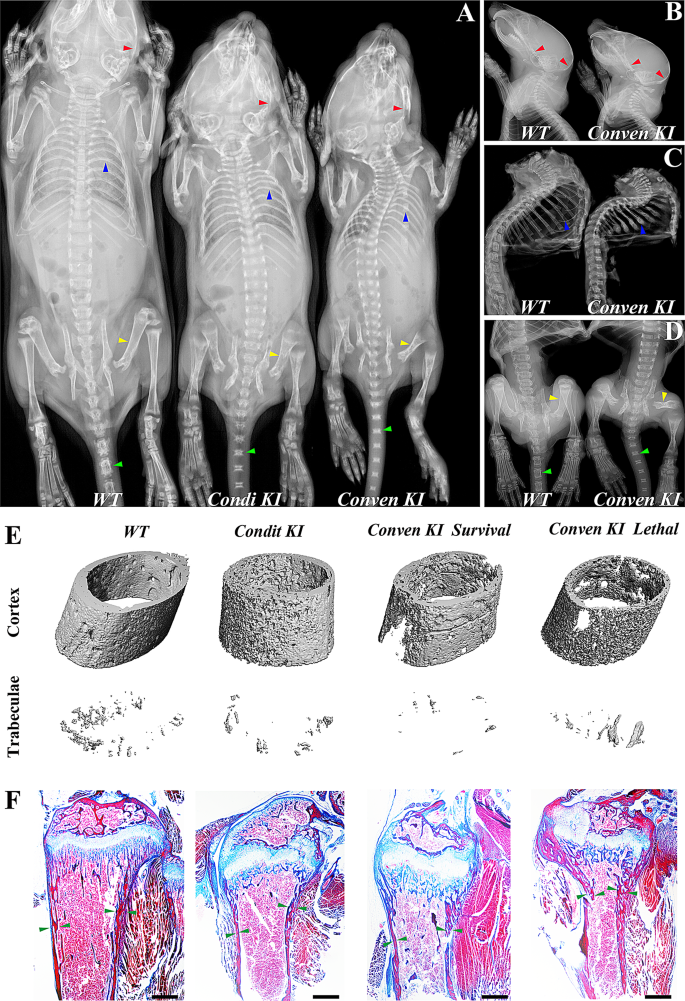
方法细节:记录出生后2周(P2W)、4周(P4W)、8周(P8W)小鼠的体重(仅雄性,避免性别差异);通过Faxitron MX-20DC12 X射线机拍摄骨骼X线片,观察骨骼形态;用SCANCO Medical µCT系统扫描胫骨,用NRecon v1.6和CTAn v1.13.8.1软件重建,分析骨密度、皮质孔隙率等参数。
结果解读:与野生型(WT)相比,两种敲入小鼠在P2W即出现生长迟滞,P4W体重显著降低(WT:17.14±1.30 g;条件性:13.04±1.57 g;常规性:12.38±1.20 g,n=每组至少6只,P<0.01);X线显示P4W敲入小鼠股骨/胫骨缩短、生长板增宽、皮质变薄(典型佝偻病特征),P8W仍有骨密度降低;约5%的常规性敲入小鼠在P1-P3W死亡,X线显示其颅骨基底、肋骨、股骨呈“骨硬化”(高反光),但micro-CT显示其胫骨皮质孔隙增加、骨密度降低——提示骨硬化是矿化纤维异常沉积的假象,而非真正的骨密度增加。
实验所用关键产品:Faxitron MX-20DC12 X射线机、SCANCO Medical µCT系统、NRecon/CTAn软件。
3.4 组织学与血清生化机制验证
实验目的是验证FGF23/DMP1通路在表型中的作用。
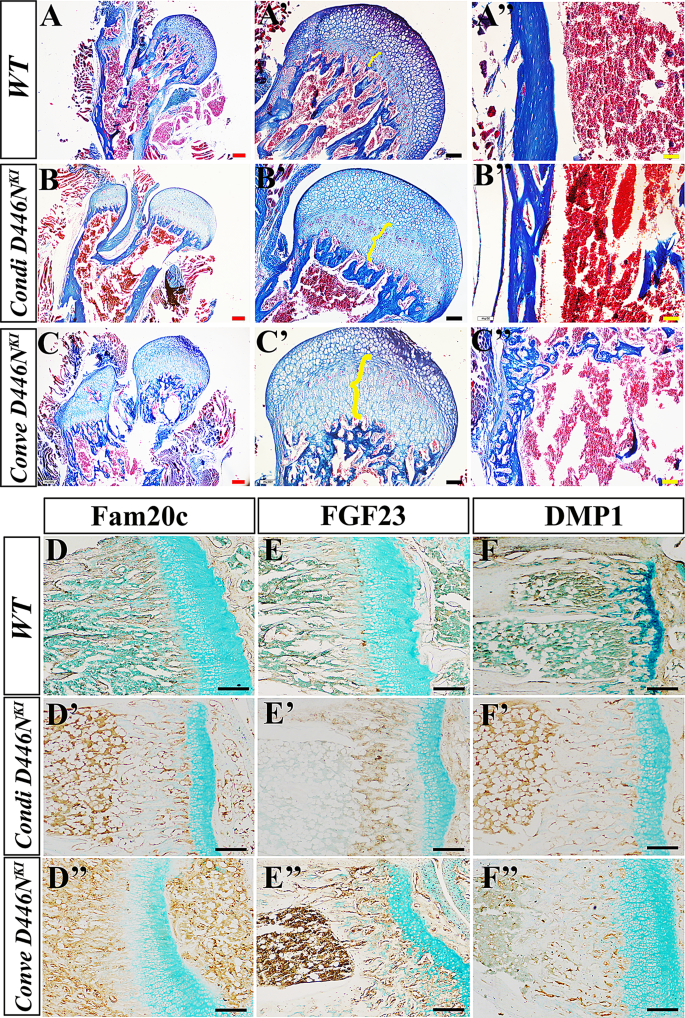
方法细节:①组织学:P4W小鼠股骨固定于4%多聚甲醛,15% EDTA脱钙2周,石蜡包埋后切10μm切片,行Masson染色(观察软骨和骨结构);②免疫组化:用Fam20c、FGF23、DMP1抗体染色,ABC试剂盒(Vector Laboratories)放大信号,DAB试剂盒(Vector Laboratories)显色,甲基绿复染;③血清生化:眼眶静脉取血分离血清,ELISA(Kainos Laboratories)检测FGF23水平,比色法(Stanbio Laboratory)检测磷、钙浓度。
结果解读:Masson染色显示,敲入小鼠生长板增殖软骨细胞减少、肥大软骨细胞柱延长,皮质骨孔隙显著增加;免疫组化显示,Fam20c表达与WT无差异(敲入不影响蛋白表达),但FGF23表达显著升高(常规性>条件性>WT),DMP1表达显著降低(常规性敲入小鼠几乎无染色);血清生化验证:敲入小鼠FGF23水平显著升高(常规性敲入:约150pg/mL vs WT:约30pg/mL,n=每组8只,P<0.001),磷浓度降低(敲入:约1.2mmol/L vs WT:约2.0mmol/L,P<0.01),钙浓度正常——完全符合低磷血症佝偻病的生化特征。
实验所用关键产品:FGF23 ELISA试剂盒(Kainos Laboratories)、磷/钙检测试剂盒(Stanbio Laboratory)、Fam20c/FGF23/DMP1抗体、ABC/DAB试剂盒(Vector Laboratories)。
4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
本研究的核心Biomarker为血清FGF23(全身磷代谢指标)和骨组织DMP1(骨骼矿化指标),均属于功能型生物标志物。筛选逻辑基于FAM20C缺陷的已知机制:①FAM20C通过磷酸化FGF23的Ser180抑制其降解,缺陷会导致FGF23累积;②FAM20C促进DMP1表达,缺陷会破坏骨基质矿化。
研究过程详述
- 血清FGF23:来自P4W小鼠血清,通过双抗体夹心ELISA定量,检测范围0-500pg/mL,批内变异系数<5%;
- 骨组织DMP1:来自股骨石蜡切片(脱钙后包埋),免疫组化染色(一抗1:200稀释,4℃孵育过夜),通过染色强度(阳性细胞比例)评估表达水平。
特异性与敏感性:血清FGF23在敲入小鼠中显著升高,与表型严重程度正相关(常规性敲入>条件性敲入>WT),统计差异显著(P<0.01);DMP1在常规性敲入小鼠中几乎缺失,条件性敲入小鼠显著降低,能有效区分佝偻病表型与正常骨骼。
核心成果提炼
- FGF23是低磷血症佝偻病的关键生物标志物:敲入小鼠血清FGF23水平与佝偻病严重程度正相关,且常规性敲入小鼠FGF23水平高于Fam20c敲除小鼠——提示突变型Fam20c(D446N)更易导致FGF23累积;
- DMP1是骨骼矿化异常的标志:DMP1表达降低与骨皮质孔隙增加、矿化不良直接相关,常规性敲入小鼠几乎无DMP1表达,表型更严重;
- 创新性发现:致命性骨硬化表型的小鼠仍存在FGF23升高和DMP1降低——证明骨硬化是佝偻病基础上的继发性改变(矿化纤维异常沉积),而非独立表型。
这些成果不仅为雷恩综合征的早期诊断提供了可靠的生物标志物,更揭示了FAM20C缺陷导致表型异质性的核心机制——FGF23/DMP1通路的异常程度决定表型严重程度,为后续治疗靶点的开发奠定了基础。
