1. 领域背景与文献引入
文献英文标题:Analysis of Sec61p and Ssh1p interactions in the ER membrane using the split-ubiquitin system;发表期刊:BMC Cell Biology;影响因子:未公开;研究领域:内质网(ER)膜蛋白转运通道核心亚基相互作用研究
内质网是真核细胞蛋白质分泌途径的关键细胞器,负责分泌蛋白和膜蛋白的合成、折叠与转运。Sec61复合体是内质网膜上的主要蛋白质转运通道,其核心亚基Sec61p通过形成跨膜孔道,介导大多数蛋白质的共翻译或翻译后转运。Sec61p的C末端结构域对通道功能至关重要——此前研究发现,Sec61p C末端融合GFP或Myc标签会破坏其与核糖体或Sec63复合体的相互作用,导致蛋白质转运效率降低。Ssh1p是Sec61p的非必需同源物,序列同源性约30%,仅参与共翻译转运,但其与Sec61p的功能差异(如对辅助亚基Sbh1p/Sbh2p的选择性)尚未完全阐明。
传统生化方法(如免疫沉淀、化学交联)研究跨膜蛋白相互作用时,难以保留蛋白质的天然构象,也无法捕捉瞬时或弱相互作用。分裂泛素系统作为一种原位检测技术,通过Nub(泛素N端半段,1-37位氨基酸)与Cub(泛素C端半段,35-76位氨基酸)的重组激活报告基因,可在活细胞中检测膜蛋白相互作用。然而,此前应用该系统研究Sec61p/Ssh1p时,存在两大未解决问题:一是C末端融合CPLV(含Cub及PLV转录因子的报告标签,约47 kDa)是否影响其功能;二是融合蛋白能否在生理条件下(如存在野生型蛋白的细胞中)整合到功能复合物并捕捉真实相互作用。本研究针对这些问题展开,旨在为内质网转运通道的相互作用研究提供可靠的技术体系。
2. 文献综述解析
文献综述围绕“分裂泛素系统在ER膜蛋白相互作用研究中的应用”,按“技术原理→现有应用局限→本研究切入点”的逻辑展开。现有研究中,分裂泛素系统已用于检测Ost1p(寡糖基转移酶亚基)、Wbp1p等ER膜蛋白的相互作用,但针对Sec61p/Ssh1p的研究存在明显不足:其一,部分研究将Sec61p作为“猎物”(prey)融合Nub,但未验证融合蛋白的功能(如是否支持细胞生存);其二,虽有研究构建Sec61-CPLV作为“诱饵”(bait),但未检测其在Sec复合物中的整合情况,也未排除标签对功能的干扰;其三,Ssh1p的分裂泛素系统研究尚未见报道。
现有研究的技术局限性主要包括:① Sec61p/Ssh1p C末端融合大标签可能破坏其关键相互作用(如与核糖体的结合),导致功能丧失;② 未在异源二倍体(同时表达野生型和融合蛋白)中验证相互作用的生理相关性——单倍体中融合蛋白功能缺陷会导致细胞死亡或表型异常,无法反映真实的相互作用。本研究的创新点在于:首次系统验证了Sec61-CPLV和Ssh1-CPLV融合蛋白的功能状态,并在异源二倍体酵母中检测融合蛋白与潜在相互作用蛋白的生理相关相互作用,弥补了现有研究中“功能验证缺失”和“生理相关性不足”的缺陷。
3. 研究思路总结与详细解析
3.1 融合蛋白构建与功能验证
实验目的:构建Sec61-CPLV和Ssh1-CPLV融合蛋白,验证C末端融合CPLV对其功能的影响。
方法细节:通过基因克隆将SEC61和SSH1的C末端编码序列(缺失5"端160 bp/134 bp)与CPLV标签(含Cub及PLV转录因子)融合,构建整合质粒;将质粒线性化后转化单倍体酵母(L40菌株),通过同源重组替换野生型基因;通过四分体 dissection检测Sec61-CPLV单倍体的生存能力,通过甘油培养基生长情况检测Ssh1-CPLV单倍体的呼吸缺陷(Ssh1p缺失会导致酵母无法利用非发酵碳源)。
结果解读:Sec61-CPLV单倍体无法存活(四分体 dissection显示2活2死,死孢子携带融合基因),说明融合蛋白完全丧失功能;Ssh1-CPLV单倍体无法在甘油培养基上生长(呼吸缺陷),提示其功能受损——融合标签破坏了Ssh1p与辅助亚基的相互作用。
产品关联:文献未提及具体实验产品,领域常规使用酵母基因编辑试剂盒(如In-Fusion HD Cloning Kit)、PCR验证试剂(如Taq DNA聚合酶)及酵母氨基酸缺陷培养基。
3.2 异源二倍体中融合蛋白的整合与功能检测
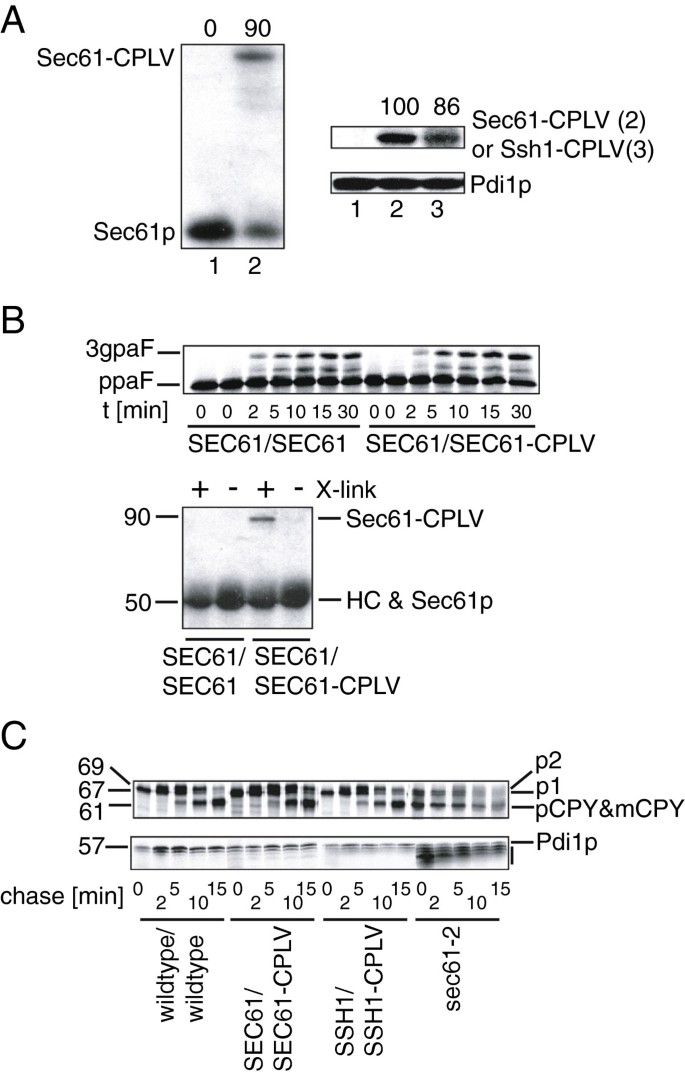
实验目的:验证异源二倍体(同时表达野生型和融合蛋白)中,Sec61-CPLV/Ssh1-CPLV是否整合到功能复合物,且不影响内质网蛋白质转运。
方法细节:构建SEC61/SEC61-CPLV和SSH1/SSH1-CPLV异源二倍体(通过整合质粒转化二倍体酵母);通过定量免疫印迹(抗Sec61p N端抗体)检测融合蛋白与野生型蛋白的表达水平;通过体外ER导入实验(^{35}S标记的preproalpha factor,检测其信号肽切割和糖基化产物3gpaF)验证转运功能;通过化学交联实验(DSP交联后抗Sec63p免疫沉淀)检测Sec61-CPLV与Sec63复合体的结合。
结果解读:异源二倍体中Sec61-CPLV与野生型Sec61p表达水平相当;ER导入实验显示,Sec61-CPLV异源二倍体的preproalpha factor转运效率与野生型无差异(信号肽切割和糖基化产物生成 kinetics一致);交联实验显示,Sec61-CPLV能与Sec63p共沉淀,说明其整合到了Sec复合物中。这些结果表明,融合蛋白在异源二倍体中不影响内质网转运功能,且能参与形成功能复合物。
对应图片:
3.3 分裂泛素系统的相互作用检测
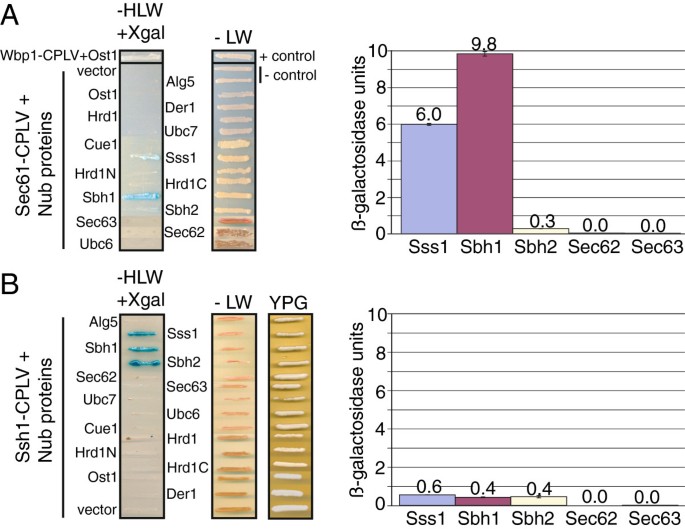
实验目的:利用分裂泛素系统检测Sec61-CPLV/Ssh1-CPLV与ER膜蛋白的相互作用。
方法细节:将猎物蛋白(Sss1p、Sbh1p、Sbh2p、Sec62p、Hrd1p等)融合NubG(突变型Nub,I13G,无法自发结合Cub),构建质粒并转化异源二倍体;通过报告基因实验(无组氨酸培养基生长能力检测HIS3表达,X-gal染色检测LacZ表达)评估相互作用强度;通过定量免疫印迹(抗PLV抗体)检测Cub-Nub重组后的PLV切割(更敏感的相互作用 readout)。
结果解读:报告基因实验显示,Sec61-CPLV与Nub-Sss1p(Sec61复合体辅助亚基)、Nub-Sbh1p(Sec61复合体辅助亚基)强相互作用(无组氨酸培养基生长,X-gal蓝染),与Nub-Sbh2p(Ssh1复合体辅助亚基)弱相互作用;Ssh1-CPLV与Nub-Sss1p、Nub-Sbh1p、Nub-Sbh2p的相互作用强度相当(无组氨酸生长和X-gal染色无差异)。PLV切割实验更敏感,显示Sec61-CPLV与Nub-Sec62p(Sec63复合体亚基)、Ost1p-Nub(寡糖基转移酶亚基)存在弱相互作用,而Ssh1-CPLV与Nub-Sec62p也有弱相互作用——这些弱相互作用未达到报告基因的激活阈值,但通过直接检测PLV切割得以捕捉。
对应图片:
< img src="https://media.springernature.com/lw685/springer-static/image/art%3A10.1186%2F1471-2121-14-14/MediaObjects/12860_2012_Article_655_Fig6_HTML.jpg" >
4. Biomarker研究及发现成果解析
本研究聚焦于内质网膜蛋白转运通道的相互作用机制,未涉及生物标志物(Biomarker)的筛选、验证或临床应用。研究的核心成果为机制性发现:① Sec61p对辅助亚基Sbh1p/Sbh2p具有选择性(与Sbh1p相互作用更强),而Ssh1p无选择性;② 分裂泛素系统中,PLV切割检测比报告基因更敏感,可捕捉弱相互作用;③ 异源二倍体是研究功能缺陷融合蛋白的理想体系,可避免单倍体的致死表型。这些成果为后续内质网相关疾病(如ER应激、蛋白质折叠病)的Biomarker研究提供了理论基础,但本研究未直接产出Biomarker相关结果。
