1. 领域背景与文献引入
文献英文标题:Upregulation of Toll-like receptor (TLR) expression and release of cytokines from P815 mast cells by GM-CSF;发表期刊:BMC Cell Biology;影响因子:未公开;研究领域:肥大细胞免疫调控。
肥大细胞是连接先天免疫与适应性免疫的关键效应细胞,通过表达Toll样受体(TLRs)识别病原体相关分子模式(PAMPs),启动免疫应答。粒细胞-巨噬细胞集落刺激因子(GM-CSF)作为多效细胞因子,已被证实能调节中性粒细胞、单核细胞等免疫细胞的TLR表达及细胞因子分泌——例如上调中性粒细胞TLR2、4表达,促进IL-8分泌。然而,GM-CSF对肥大细胞TLR表达及细胞因子产生的调控作用尚不明确,这一研究空白限制了对肥大细胞在GM-CSF介导的免疫应答中的功能理解。因此,本研究旨在系统探究GM-CSF对肥大细胞TLR表达、细胞因子分泌的影响及潜在分子机制,为揭示GM-CSF在肥大细胞介导的先天免疫中的作用提供实验依据。
2. 文献综述解析
作者对现有研究的评述逻辑围绕三方面展开:
一是GM-CSF对其他免疫细胞的调控作用:GM-CSF可上调中性粒细胞TLR2、4表达,促进IL-8分泌;
二是肥大细胞TLR的表达与功能:肥大细胞表达TLR3(识别病毒双链RNA)、TLR7(识别单链RNA)、TLR9(识别病原体DNA),通过产生IFN-β、RANTES等参与抗病毒免疫;
三是现有研究的局限性:尽管GM-CSF和肥大细胞TLR的功能均有报道,但GM-CSF对肥大细胞TLR表达及细胞因子分泌的调控作用及机制尚未阐明。
本研究的创新价值在于:首次明确GM-CSF对肥大细胞TLR3、7表达及细胞因子分泌的调控作用,并揭示其依赖的信号通路(MAPK、PI3K/Akt);同时发现GM-CSF能增强TLR7配体R-848诱导的IL-6分泌,提示其可能通过调控TLR增强肥大细胞的抗病毒应答。这些发现填补了GM-CSF对肥大细胞功能调控的研究空白,为理解肥大细胞在GM-CSF介导的免疫反应中的作用提供了新视角。
3. 研究思路总结与详细解析
整体框架
本研究以P815肥大细胞系为模型,技术路线形成“模型验证→表型检测→机制探究→通路验证”闭环:
1. 验证P815细胞是否表达TLR3、7、9(作为研究基础);
2. 检测GM-CSF对TLR mRNA/蛋白表达的影响;
3. 检测GM-CSF对细胞因子分泌的调控;
4. 用抑制剂探究信号通路;
5. 验证信号分子磷酸化。
3.1 P815细胞TLR表达验证
实验目的:确认P815细胞是否表达TLR3、7、9,确保其作为研究模型的适用性。
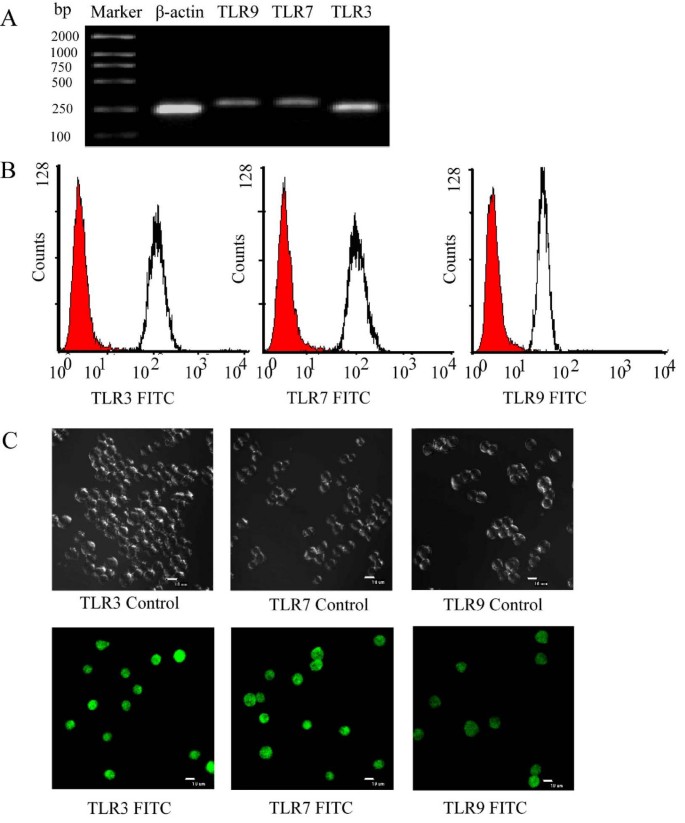
方法细节:采用逆转录-聚合酶链反应(RT-PCR)检测TLR3、7、9的mRNA表达(引物见表1);流式细胞术(FITC标记抗体染色)、免疫荧光染色检测蛋白表达。P815细胞培养于含10%胎牛血清的DMEM培养基,收集后提取总RNA并逆转录为cDNA,进行PCR扩增;流式样本经4%多聚甲醛固定后,用TLR特异性抗体染色。
结果解读:RT-PCR显示P815细胞表达TLR3(240bp)、TLR7(262bp)、TLR9(297bp)的mRNA(图1A);流式及免疫荧光证实蛋白表达(图1B、1C),表明P815细胞可作为研究肥大细胞TLR调控的合适模型。
产品关联:实验所用关键产品包括Invitrogen的TRIzol试剂(RNA提取)、TaKaRa的ExScript RT试剂(cDNA合成)、eBioScience的FITC标记TLR抗体、BD Pharmingen的FITC标记二抗。
3.2 GM-CSF对TLR表达的调控
实验目的:探究GM-CSF对P815细胞TLR3、7、9表达的影响。
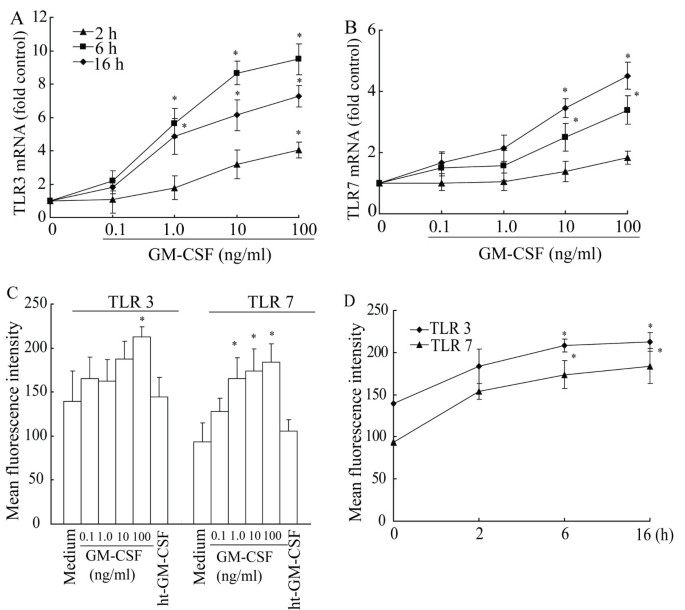
方法细节:实时荧光定量PCR检测GM-CSF(0.1-100ng/ml,处理2、6、16h)对TLR mRNA的影响(以β-actin为内参,计算2^-ΔΔCt值);流式细胞术检测蛋白表达(浓度0.1-100ng/ml,处理16h;时间梯度2、6、16h,浓度100ng/ml);设置热灭活GM-CSF(100ng/ml,100℃处理10min)为阴性对照。
结果解读:实时荧光定量PCR显示,GM-CSF浓度依赖性上调TLR3、7的mRNA表达(n=4,P<0.05)——TLR3 mRNA在100ng/ml处理6h时上调约9.5倍,TLR7 mRNA在100ng/ml处理16h时上调约4.5倍;对TLR9无影响(图2A、2B)。流式结果显示,100ng/ml GM-CSF处理16h时,TLR3阳性率较对照升高52%,TLR7升高96.3%(n=4,P<0.05);热灭活GM-CSF完全丧失该作用;时间梯度实验显示,TLR3、7蛋白表达在6h开始显著升高,持续至16h(图2C、2D)。
产品关联:实验所用关键产品包括ABI Prism 7000实时PCR系统、TaKaRa的SYBR Premix Ex Taq试剂、R&D Systems的重组GM-CSF。
3.3 GM-CSF对细胞因子分泌的影响
实验目的:检测GM-CSF对P815细胞IL-6、IL-13、IL-12分泌的调控,及对TLR配体诱导细胞因子的影响。
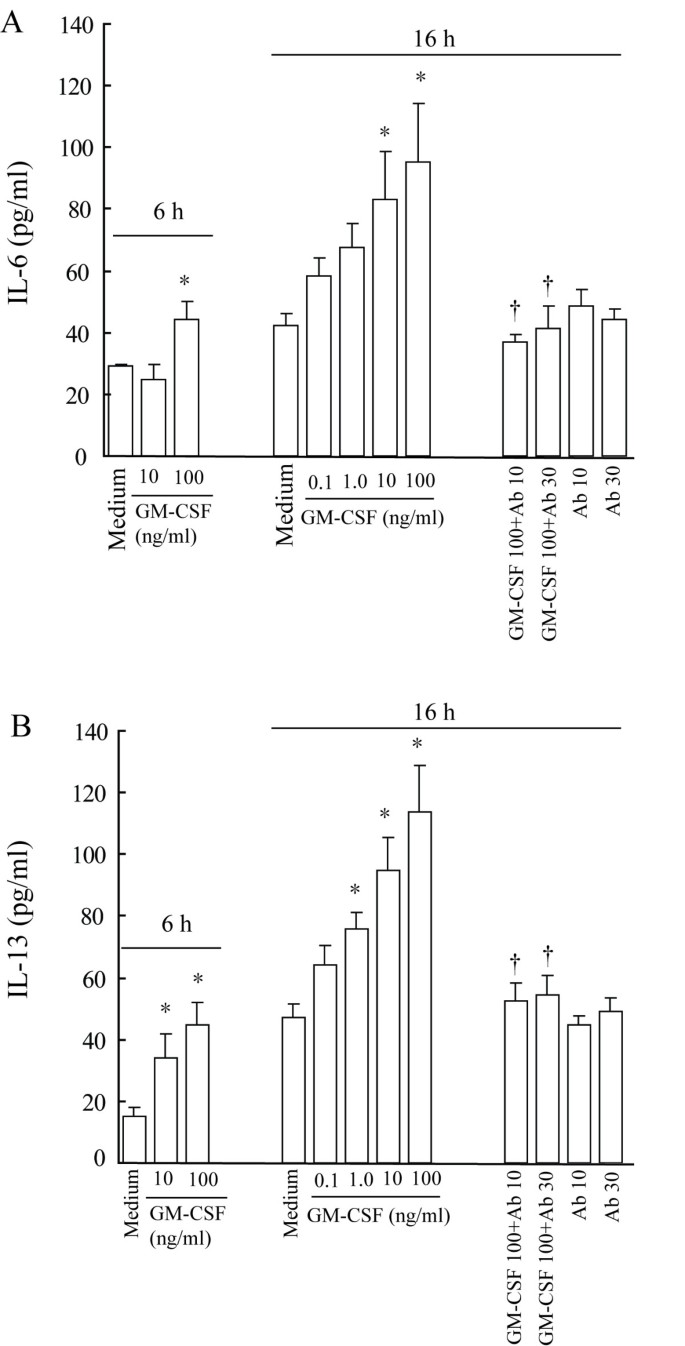
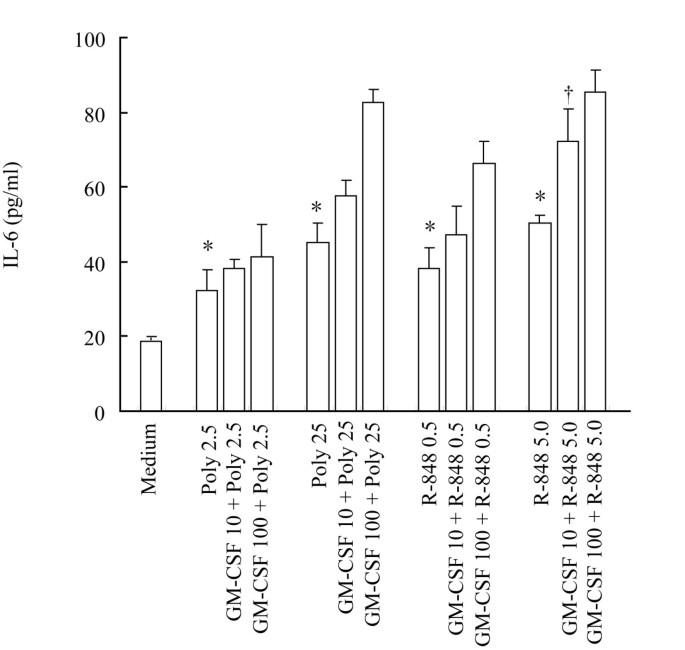
方法细节:细胞经血清饥饿6h后,用GM-CSF(0.1-100ng/ml)处理6、16h,ELISA检测上清细胞因子浓度;预孵育GM-CSF(10、100ng/ml)1h后,加入TLR3配体poly(I:C)(2.5、25μg/ml)或TLR7配体R-848(0.5、5μg/ml)处理6h,检测IL-6分泌。
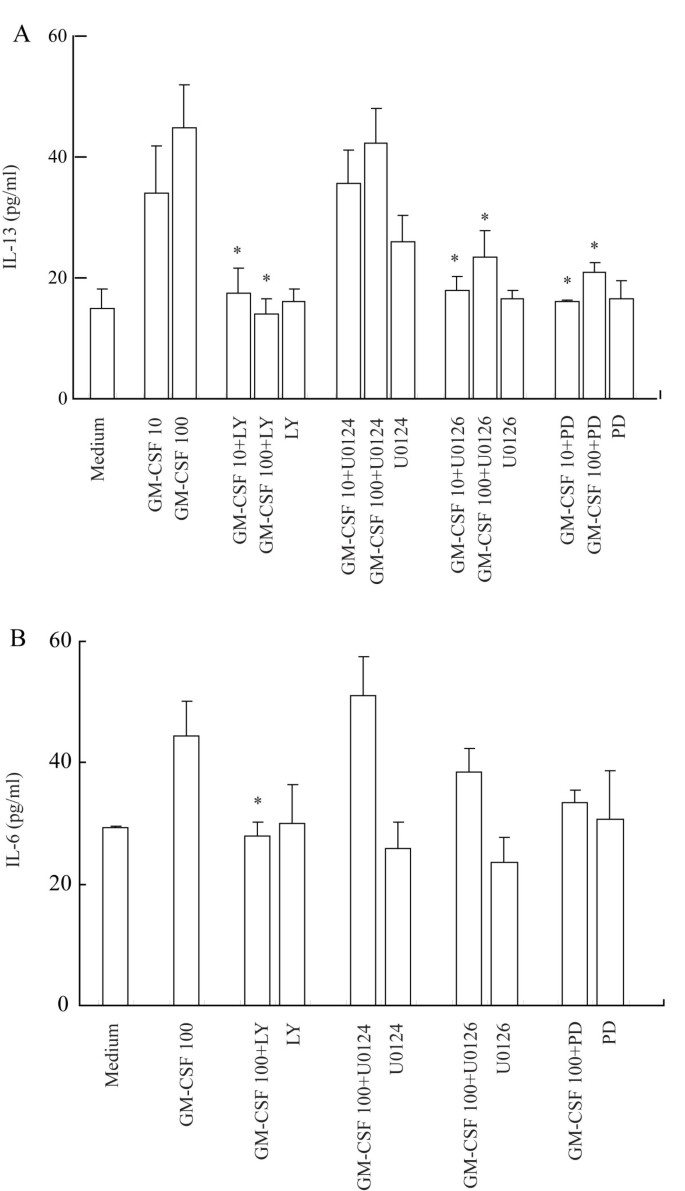
结果解读:ELISA显示,GM-CSF浓度依赖性促进IL-6、IL-13分泌(n=4,P<0.05)——100ng/ml处理16h时,IL-6较对照升高2.3倍,IL-13升高2.4倍;对IL-12无影响(图3A、3B)。GM-CSF预处理增强R-848诱导的IL-6分泌(10ng/ml GM-CSF+5μg/ml R-848组较R-848单独组显著升高,P<0.05),对poly(I:C)无显著增强(图4)。
产品关联:实验所用关键产品包括Pierce的IL-6/IL-13 ELISA试剂盒、Invivogen的poly(I:C)和R-848。
3.4 信号通路机制探究
实验目的:揭示GM-CSF调控TLR表达及细胞因子分泌的分子通路。
方法细节:细胞预孵育信号通路抑制剂(PD98059:50μM,MAPK抑制剂;U0126:5μM,MEK抑制剂;LY294002:20μM,PI3K抑制剂)30min后,加入GM-CSF(10、100ng/ml)处理6h,ELISA检测IL-13/IL-6分泌,流式检测TLR3/7表达;用Cellular Activation of Signaling ELISA(CASE)试剂盒检测ERK、Akt磷酸化(抑制剂预处理30min,GM-CSF处理15min)。
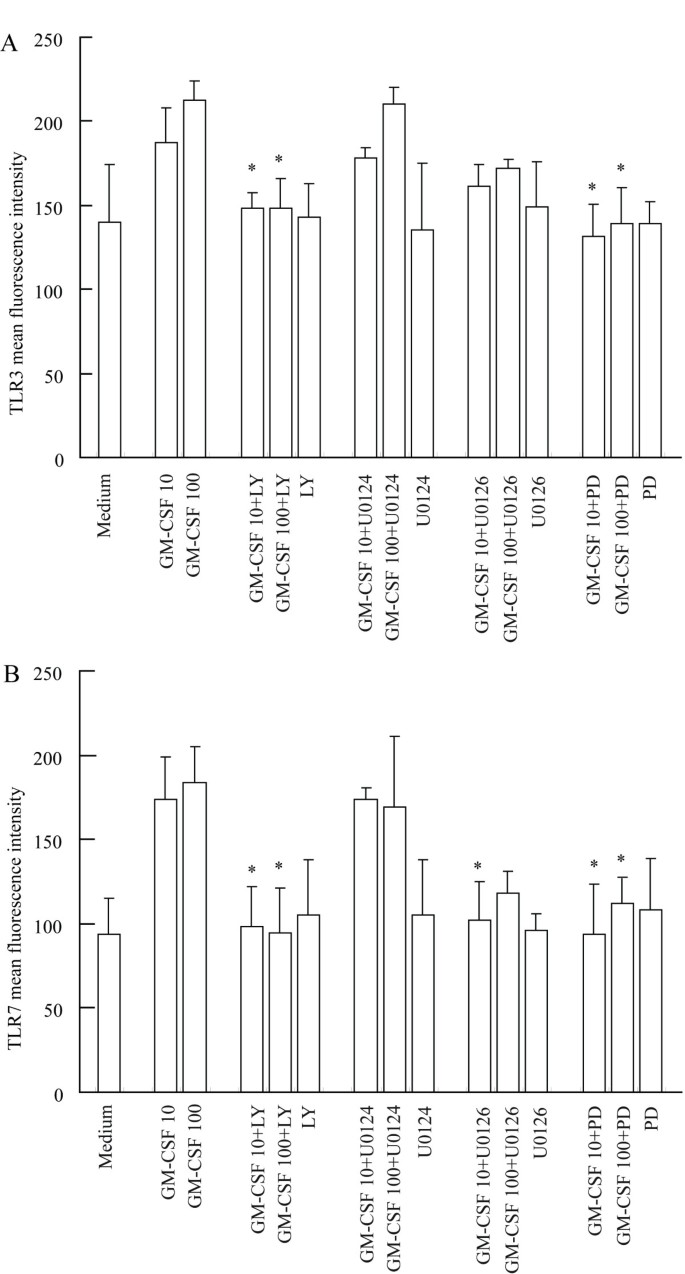
结果解读:抑制剂实验显示,PD98059、U0126、LY294002完全抑制GM-CSF诱导的IL-13分泌(n=4,P<0.05),LY294002完全抑制IL-6分泌(n=4,P<0.05)(图5A、5B);同时,这些抑制剂显著抑制GM-CSF诱导的TLR3、7表达(n=4,P<0.05)(图6A、6B)。CASE结果显示,PD98059抑制ERK磷酸化约50%,U0126抑制约46.7%,LY294002抑制Akt磷酸化约76.2%(n=3,P<0.05)。
产品关联:实验所用关键产品包括Cell Signaling Technology的抑制剂、SuperArray的CASE试剂盒。
4. Biomarker研究及发现成果解析
Biomarker定位
本研究的核心Biomarker为TLR3、TLR7(GM-CSF调控肥大细胞功能的关键分子)及IL-6、IL-13(GM-CSF调控的效应分子)。筛选逻辑为:先验证P815细胞表达TLR3、7、9(基础筛选),再通过GM-CSF处理检测TLR3、7的差异表达(功能筛选),最后结合细胞因子分泌和信号通路验证其相关性。
研究过程详述
- 来源:TLR3、7来自P815肥大细胞,细胞因子来自细胞培养上清;
- 验证方法:实时荧光定量PCR(mRNA)、流式细胞术(蛋白)、ELISA(细胞因子)、抑制剂实验(功能相关性);
- 关键数据:
- TLR3:100ng/ml GM-CSF处理6h时mRNA上调9.5倍(n=4,P<0.05),16h蛋白上调52%(n=4,P<0.05);
- TLR7:100ng/ml处理16h时mRNA上调4.5倍(n=4,P<0.05),蛋白上调96.3%(n=4,P<0.05);
- IL-6:100ng/ml处理16h时升高2.3倍(n=4,P<0.05);
- IL-13:100ng/ml处理16h时升高2.4倍(n=4,P<0.05)。
核心成果提炼
- 功能关联:TLR3、7是GM-CSF调控肥大细胞功能的关键Biomarker,其表达上调与IL-13、IL-6分泌增加直接相关;
- 创新性:首次发现GM-CSF通过TLR3、7增强肥大细胞的抗病毒应答(如增强R-848诱导的IL-6分泌);
- 机制:TLR3、7表达及IL-13分泌依赖MAPK和PI3K/Akt通路,IL-6分泌仅依赖PI3K/Akt通路。
这些成果为理解GM-CSF在肥大细胞介导的先天免疫中的作用提供了新的Biomarker和机制依据。
