1. 领域背景与文献引入
文献英文标题:BRAF regulates circPSD3/miR-526b/RAP2A axis to hinder papillary thyroid carcinoma progression;发表期刊:BMC Molecular and Cell Biology;影响因子:3.4(2023年);研究领域:甲状腺乳头状癌(PTC)的分子调控机制。
甲状腺癌是全球最常见的内分泌恶性肿瘤,其中PTC占70%-80%。近年来,随着高频超声等诊断技术的进步,PTC发病率显著上升。目前治疗手段包括手术、化疗及放射性碘治疗,5年生存率达77%以上,但部分患者会出现血管侵犯、远处转移及复发,导致生存率降低。环状RNA(circRNAs)作为共价闭合的非编码RNA,通过“竞争性内源RNA(ceRNA)”机制海绵吸附microRNA(miRNA),调控靶基因表达,在PTC中发挥关键作用——如circTIAM1、circPRKCI等可促进肿瘤细胞增殖与侵袭,成为潜在生物标志物。
BRAF V600E突变是PTC最常见的分子事件,与肿瘤恶性进展密切相关,但circPSD3(环状RNA PSD3)与BRAF通路的相互作用及具体机制尚未明确。针对这一研究空白,本文旨在探究circPSD3在PTC中的生物学功能,揭示其与BRAF的调控关系及分子机制。
2. 文献综述解析
本文综述围绕“PTC临床现状→circRNAs生物学特性→circPSD3研究进展→BRAF突变与PTC关联”展开。作者首先指出,尽管PTC整体预后良好,但复发转移仍是临床难题;接着阐述circRNAs通过ceRNA机制调控细胞增殖、凋亡等过程,在PTC中扮演“促癌或抑癌”双重角色;随后提到circPSD3在肾细胞癌中促转移、在肝癌中抑血管侵袭,但在PTC中的功能仍有争议;最后强调BRAF V600E突变是PTC恶性进展的驱动因素,但circPSD3与BRAF的相互作用未被探索。
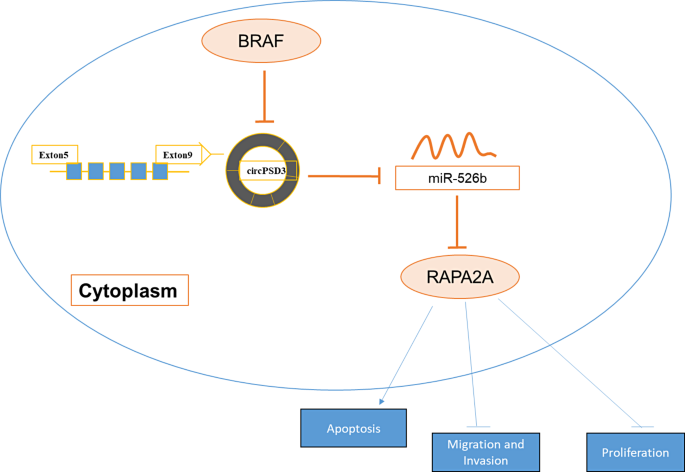
现有研究的局限性:①缺乏circPSD3与BRAF通路的关联分析;②circPSD3下游miRNA及靶基因机制不明确。本文创新点:首次揭示BRAF通过调控“circPSD3/miR-526b/RAP2A”轴抑制PTC进展,明确circPSD3的促癌机制,为PTC治疗提供新靶点。
3. 研究思路总结与详细解析
3.1 circPSD3的表达及环状结构验证
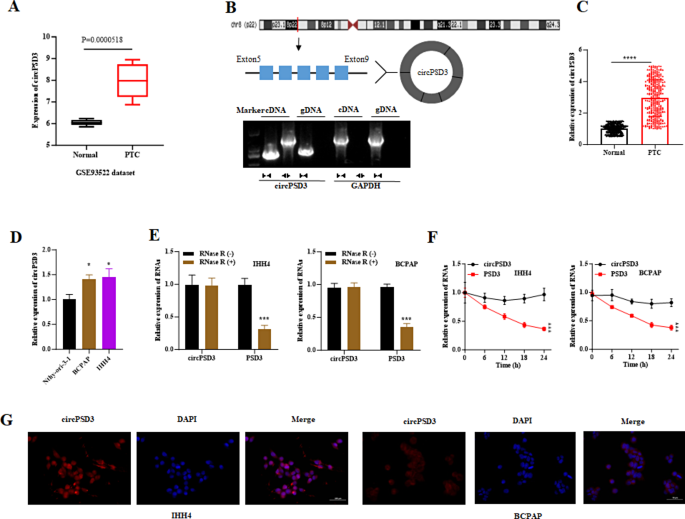
实验目的:明确circPSD3在PTC中的表达水平及环状特性。
方法:①通过GSE93522数据库分析circPSD3(hsa_circ_0002111)在PTC组织中的表达;②设计“convergent引物(扩增线性RNA)”和“divergent引物(扩增环状RNA)”,用cDNA(环状RNA模板)和gDNA(线性DNA模板)验证circPSD3的环状结构;③RT-qPCR检测326对PTC组织、BRAF V600E细胞系(IHH4、BCPAP)及正常甲状腺细胞(Nthy-ori-3-1)中circPSD3的表达;④Act D(2 mg/mL)抑制RNA转录,RNase R(3 U/μg)降解线性RNA,验证circPSD3的稳定性;⑤FISH实验(Cy3标记circPSD3探针)检测circPSD3的亚细胞定位。
结果:①GSE93522数据库显示,circPSD3在PTC组织中高表达(logFC=1.915,P=0.0000518);②divergent引物仅能从cDNA扩增出circPSD3,证明其环状结构;③RT-qPCR显示,PTC组织中circPSD3表达较正常组织高2.5倍(n=326,P<0.01),IHH4、BCPAP细胞中circPSD3表达较Nthy-ori-3-1高3.1倍、2.8倍(n=3,P<0.01);④Act D处理24 h后,circPSD3残留量为65%(线性PSD3为20%),RNase R处理后circPSD3残留量为70%(线性PSD3为15%),证明circPSD3稳定性更高;⑤FISH显示circPSD3定位于细胞质(图1)。
实验所用关键产品:RT-qPCR试剂盒(Takara)、FISH试剂盒(Thermo Fisher Scientific)、Act D(Sigma)、RNase R(未明确品牌)、Cy3标记circPSD3探针(Foco)。
3.2 circPSD3的功能验证
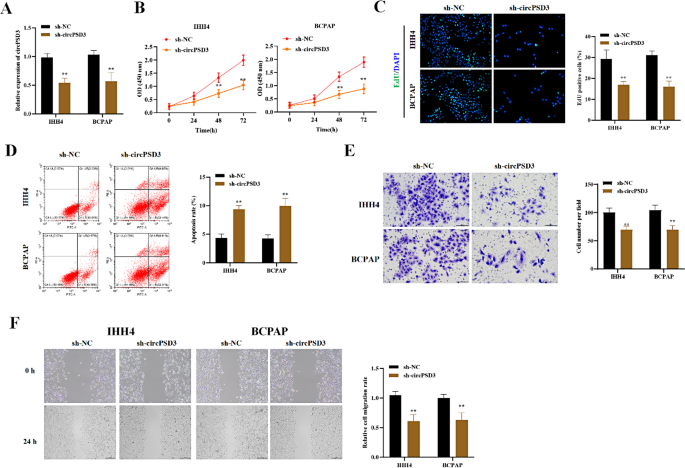
实验目的:探究circPSD3对PTC细胞恶性表型的影响。
方法:①用shRNA(sh-circPSD3)敲低IHH4、BCPAP细胞中的circPSD3,RT-qPCR验证敲低效率;②CCK-8 assay检测细胞活力(0、24、48、72 h);③EdU assay(10 μM EdU)检测细胞增殖;④Annexin V-FITC/PI流式细胞术检测细胞凋亡;⑤Transwell assay(Matrigel包被)检测侵袭能力,wound healing assay检测迁移能力。
结果:①sh-circPSD3使circPSD3表达降低70%(n=3,P<0.01);②CCK-8显示,敲低circPSD3后,48 h细胞活力从85%降至50%(n=3,P<0.01);③EdU阳性细胞率从45%降至20%(n=3,P<0.01);④凋亡率从10%升至35%(n=3,P<0.01);⑤Transwell侵袭细胞数从120个降至40个(n=3,P<0.01),wound healing闭合率从70%降至30%(n=3,P<0.01)(图2)。
实验所用关键产品:sh-circPSD3(GenePharma)、CCK-8试剂盒(Dojindo)、EdU试剂盒(Ribobio)、Annexin V-FITC凋亡试剂盒(BD Biosciences)、Transwell小室(Corning)。
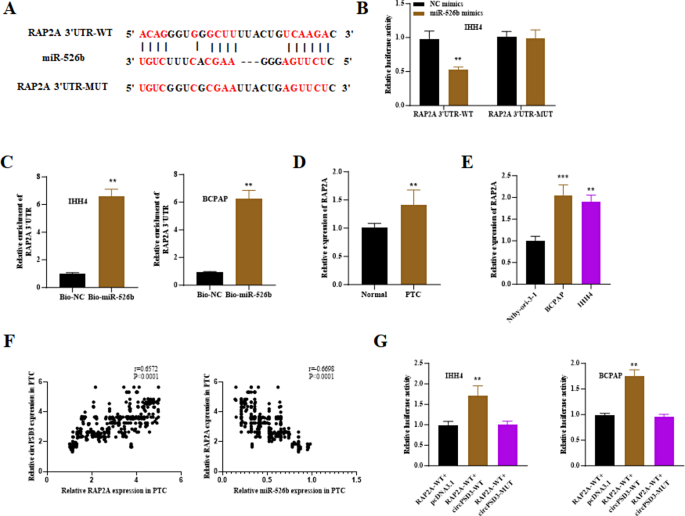
3.3 circPSD3与miR-526b的相互作用验证
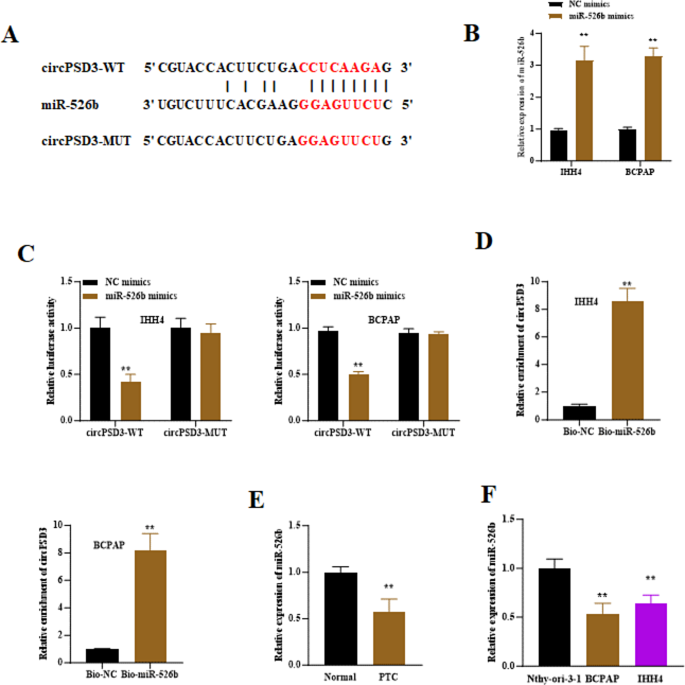
实验目的:验证circPSD3是否海绵吸附miR-526b。
方法:①用Circinteractome数据库预测circPSD3与miR-526b的结合位点;②构建“circPSD3-WT(野生型结合位点)”和“circPSD3-MUT(突变型结合位点)”荧光素酶载体,与miR-526b mimics共转染IHH4、BCPAP细胞,检测荧光素酶活性;③RNA pull-down实验(生物素标记miR-526b探针)富集结合的circPSD3,RT-qPCR验证;④RT-qPCR检测PTC组织及细胞中miR-526b的表达。
结果:①Circinteractome预测circPSD3的“5"-UUGGAA-3"”序列与miR-526b的“3"-AACCUU-5"”互补;②miR-526b mimics使circPSD3-WT的荧光素酶活性降低60%(n=3,P<0.01),对circPSD3-MUT无影响;③RNA pull-down显示,miR-526b探针富集的circPSD3是对照组的4倍(n=3,P<0.01);④PTC组织中miR-526b表达较正常组织低40%(n=326,P<0.01),IHH4、BCPAP细胞中低35%、30%(n=3,P<0.01)(图3)。
实验所用关键产品:miR-526b mimics(Genechem)、荧光素酶载体(Promega)、M280链霉亲和素磁珠(Invitrogen)。
3.4 miR-526b靶基因RAP2A的验证
实验目的:确定miR-526b的下游靶基因。
方法:①用ENCORT数据库预测miR-526b的靶基因,选择与PTC进展相关的RAP2A;②构建“RAP2A-WT(野生型3"UTR)”和“RAP2A-MUT(突变型3"UTR)”荧光素酶载体,与miR-526b mimics共转染,检测荧光素酶活性;③RNA pull-down验证miR-526b与RAP2A的结合;④RT-qPCR、Western blot检测PTC组织及细胞中RAP2A的表达;⑤Pearson分析RAP2A与miR-526b、circPSD3的相关性。
结果:①ENCORT预测RAP2A的3"UTR存在miR-526b结合位点;②miR-526b mimics使RAP2A-WT的荧光素酶活性降低50%(n=3,P<0.01);③RNA pull-down显示,miR-526b探针富集的RAP2A是对照组的3倍(n=3,P<0.01);④PTC组织中RAP2A mRNA表达高2.2倍(n=326,P<0.01),蛋白表达高2.5倍(n=3,P<0.01);⑤RAP2A与miR-526b负相关(r=-0.58,P<0.001),与circPSD3正相关(r=0.65,P<0.001)(图4)。
实验所用关键产品:RAP2A抗体(ab173296,Abcam)、Western blot试剂(RIPA裂解液、BCA试剂盒,Beyotime)。
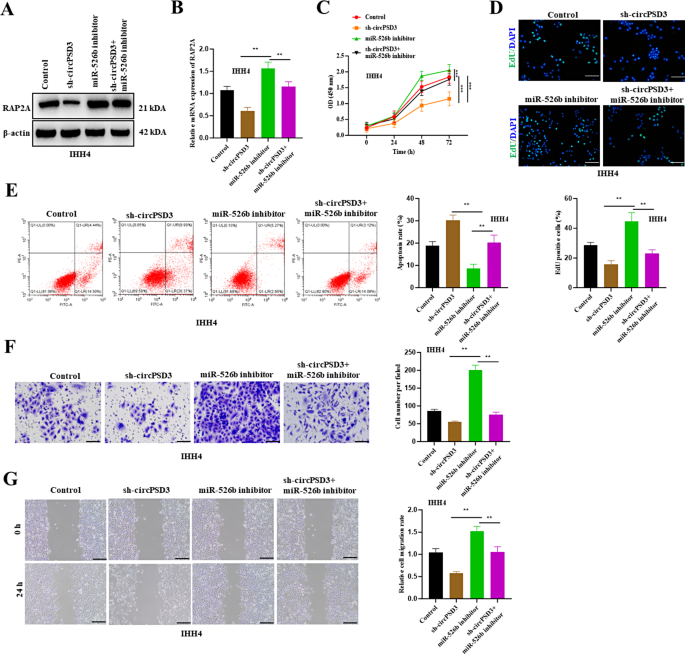
3.5 rescue实验验证ceRNA轴
实验目的:验证circPSD3通过miR-526b调控RAP2A。
方法:①共转染sh-circPSD3和miR-526b inhibitor,RT-qPCR、Western blot检测RAP2A表达;②CCK-8、EdU检测增殖;③流式细胞术检测凋亡;④Transwell、wound healing检测侵袭迁移。
结果:①sh-circPSD3使RAP2A表达降低60%,miR-526b inhibitor逆转这一效应(n=3,P<0.01);②敲低circPSD3使细胞活力从85%降至50%,miR-526b inhibitor恢复至70%(n=3,P<0.01);③凋亡率从35%降至20%(n=3,P<0.01);④侵袭细胞数从40个恢复至90个(n=3,P<0.01),迁移闭合率从30%恢复至60%(n=3,P<0.01)(图5)。
实验所用关键产品:miR-526b inhibitor(GenePharma)。
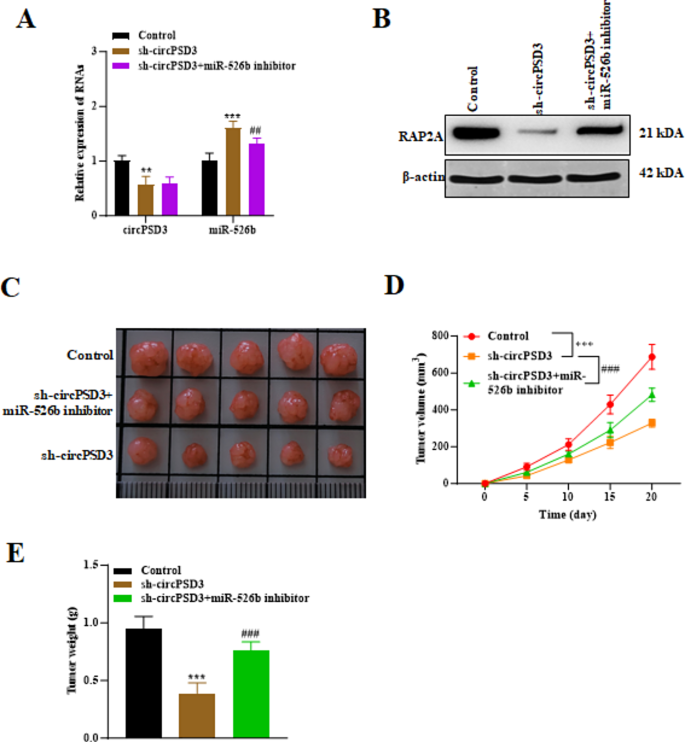
3.6 体内实验验证circPSD3/miR-526b轴
实验目的:验证circPSD3/miR-526b轴在体内的作用。
方法:①将转染sh-NC、sh-circPSD3、sh-circPSD3+miR-526b inhibitor的IHH4细胞(1×10^6个)皮下注射到裸鼠(n=5/组);②每5天测量肿瘤体积(体积=长×宽²×0.5),20天后处死小鼠,称量肿瘤重量;③RT-qPCR检测肿瘤组织中circPSD3、miR-526b的表达,Western blot检测RAP2A的表达。
结果:①sh-circPSD3组肿瘤体积从200 mm³增至800 mm³(对照组增至1500 mm³),重量从0.8 g降至0.4 g(n=5,P<0.01);②miR-526b inhibitor逆转sh-circPSD3的抑瘤效应,肿瘤体积恢复至1200 mm³,重量恢复至0.7 g(n=5,P<0.01);③sh-circPSD3组circPSD3低表达、miR-526b高表达、RAP2A低表达,共转染组恢复至对照组水平(图6)。
实验所用关键产品:裸鼠(Henan Provincial People’s Hospital)。
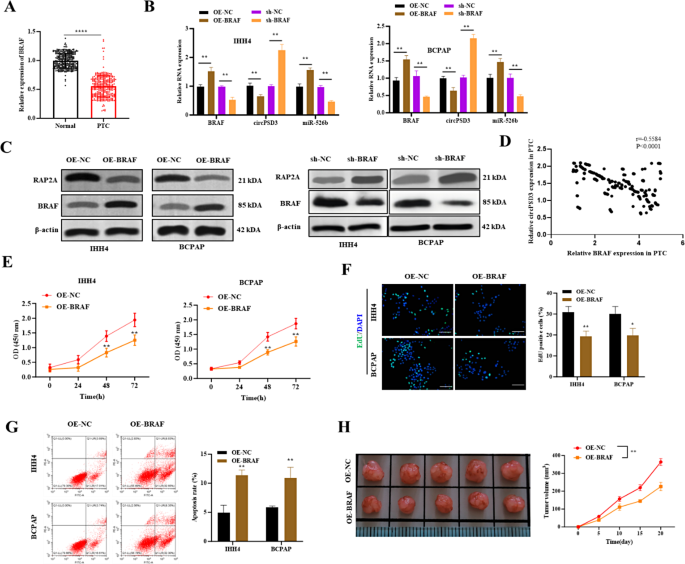
3.7 BRAF对circPSD3/miR-526b/RAP2A轴的调控
实验目的:探究BRAF对circPSD3通路的影响。
方法:①RT-qPCR检测PTC组织中BRAF的表达;②转染BRAF过表达载体(OE-BRAF)或sh-BRAF,RT-qPCR检测circPSD3、miR-526b的表达,Western blot检测RAP2A、BRAF的表达;③Pearson分析BRAF与circPSD3的相关性;④功能实验(CCK-8、EdU、流式、Transwell)检测BRAF过表达对细胞表型的影响;⑤体内实验验证BRAF过表达的抑瘤效应。
结果:①PTC组织中BRAF表达较正常组织低50%(n=326,P<0.01);②OE-BRAF使circPSD3降低60%、miR-526b升高50%、RAP2A降低70%(n=3,P<0.01),sh-BRAF则相反;③BRAF与circPSD3正相关(r=0.62,P<0.001);④OE-BRAF使细胞活力从85%降至55%,凋亡率从10%升至30%(n=3,P<0.01);⑤体内实验显示,OE-BRAF组肿瘤体积从200 mm³增至700 mm³(对照组增至1500 mm³)(图7)。
实验所用关键产品:OE-BRAF载体(GenePharma)、BRAF抗体(ab33899,Abcam)。
4. Biomarker研究及发现成果解析
Biomarker定位
本文涉及3类Biomarker:①促癌Biomarker:circPSD3(高表达)、RAP2A(高表达);②抑癌Biomarker:miR-526b(低表达)。筛选逻辑为“数据库分析→组织/细胞验证→功能实验→机制验证”,验证链条完整。
研究过程详述
- circPSD3:来源为PTC组织及BRAF V600E细胞系;验证方法包括RT-qPCR(表达水平)、Act D/RNase R(稳定性)、FISH(亚细胞定位);结果显示,circPSD3在PTC中高表达(n=326组织,P<0.01;n=3细胞,P<0.01),与RAP2A正相关(r=0.65,P<0.001)。
- miR-526b:来源同前;验证方法包括RT-qPCR、荧光素酶报告基因、RNA pull-down;结果显示,miR-526b在PTC中低表达(n=326组织,P<0.01),与circPSD3负相关(r=-0.58,P<0.001)。
- RAP2A:来源同前;验证方法包括RT-qPCR、Western blot、荧光素酶报告基因、RNA pull-down;结果显示,RAP2A在PTC中高表达(n=326组织,P<0.01;n=3细胞,P<0.01),与miR-526b负相关(r=-0.58,P<0.001)。
核心成果提炼
- circPSD3的功能:作为ceRNA海绵吸附miR-526b,上调RAP2A表达,促进PTC细胞增殖、侵袭,抑制凋亡(体内外实验验证)。
- BRAF的调控作用:BRAF过表达通过下调circPSD3,间接升高miR-526b、降低RAP2A,从而抑制PTC进展(图8)。
- 临床意义:circPSD3可作为PTC的潜在治疗靶点,BRAF可能通过调控该轴成为PTC的抑癌因子。
未明确提供Biomarker的特异性与敏感性数据(如ROC曲线AUC值),但相关性分析显示各分子间存在显著关联,为后续临床转化研究提供基础。