1. 领域背景与文献引入
文献英文标题:The XMAP215-family protein DdCP224 is required for cortical interactions of microtubules;发表期刊:BMC Cell Biology;影响因子:未公开;研究领域:细胞生物学(微管与细胞皮层相互作用、XMAP215家族蛋白功能)。
微管作为细胞骨架的核心成分,其与细胞皮层的相互作用(如微管正端与皮层的锚定)是细胞核迁移、纺锤体定向、中心体定位及细胞定向运动的关键基础。动力蛋白(dynein,微管负端指向马达蛋白)是介导这一过程的核心因子——通过与皮层结合产生“拉力”,维持微管的放射状阵列。XMAP215家族蛋白是一类保守的微管正端结合蛋白(+TIPs),已知功能包括促进微管延长、调控微管成核及中心体复制,但此前仅酵母中的短链同源物(如Stu2p)被报道参与有丝分裂期的纺锤体定向,长链单体XMAP215蛋白(如盘基网柄菌的DdCP224)是否在间期细胞中参与微管与皮层的相互作用,尚未有明确证据。当前研究热点聚焦于+TIPs在微管-皮层相互作用中的协同机制,但XMAP215家族蛋白的角色仍属空白。
鉴于此,本研究以盘基网柄菌的XMAP215同源物DdCP224为对象,通过过表达其N端截断体(ΔC-GFP),结合活细胞成像、免疫荧光及免疫共沉淀等技术,探究DdCP224在间期细胞微管与皮层相互作用中的功能及机制。研究旨在解决“长链XMAP215蛋白是否参与间期微管-皮层相互作用”这一核心问题,其学术价值在于首次证明XMAP215家族蛋白不仅调控微管动力,还通过与动力蛋白复合物相互作用介导微管与细胞皮层的连接,填补了XMAP215家族蛋白功能研究的空白。
2. 文献综述解析
文献综述的核心评述逻辑:作者按“XMAP215家族蛋白的已知功能→酵母同源物的有丝分裂功能→长链XMAP215的未知角色”三大维度展开,系统梳理领域进展与不足。
现有研究的关键结论:XMAP215家族蛋白是微管动态的主要调控因子,酵母Stu2p参与有丝分裂期纺锤体定向,但长链XMAP215蛋白(如DdCP224)是否在间期参与微管-皮层相互作用未知;技术方法优势:盘基网柄菌作为模式生物,透明的细胞结构及易于遗传操作的特点便于研究微管动态;局限性:此前未分析DdCP224截断体过表达对微管的影响,也未探究其与动力蛋白的相互作用。
文献的创新价值在于:突破了XMAP215家族蛋白仅参与“微管动力调控”及“有丝分裂功能”的传统认知,首次将长链XMAP215蛋白(DdCP224)与间期细胞的微管-皮层相互作用关联,并证明其功能依赖于与动力蛋白(dynein)及动力蛋白激活复合物(dynactin)的相互作用。这一发现不仅拓展了XMAP215家族蛋白的功能谱,也为理解微管-皮层相互作用的分子机制提供了新视角。
3. 研究思路总结与详细解析
本研究的整体框架:以“探究DdCP224在微管与细胞皮层相互作用中的功能及机制”为目标,围绕“DdCP224是否参与间期微管-皮层相互作用”“其功能是否通过动力蛋白介导”两大核心科学问题,采用“表型观察→动态分析→机制验证”的闭环技术路线——先通过过表达截断体观察微管结构变化,再利用活细胞成像分析中心体动态,随后通过高尔基体分散及皮层动力蛋白定位验证功能异常,再通过免疫共沉淀探究蛋白相互作用,最后通过共定位及dynactin亚基Ddp62的克隆明确分子基础。
3.1 DdCP224-ΔC-GFP过表达对间期微管阵列的影响
实验目的:验证DdCP224的N端截断体过表达是否破坏间期微管的放射状结构。
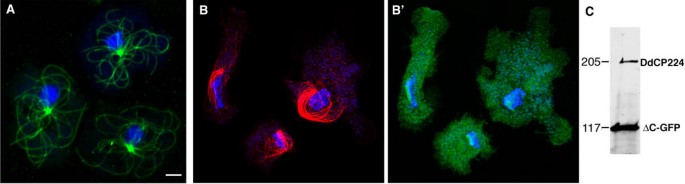
方法细节:构建表达DdCP224 N端813个氨基酸(ΔC)与GFP融合蛋白的细胞系,以GFP-α-tubulin细胞为对照;采用甲醇固定细胞后,用YL1/2抗微管蛋白抗体(Chemicon)进行免疫荧光染色(标记微管),TOPRO3(Molecular Probes)染色DNA;通过Western blot(抗DdCP-HindIII抗体,针对DdCP224 N端HindIII片段自制)检测截断体的过表达水平。
结果解读:对照细胞的微管呈典型放射状,从中心体延伸至细胞皮层;而ΔC-GFP过表达细胞的微管阵列完全坍塌——微管成束、缠绕细胞核(图1B);Western blot结果显示,ΔC-GFP的表达量约为内源性DdCP224的5倍(ImageJ软件定量)。
实验所用关键产品:YL1/2抗微管蛋白抗体(Chemicon)、TOPRO3(Molecular Probes)、抗DdCP-HindIII多克隆抗体(自制)。
3.2 活细胞成像分析中心体与微管动态
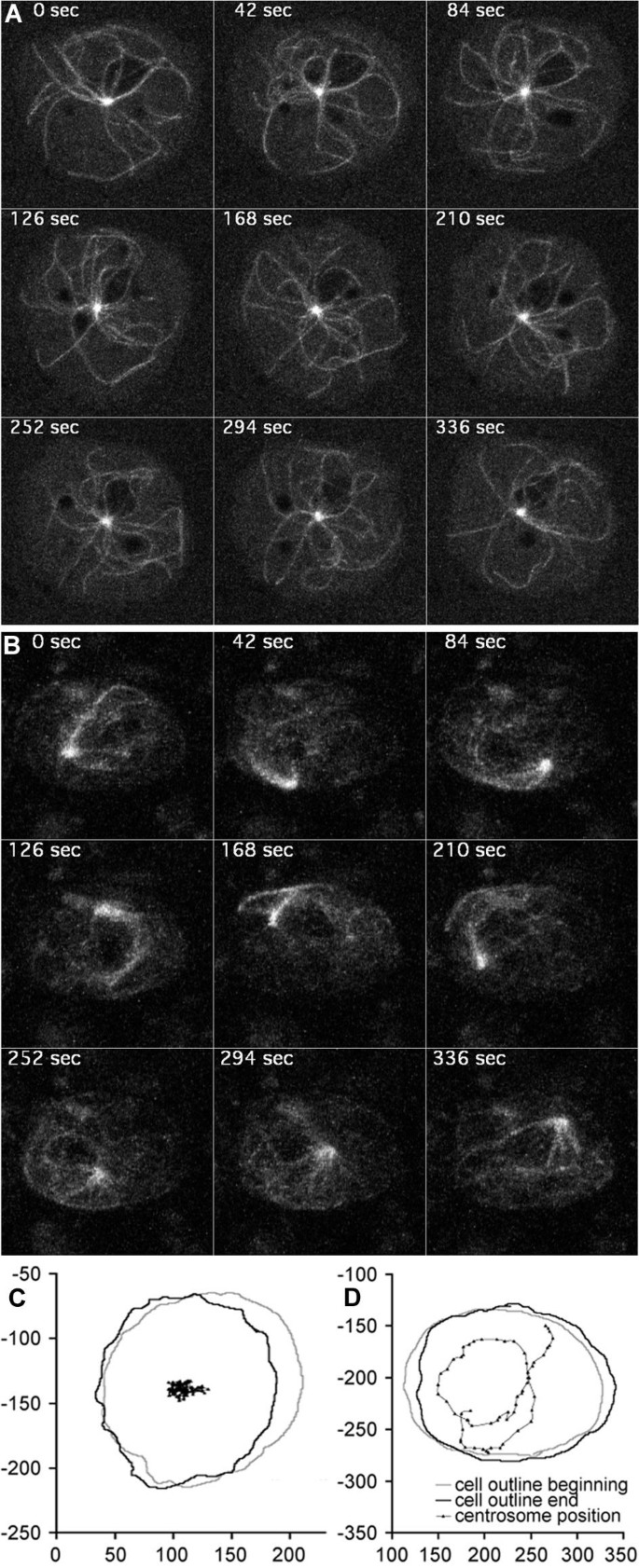
实验目的:观察ΔC-GFP过表达后,中心体及微管的动态变化。
方法细节:将无标签的DdCP-ΔC转入GFP-α-tubulin细胞,利用4D共聚焦显微镜(Zeiss Axiovert 200M/510META)成像(每幅图像为5层z-stack的最亮点投影,层间距1μm)。
结果解读:对照细胞的中心体稳定位于细胞中央,仅做短距离移动;而ΔC过表达细胞的中心体呈现“异常高 motility”——快速循环移动,微管像“彗星尾”一样拖在中心体后方(图2B、D,补充视频2);这一表型与过表达动力蛋白重链马达域的细胞完全一致。
实验所用关键产品:Zeiss共聚焦显微镜(63×/1.4N.A.镜头)。
3.3 高尔基体分散与皮层动力蛋白定位分析
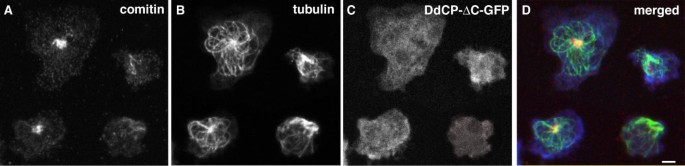
实验目的:验证ΔC-GFP过表达是否破坏动力蛋白/动力蛋白激活复合物的功能(高尔基体定位依赖该复合物)。
方法细节:用甲醛/丙酮固定细胞,分别用抗comitin抗体(Michael Schleicher提供,标记高尔基体)、抗动力蛋白重链Y7抗体(Mike Koonce提供,标记动力蛋白)进行免疫荧光染色。
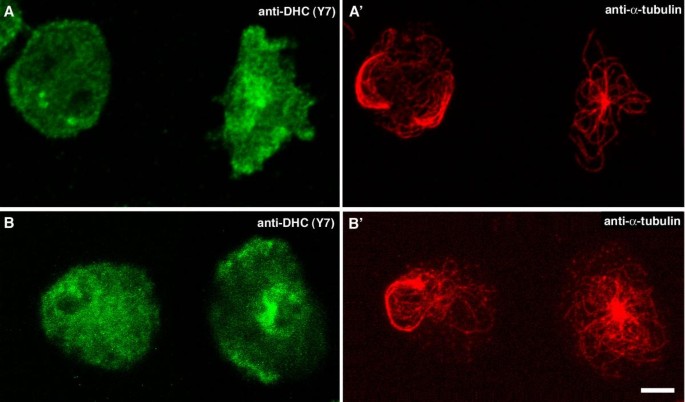
结果解读:微管阵列坍塌的细胞中,高尔基体明显分散(图3,箭头标记);同时,这些细胞的皮层动力蛋白定位显著减少——而微管结构正常的细胞,皮层动力蛋白仍呈均匀分布(图4)。
实验所用关键产品:抗comitin抗体(Michael Schleicher提供)、抗动力蛋白重链Y7抗体(Mike Koonce提供)。
3.4 DdCP224与动力蛋白/动力蛋白激活复合物的相互作用验证
实验目的:探究DdCP224是否与动力蛋白(dynein)及动力蛋白激活复合物(dynactin)存在直接或间接相互作用。
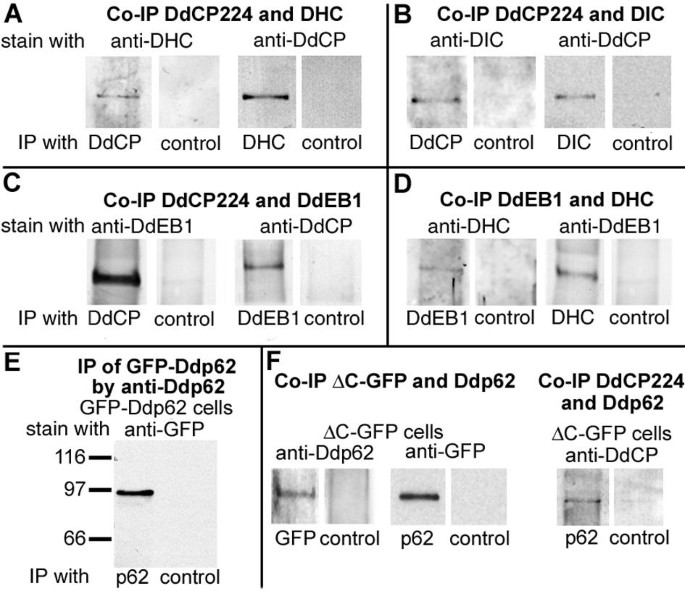
方法细节:提取野生型细胞(AX2)、GFP-Ddp62细胞及ΔC-GFP细胞的胞质裂解物,分别用抗DdCP224抗体(单抗2/165)、抗动力蛋白重链(DHC)抗体、抗动力蛋白中间链(DIC)抗体、抗DdEB1抗体(自制)、抗Ddp62抗体(自制,针对MBP-Ddp62融合蛋白)进行免疫共沉淀;通过Western blot检测共沉淀的蛋白。
结果解读:DdCP224与动力蛋白重链、中间链共沉淀,也与DdEB1(盘基网柄菌的EB1蛋白)共沉淀(图5A-D);更关键的是,DdCP224-ΔC-GFP与dynactin的p62亚基Ddp62共沉淀(图5F)——说明ΔC片段通过结合Ddp62,干扰了dynactin与动力蛋白的正常相互作用。
实验所用关键产品:抗DdCP224单抗2/165、抗DdEB1抗体(自制)、抗Ddp62抗体(自制)。
3.5 DdCP224与动力蛋白的共定位分析
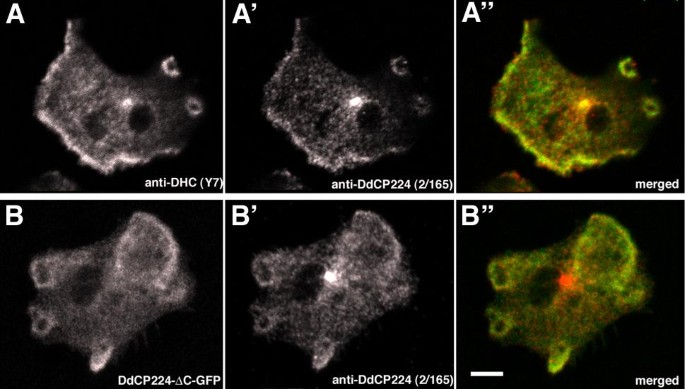
实验目的:观察DdCP224与动力蛋白的亚细胞共定位情况,明确相互作用的空间基础。
方法细节:用甲醛/丙酮固定ΔC-GFP细胞,分别用抗DdCP224抗体(单抗2/165)、抗动力蛋白重链Y7抗体进行免疫荧光染色。
结果解读:DdCP224与动力蛋白不仅在中心体重叠,还在细胞皮层的“前缘”及“胞饮杯”处共定位(图6A);更重要的是,ΔC-GFP片段也与内源性DdCP224在皮层共定位(图6B)——说明ΔC片段通过“竞争性结合”内源性DdCP224或dynactin,破坏了皮层动力蛋白的功能。
实验所用关键产品:抗DdCP224单抗2/165、抗动力蛋白重链Y7抗体(Mike Koonce提供)。
2. 文献综述解析
文献综述的核心评述逻辑:作者按“XMAP215家族蛋白的已知功能→酵母同源物的有丝分裂功能→长链XMAP215的未知角色”分层,系统梳理领域进展与不足。
现有研究的关键结论:XMAP215家族蛋白是微管动态的主要调控因子(促进微管延长、微管成核),酵母中的短链同源物Stu2p参与有丝分裂期的纺锤体定向,但长链单体XMAP215蛋白(如DdCP224)是否在间期参与微管-皮层相互作用,尚未有直接证据;技术方法优势:盘基网柄菌作为模式生物,其透明的细胞结构及易于遗传操作的特点,为研究微管动态提供了独特优势;局限性:此前研究未分析DdCP224截断体过表达对微管的影响,也未探究其与动力蛋白的相互作用。
文献的创新价值在于:首次将长链XMAP215蛋白(DdCP224)与间期细胞的微管-皮层相互作用关联,并证明其功能依赖于与动力蛋白/ dynactin复合物的相互作用。这一发现不仅填补了XMAP215家族蛋白功能的空白,也为理解微管-皮层相互作用的分子机制提供了新的调控节点。
3. Biomarker研究及发现成果解析
本研究聚焦于DdCP224蛋白的功能机制,未涉及生物标志物(Biomarker)的筛选、验证或应用研究。其核心成果可概括为三点:
1. 功能发现:长链XMAP215家族蛋白DdCP224是间期细胞微管与皮层相互作用的必需因子——过表达其N端截断体可完全破坏微管的放射状结构;
2. 机制明确:DdCP224通过与动力蛋白/ dynactin复合物相互作用介导微管-皮层连接——ΔC片段通过结合dynactin的Ddp62亚基,干扰了动力蛋白与皮层的结合;
3. 学术价值:首次证明长链XMAP215蛋白参与间期微管-皮层相互作用,突破了此前仅关注其“微管动力调控”的传统认知。
本研究虽未涉及Biomarker,但为后续探索“微管相关疾病的分子靶点”提供了重要基础——例如,DdCP224与动力蛋白的相互作用异常可能与中心体定位紊乱相关的疾病(如癌症)有关。
结论
本研究通过多维度实验,首次证明XMAP215家族蛋白DdCP224在间期细胞微管与皮层相互作用中的关键作用,并揭示其通过动力蛋白/ dynactin复合物介导的分子机制。这一发现不仅拓展了XMAP215家族蛋白的功能谱,也为理解微管-皮层相互作用的调控网络提供了新的视角。
