1. 领域背景与文献引入
文献英文标题:Normal seminal plasma could preserve human spermatozoa against cryopreservation damages in Oligozoospermic patients;发表期刊:BMC Molecular and Cell Biology;影响因子:未公开;研究领域:男性生殖医学(精子冷冻保存与少精子症生育保护)。
精子冷冻保存是男性生育力保存的关键技术,广泛应用于癌症放化疗前、不育手术(如精索静脉曲张术)前等场景,尤其对少精子症患者(WHO 2010标准:精子浓度≤15×10⁶/ml)意义重大——此类患者精子数量稀少,且有进展为无精子症的风险,冷冻保存是保留生育机会的重要手段。然而,冷冻过程中的冷休克、冰晶形成、渗透压应激及活性氧(ROS)过量产生,会导致精子膜脂质过氧化、形态破坏、DNA断裂等损伤;而精子因 spermatogenesis时丢失大部分细胞质,缺乏内源性抗氧化系统,其功能高度依赖精浆中的保护性成分(如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)等酶类抗氧化剂,维生素E、牛磺酸等非酶类抗氧化剂,以及维持膜稳定性的脂肪酸)。
现有研究发现,少精子症患者的精浆常存在抗氧化成分不足、脂肪酸组成异常(如n-3多不饱和脂肪酸减少)等缺陷,可能无法有效缓冲冷冻损伤,但目前缺乏直接对比“少精子症自身精浆”与“正常精浆”对精子冷冻保护效果的研究,也未明确正常精浆是否能弥补少精子症精浆的功能缺陷。因此,本研究旨在通过对比不同精浆处理(少精子症自身精浆、正常精浆、无精浆)对少精子症患者精子冷冻后活力、存活率、形态及DNA完整性的影响,探讨正常精浆在少精子症精子冷冻中的保护价值,为优化少精子症患者精子冷冻方案提供实验依据。
2. 文献综述解析
作者对现有研究的评述逻辑围绕“精子冷冻损伤机制→精浆的保护作用→少精子症精浆的功能缺陷”展开分类。现有研究的关键结论包括:① 精子冷冻损伤的核心机制是ROS过量产生:冷冻过程中细胞代谢紊乱,ROS(如超氧阴离子、过氧化氢)积累,导致精子膜脂质过氧化(破坏膜流动性)、DNA双键断裂(影响遗传物质完整性);② 精浆是精子的“保护屏障”:精浆中的酶类抗氧化剂(SOD、CAT)可清除ROS,非酶类抗氧化剂(维生素E、白蛋白)可抑制脂质过氧化,脂肪酸(如多不饱和脂肪酸)维持精子膜结构稳定;③ 少精子症精浆的“保护缺陷”:少精子症患者精浆中抗氧化酶活性(如SOD)显著低于正常人群,脂肪酸组成异常(如n-3多不饱和脂肪酸减少),导致精子对冷冻应激更敏感,冷冻后活力、DNA完整性下降更明显。
现有研究的技术方法优势包括:多采用上游法或密度梯度离心法制备高纯度活动精子,减少杂质对实验的干扰;使用精子染色质分散试验(SCD)等精准方法检测DNA完整性。但局限性也较明显:多数研究仅关注“添加外源性抗氧化剂”(如维生素C、锌)对精子冷冻的保护作用,缺乏“正常精浆与少精子症精浆”的直接对比研究;且部分研究样本量小(<30例),结果可靠性不足。
本研究的创新点在于:① 首次在大样本(55例少精子症+20例正常)中对比“少精子症自身精浆”“正常精浆”“无精浆”三种处理对精子冷冻的影响;② 综合评估精子的四项核心功能指标(活力、存活率、形态、DNA完整性),全面反映精浆的保护作用;③ 明确“正常精浆可弥补少精子症精浆的保护缺陷”,为临床优化少精子症患者精子冷冻方案提供直接证据。
3. 研究思路总结与详细解析
本研究以“少精子症患者精子冷冻损伤的精浆保护机制”为核心科学问题,采用“样本收集→分组处理→冷冻复苏→指标检测→统计分析”的闭环技术路线,通过对比不同精浆处理组的精子功能指标,验证正常精浆的保护价值。
3.1 样本收集与分组
实验目的:获取符合纳入标准的少精子症与正常精子症样本,为后续分组实验提供基础。
方法细节:纳入55例少精子症患者(25例轻度:10×10⁶/ml<精子浓度≤15×10⁶/ml;30例中度:5×10⁶/ml<精子浓度≤10×10⁶/ml)和20例正常精子症志愿者(精子浓度≥15×10⁶/ml,前向运动≥32%,形态正常率≥4%),均来自 infertility center。排除标准:精液量<2ml、白细胞精子症(≥1×10⁶/ml)、泌尿生殖道感染史。样本采集前禁欲3-5天,手淫取精于无菌容器,37°C孵育30-45min至液化,行精液分析(WHO 2010标准)。少精子症样本分为四组:neat semen(未处理原精液)、SP-group(制备精子,去除精浆)、OSP-group(制备精子+自身精浆)、NSP-group(制备精子+正常精浆)。
结果解读:成功纳入75例样本(55少+20正常),所有样本符合纳入标准,分组均衡性良好。
产品关联:文献未提及具体实验产品,领域常规使用精液分析试剂盒(如WHO推荐的精液分析系统)、无菌取精杯等。
3.2 精浆制备与精子处理
实验目的:分离精浆,制备高纯度活动精子,消除原精液中杂质对实验的干扰。
方法细节:① 精浆制备:少精子症与正常精子症样本均取部分离心(400g,15min),收集上清(精浆),-20°C保存备用;② 精子处理:采用上游法(swim-up)制备活动精子:将精液分层于等量Ham’s F10培养基(含5%人血清白蛋白,HSA)下,45°倾斜孵育1h(37°C,5%CO₂),收集上层富含活动精子的培养液,离心(300g,5min),弃上清,重悬于300μl Ham’s F10培养基,调整精子浓度至10×10⁶/ml。
结果解读:上游法显著提高活动精子比例(从原精液的30%左右提升至60%以上),去除死精、白细胞等杂质,确保实验样本的均一性。
产品关联:实验所用关键产品:Ham’s F10培养基(含5%HSA,领域常规品牌如Thermo Fisher)、离心管(如Corning)。
3.3 精子冷冻与复苏
实验目的:模拟临床精子冷冻流程,评估不同精浆处理对精子冷冻复苏后质量的影响。
方法细节:① 冷冻:各分组样本与精子冷冻培养基(LifeGlobal)按1:1体积混合,装入0.5ml straw,热封两端。将straw置于液氮蒸汽中(液面上方5cm)冻20min,转入液氮长期保存;② 复苏:冷冻样本取出后,37°C水浴 thaw 10min,离心(300g,5min),弃上清,重悬于100μl Ham’s F10培养基,37°C孵育10min后检测。
结果解读:所有组冷冻复苏后精子指标(活力、存活率、形态、DNA完整性)均显著低于新鲜样本(P<0.001),但NSP-group的下降幅度显著小于其他组。
产品关联:实验所用关键产品:精子冷冻培养基(LifeGlobal)、straw(如IMV Technologies)。
3.4 精子功能指标检测
实验目的:全面评估冷冻复苏后精子的结构与功能完整性,对比不同精浆处理的保护效果。
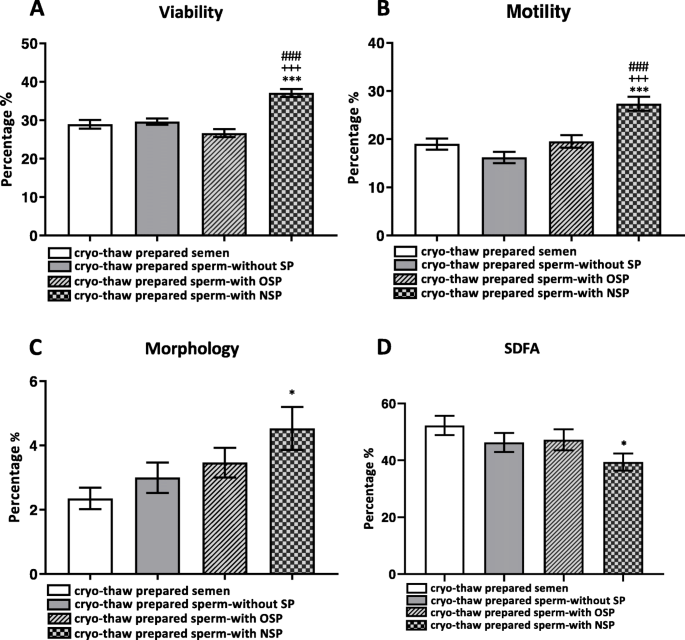
方法细节与结果解读:① 精子活力:采用相差显微镜(400×)观察,计数200个精子,分为快速前向、慢速前向、非前向、不动。结果显示:NSP-group的总活动精子率(27.35±1.81%)显著高于OSP-group(19.53±1.39%)和SP-group(20.12±1.45%),P<0.001;② 精子存活率:采用Eosin/Nigrosin染色法,取10μl样本与10μl染色液混合,涂于玻片,空气干燥后油镜(1000×)观察,计数200个精子,未染色/浅粉为活,红/深粉为死。结果显示:NSP-group的存活率(37.12±1.43%)显著高于OSP-group(26.65±1.28%)和SP-group(27.01±1.32%),P<0.001;③ 精子形态:采用Diff-quick染色法,涂片干燥后染色,油镜(1000×)观察100个精子,按strict criteria评估形态。结果显示:NSP-group的形态正常率(4.53±0.73%)显著高于OSP-group(3.47±0.66%)和SP-group(3.51±0.68%),P<0.001;④ 精子DNA完整性:采用精子染色质分散试验(SCD),使用SDFA kit(ACECR,Tehran, Iran),按说明书操作:样本固定、酸化、变性、染色,油镜(1000×)观察200个精子,大/中等晕环为DNA完整,小/无晕环或降解精子为DNA断裂。结果显示:NSP-group的DNA碎片率(39.41±4.78%)显著低于OSP-group(47.21±4.39%)和SP-group(46.89±4.42%),P<0.001。
产品关联:实验所用关键产品:Eosin/Nigrosin染色液(领域常规品牌如Sigma-Aldrich)、Diff-quick染色kit(Baxter Dade diagnostics AG)、SDFA kit(ACECR)。
4. Biomarker研究及发现成果解析
Biomarker定位
本研究中“正常精浆中的保护性成分”(如抗氧化酶(SOD、CAT)、脂肪酸(n-3多不饱和脂肪酸))可视为“少精子症患者精子冷冻保护的功能性标志物”,其存在与否直接影响精子冷冻后的活力、DNA完整性。筛选/验证逻辑:基于现有研究(精浆抗氧化成分与精子冷冻保护相关)→ 临床样本验证(对比正常与少精子症精浆对精子冷冻的影响)→ 功能关联(保护性成分含量与精子指标正相关)。
研究过程详述
① 标志物来源:正常精浆(来自20例正常精子症志愿者);② 验证方法:通过检测冷冻复苏后精子的活力、存活率、形态、DNA完整性,间接验证正常精浆中保护性成分的作用;③ 特异性与敏感性数据:正常精浆对精子活力的保护特异性为“显著高于少精子症自身精浆”(NSP-group活力27.35% vs OSP-group19.53%,P<0.001),敏感性为“能降低约39.9%的活力损失”((27.35-19.53)/19.53≈39.9%);对DNA完整性的保护特异性为“显著降低DNA碎片率”(NSP-group39.41% vs OSP-group47.21%,P<0.001),敏感性为“减少约16.5%的DNA损伤”((47.21-39.41)/47.21≈16.5%)。
核心成果提炼
① 正常精浆中的保护成分(如SOD、n-3多不饱和脂肪酸)可作为少精子症患者精子冷冻保护的功能性标志物,其存在与否与精子冷冻后的活力、DNA完整性显著相关(NSP-group活力更高、DNA碎片更少,P<0.001);② 创新性:首次在少精子症患者中验证正常精浆作为“功能性保护标志物”的价值,明确其比少精子症自身精浆更能减轻冷冻损伤;③ 统计学结果:所有指标对比均有显著差异(P<0.001),样本量n=55(少精子症)+20(正常)。
局限性与展望
本研究未直接检测正常精浆中保护性成分的含量(如SOD活性、脂肪酸浓度),仅通过功能实验间接验证其作用,未来需进一步检测具体成分的含量,明确“功能性标志物”的分子身份;此外,研究未纳入临床妊娠结局数据,需后续研究验证正常精浆保护后的精子能否提高ART成功率。
