1. 领域背景与文献引入
文献英文标题:Octamer-binding factor 6 (Oct-6/Pou3f1) is induced by interferon and contributes to dsRNA-mediated transcriptional responses;发表期刊:BMC Cell Biology;影响因子:未公开;研究领域:先天免疫应答与转录因子调控
先天免疫是机体抵御病原体入侵的第一道防线,干扰素(IFN)作为关键细胞因子,通过激活Janus激酶/信号转导及转录激活因子(Jak/Stat)通路,调控干扰素刺激基因(ISGs)的表达,介导抗病毒、免疫调节等核心生物学功能,这一调控网络是先天免疫领域的研究核心。Pit-Oct-Unc(POU)家族转录因子因高度保守的POU结构域得名,已知功能集中于细胞发育、分化过程,其中Oct-6(Pou3f1)的研究局限于施万细胞髓鞘形成、神经发育等场景,此前认为其表达严格局限于胚胎干细胞、神经胶质细胞等发育相关细胞,未涉及免疫细胞或免疫应答领域。当前领域的核心空白在于,POU家族转录因子在先天免疫中的作用尚未被系统探索,Oct-6是否参与干扰素介导的免疫应答及具体调控机制完全未知,这一空白限制了对先天免疫转录调控网络的全面理解。本研究针对这一空白,首次揭示Oct-6是干扰素诱导的干扰素刺激基因,可在成纤维细胞和巨噬细胞中表达并参与双链RNA(dsRNA)介导的转录应答,为POU家族转录因子的功能拓展及先天免疫调控机制的完善提供了新证据。
2. 文献综述解析
作者围绕“干扰素信号通路调控”与“POU家族转录因子功能”两大维度展开综述,系统梳理了干扰素通过Jak/Stat通路调控干扰素刺激基因的经典机制,以及Oct-6在发育过程中的已知表达模式与功能。
现有研究已明确,干扰素α/β和干扰素γ分别通过结合不同受体激活Janus激酶/信号转导及转录激活因子通路,Stat1作为关键分子,可形成同源二聚体或与Stat2、Irf9形成复合物,结合到靶基因启动子的干扰素γ激活序列(GAS)或干扰素刺激应答元件(ISRE),调控干扰素刺激基因的表达,这些基因是干扰素发挥生物学功能的核心效应分子。对于Oct-6的研究,现有结论主要基于基因敲除小鼠模型,证实其在施万细胞中是调控髓鞘形成的关键转录因子,缺失会导致外周神经髓鞘化缺陷,但其表达被认为严格局限于发育相关细胞,未涉及免疫细胞或免疫应答场景。现有研究的技术方法优势在于,利用基因敲除、免疫沉淀、电泳迁移率变动分析(EMSA)等经典分子生物学技术,清晰解析了Oct-6在发育中的功能及调控机制,但局限性也十分明显,即未关注Oct-6在免疫应答中的潜在作用,对干扰素诱导的非经典干扰素刺激基因的研究覆盖不足,导致先天免疫转录调控网络中POU家族转录因子的作用长期被忽视。本研究的创新价值在于,突破了Oct-6仅参与发育调控的传统认知,首次发现其作为干扰素诱导的蛋白在免疫相关细胞中表达,并明确其参与dsRNA介导的转录应答,填补了POU家族转录因子在先天免疫领域的研究空白,为理解先天免疫的转录调控网络提供了新的视角。
3. 研究思路总结与详细解析
本研究的核心目标是明确Oct-6在干扰素应答中的表达特征、调控机制及功能,核心科学问题为“Oct-6是否为干扰素诱导的干扰素刺激基因?其诱导依赖的信号通路是什么?是否参与先天免疫中的转录调控?”,技术路线遵循“诱导验证→通路解析→机制探索→功能验证”的闭环逻辑,通过细胞水平实验、基因敲除模型、转录组分析等多维度实验,系统解析Oct-6的免疫调控功能。
3.1 干扰素诱导Oct-6表达的细胞水平验证
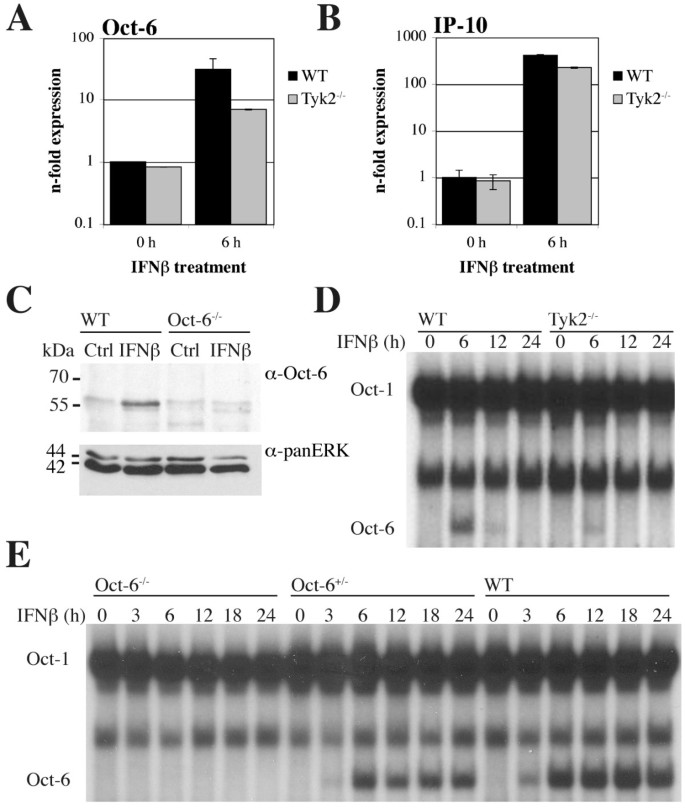
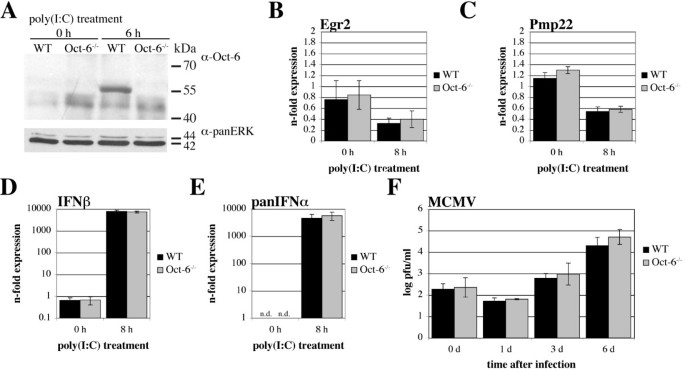
实验目的是验证Oct-6是否可被干扰素诱导,且在非发育相关细胞中表达。方法细节:选取野生型(WT)和Tyk2基因敲除的原代胚胎成纤维细胞(pMEF)、小鼠施万细胞系SW10,分别用干扰素β处理6小时或仅用培养基处理作为对照,采用实时定量反转录PCR(RT-qPCR)检测Oct-6 mRNA表达水平,免疫沉淀实验检测蛋白表达,电泳迁移率变动分析检测Oct-6的DNA结合活性。结果解读:实时定量反转录PCR结果显示,野生型原代胚胎成纤维细胞中Oct-6 mRNA表达经干扰素β处理后显著上调,Tyk2敲除细胞中的诱导水平显著降低(图1A),同时作为阳性对照的干扰素靶基因C-X-C基序趋化因子10(Cxcl10/IP-10)也被显著诱导(图1B);免疫沉淀实验证实,干扰素β处理后野生型原代胚胎成纤维细胞中可检测到Oct-6蛋白,未处理细胞及Oct-6敲除细胞中无特异性条带(图1C);电泳迁移率变动分析结果显示,干扰素β处理后出现特异性的Oct-6 DNA结合复合物,该复合物在Tyk2敲除细胞中显著减弱,且可被Oct-6抗体超迁移(图1D-E)。在SW10细胞中,干扰素β处理同样可诱导Oct-6 mRNA和蛋白表达,且DNA结合活性在处理后3-8小时可被检测到(图2)。实验所用关键产品:Santa Cruz的抗Oct-6抗体(C-20)、BD Transduction Laboratories的panERK抗体、GE Healthcare的ECL™检测系统、Calbiochem的干扰素β试剂。
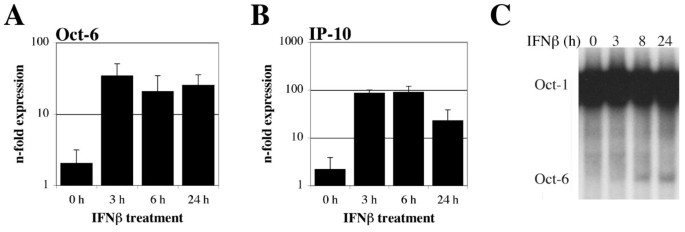
3.2 巨噬细胞中Oct-6的干扰素诱导及信号通路依赖分析
实验目的是验证Oct-6在巨噬细胞中的干扰素诱导特征,并明确其依赖的信号通路分子。方法细节:分离培养野生型小鼠的骨髓来源巨噬细胞(BMMs),分别用干扰素β、干扰素γ、白细胞介素-6(IL-6)处理不同时间,通过实时定量反转录PCR、免疫沉淀、电泳迁移率变动分析检测Oct-6的mRNA表达、蛋白水平及DNA结合活性;同时选取Stat1、Tyk2、干扰素α/β受体1(Ifnar1)、Irf1基因敲除的骨髓来源巨噬细胞,经干扰素β处理后检测Oct-6的表达情况,分析通路依赖。结果解读:干扰素β和干扰素γ均可诱导骨髓来源巨噬细胞中Oct-6的mRNA表达、蛋白积累及DNA结合活性,其中干扰素β的诱导水平略高于干扰素γ,而白细胞介素-6处理无明显诱导作用(图3);Stat1敲除的骨髓来源巨噬细胞中,干扰素β几乎无法诱导Oct-6表达,Tyk2敲除细胞中诱导水平显著降低,干扰素α/β受体1敲除细胞中无诱导(图4A);Irf1敲除细胞中Oct-6的干扰素β诱导水平与野生型细胞无显著差异,说明Oct-6的诱导是Stat1直接调控而非通过Irf1间接介导(图4B)。实验所用关键产品:Calbiochem的干扰素γ、白细胞介素-6试剂,Santa Cruz的抗Oct-1、Oct-2抗体。


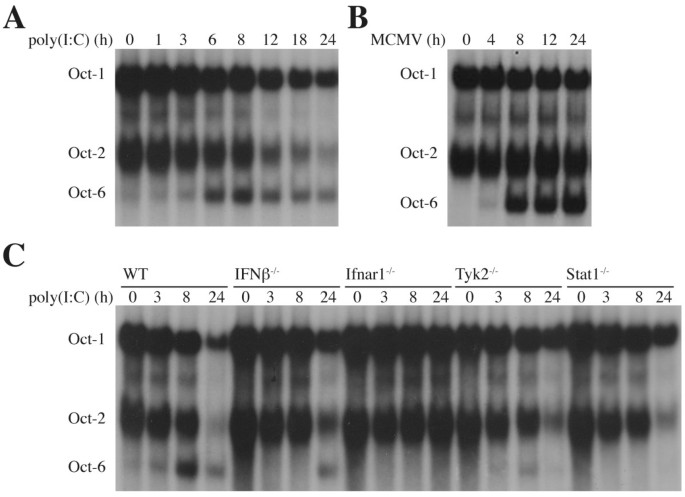
3.3 dsRNA与病毒感染中Oct-6的诱导机制验证
实验目的是探索Oct-6在病原体相关模式分子刺激下的诱导是否依赖干扰素的自分泌/旁分泌作用。方法细节:用合成dsRNA类似物聚肌苷酸-聚胞苷酸(poly(I:C))处理骨髓来源巨噬细胞,或用鼠巨细胞病毒(MCMV)感染骨髓来源巨噬细胞,通过电泳迁移率变动分析检测Oct-6的DNA结合活性;同时使用干扰素α/β受体1、干扰素β、Tyk2、Stat1基因敲除的骨髓来源巨噬细胞,经聚肌苷酸-聚胞苷酸处理后检测Oct-6的表达,明确信号通路依赖。结果解读:聚肌苷酸-聚胞苷酸处理和鼠巨细胞病毒感染均可显著诱导骨髓来源巨噬细胞中Oct-6的DNA结合活性(图5A-B);干扰素α/β受体1敲除细胞中,聚肌苷酸-聚胞苷酸无法诱导Oct-6表达,干扰素β敲除细胞中诱导延迟且水平降低,Tyk2和Stat1敲除细胞中诱导显著减弱,说明Oct-6在聚肌苷酸-聚胞苷酸和病毒感染中的诱导完全依赖干扰素α/β的自分泌/旁分泌信号(图5C)。实验所用关键产品:GE Healthcare的聚肌苷酸-聚胞苷酸,鼠巨细胞病毒株。
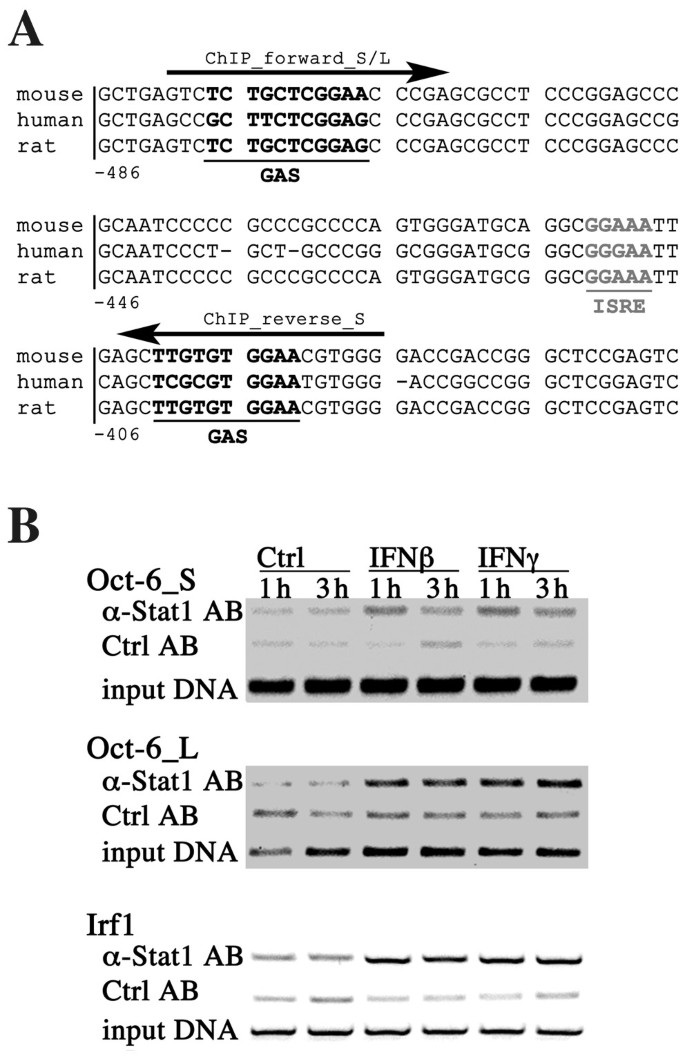
3.4 Stat1结合Oct-6启动子的直接调控验证
实验目的是明确Stat1是否直接结合到Oct-6的启动子区域介导其诱导表达。方法细节:比对小鼠、大鼠、人Oct-6基因启动子上游序列,通过转录因子结合位点预测工具(Patch)筛选潜在的GAS和ISRE位点;采用染色质免疫沉淀(ChIP)实验,用干扰素β或干扰素γ处理骨髓来源巨噬细胞1小时和3小时后,免疫沉淀Stat1蛋白,通过PCR扩增Oct-6启动子的特定区域,验证Stat1的结合。结果解读:序列比对发现Oct-6启动子上游-481至-387区域存在保守的GAS和ISRE位点(图6A);染色质免疫沉淀实验结果显示,干扰素β或干扰素γ处理后,Stat1可特异性结合到该区域,而未处理细胞中结合水平极低,同时作为阳性对照的Irf1启动子区域也检测到Stat1的结合(图6B),证实Stat1直接结合Oct-6启动子介导其干扰素诱导。实验所用关键产品:Pavel Kovarik提供的Stat1抗体,Agrobiogen的Biotaq DNA聚合酶。
3.5 Oct-6的亚细胞定位分析
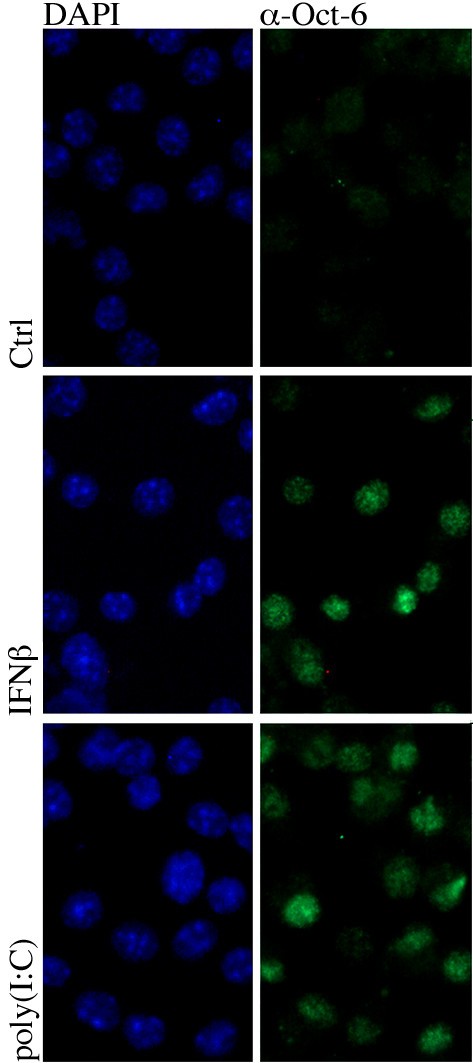
实验目的是确定干扰素和dsRNA诱导的Oct-6的亚细胞定位,明确其发挥功能的场所。方法细节:将骨髓来源巨噬细胞接种于载玻片上,分别用干扰素β、聚肌苷酸-聚胞苷酸处理6小时或仅用培养基处理,用4%多聚甲醛固定细胞,甲醇透化后,通过免疫荧光染色检测Oct-6的定位,DAPI染色标记细胞核。结果解读:未处理细胞中未检测到Oct-6的荧光信号,干扰素β或聚肌苷酸-聚胞苷酸处理后,Oct-6的荧光信号仅出现在细胞核中(图7),说明诱导表达的Oct-6定位于细胞核内,可直接参与转录调控。实验所用关键产品:Santa Cruz的抗Oct-6抗体,Invitrogen的Alexa-Fluor™ 488标记的羊抗兔二抗。
3.6 Oct-6在dsRNA介导的转录应答中的功能验证
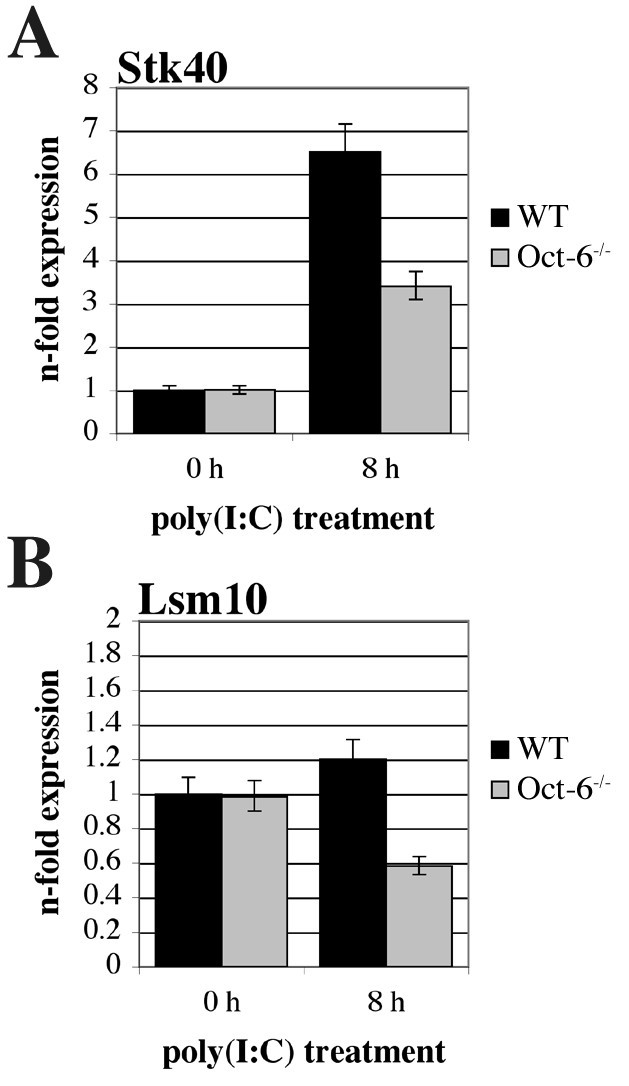
实验目的是解析Oct-6在先天免疫应答中的下游靶基因及调控功能。方法细节:分离培养野生型和Oct-6敲除的胎肝来源巨噬细胞(FLMs),用聚肌苷酸-聚胞苷酸处理8小时后,采用小鼠基因组芯片进行转录组分析,筛选差异表达基因;选取丝氨酸/苏氨酸激酶40(Stk40)和U7 snRNP特异性Sm样蛋白Lsm10作为候选靶基因,通过实时定量反转录PCR验证其表达差异。结果解读:转录组分析显示,共有200个基因在野生型和Oct-6敲除细胞中的表达差异≥2倍(P<0.05),其中约60%的基因在敲除细胞中表达降低,提示Oct-6具有转录激活和抑制双重功能;实时定量反转录PCR验证结果显示,Stk40在野生型细胞中经聚肌苷酸-聚胞苷酸处理后表达上调约7倍,而在Oct-6敲除细胞中仅上调约3倍(n=6,P<0.01)(图9A);Lsm10在野生型细胞中不受聚肌苷酸-聚胞苷酸影响,但在Oct-6敲除细胞中表达降低约2倍(n=6,P<0.01)(图9B)。此外,研究还发现Oct-6的缺失不影响干扰素α/β的表达及鼠巨细胞病毒的复制(图8)。实验所用关键产品:Applied Biosystems的小鼠基因组芯片,BioRad的iScript第一链cDNA合成试剂盒。
4. Biomarker研究及发现成果解析
本研究中涉及的Biomarker为Oct-6,属于转录调控型生物标志物,其筛选与验证遵循“细胞诱导验证→信号通路解析→启动子结合验证→功能靶基因验证”的完整逻辑链条。
Oct-6的来源为干扰素或dsRNA处理后的成纤维细胞、巨噬细胞等免疫相关细胞,验证方法包括实时定量反转录PCR定量检测mRNA表达、免疫沉淀检测蛋白水平、电泳迁移率变动分析检测DNA结合活性、染色质免疫沉淀验证转录因子结合、免疫荧光定位等。特异性方面,Oct-6在未处理的免疫细胞中无表达,仅在干扰素α/β、干扰素γ、dsRNA处理或病毒感染后被诱导,且诱导严格依赖干扰素信号通路;敏感性方面,干扰素β处理原代胚胎成纤维细胞6小时后,Oct-6 mRNA表达水平较未处理细胞显著上调(n=2,P<0.05)。
核心成果提炼:Oct-6作为新发现的干扰素刺激基因,其功能关联主要体现在参与dsRNA介导的先天免疫转录应答,可调控Stk40和Lsm10的表达,其中Stk40被报道与NFκB和p53的调控相关,Lsm10参与组蛋白mRNA的3"端加工,提示Oct-6可能通过调控这些基因影响免疫细胞的功能;创新性在于首次突破了Oct-6仅参与发育调控的传统认知,明确其为先天免疫应答中的转录调控因子,填补了POU家族转录因子在先天免疫领域的研究空白;统计学结果显示,野生型与Oct-6敲除细胞中Stk40和Lsm10的表达差异均具有显著统计学意义(P<0.01,n=6)。此外,研究还提示Oct-6可能作为干扰素应答的新型标志物,为先天免疫应答的转录调控网络研究提供了新的靶点。
