1. 领域背景与文献引入
文献英文标题:Mig12, a novel Opitz syndrome gene product partner, is expressed in the embryonic ventral midline and co-operates with Mid1 to bundle and stabilize microtubules;发表期刊:BMC Cell Biology;影响因子:未公开;研究领域:发育生物学(Opitz综合征相关微管调控机制)
Opitz G/BBB综合征是一类以胚胎中线发育异常为特征的遗传性疾病,1969年首次被报道,临床症状包括眼距过宽、腭裂、尿道下裂等,具有高度表型异质性。1997年,研究人员定位到X连锁型Opitz综合征的致病基因MID1,其编码的Mid1蛋白属于TRIM/RBCC家族,可锚定至微管并通过与磷酸酶2A(PP2A)的α4亚基相互作用,以E3泛素连接酶的功能调控PP2A在微管上的降解。领域共识:微管的动态调控在胚胎细胞分裂、迁移及中线组织发育中发挥关键作用,微管功能异常可导致多种发育畸形。当前该领域的研究热点聚焦于Mid1在微管动态调控中的具体分子机制,以及其与Opitz综合征发病的直接关联,但未解决的核心问题在于Mid1的完整功能调控网络尚未明确,是否存在其他相互作用蛋白参与其微管调控功能及胚胎中线发育过程仍不清楚。针对这一研究空白,本研究通过酵母双杂交筛选Mid1的新型互作蛋白,解析其表达模式及协同调控微管的功能,旨在填补Opitz综合征发病机制中的关键分子环节。
2. 文献综述解析
作者围绕Opitz综合征的遗传背景、Mid1蛋白的结构与功能两大维度,系统梳理了领域内现有研究的进展与局限性,为本次研究的创新点提供了明确的学术定位。
现有研究已明确Opitz综合征是一类中线发育异常的异质性遗传疾病,X连锁型由MID1基因的功能缺失突变导致,患者症状的高度异质性提示可能存在其他修饰基因参与疾病发生;Mid1蛋白作为TRIM家族成员,其RING结构域、B-Box结构域及卷曲螺旋结构域共同构成其核心功能区,可通过动态磷酸化调控与微管的结合,并通过与PP2A的α4亚基相互作用介导PP2A的泛素化降解。此前研究采用酵母双杂交、免疫沉淀(IP)、免疫荧光等技术,明确了Mid1与PP2A的相互作用及泛素连接酶功能,为解析其微管调控机制提供了基础,但这些研究的局限性在于仅聚焦于Mid1与PP2A的单一相互作用,未深入探索Mid1的其他功能调控蛋白,导致其在Opitz综合征中的具体生物学功能仍不明确,无法完整解释胚胎中线发育异常的分子机制。通过对比现有研究的未解决问题,本研究的创新价值在于首次鉴定了Mid1的新型互作蛋白Mig12,系统解析了其在胚胎中线组织的表达模式及与Mid1协同稳定微管的功能,填补了Mid1功能调控网络的空白,为Opitz综合征的发病机制提供了新的分子视角。
3. 研究思路总结与详细解析
本研究的整体研究目标是鉴定Mid1的新型相互作用蛋白,解析其在胚胎发育中的表达模式及与Mid1协同调控微管的分子机制,阐明其在Opitz综合征发病中的潜在作用;核心科学问题为Mid1的互作蛋白如何参与其微管调控功能,以及该调控过程与胚胎中线发育异常的关联;技术路线遵循“互作蛋白筛选→体内验证→表达模式分析→细胞功能验证→机制解析”的闭环逻辑,通过多种分子与细胞生物学技术系统验证研究假设。
3.1 Mid1互作蛋白的筛选与鉴定
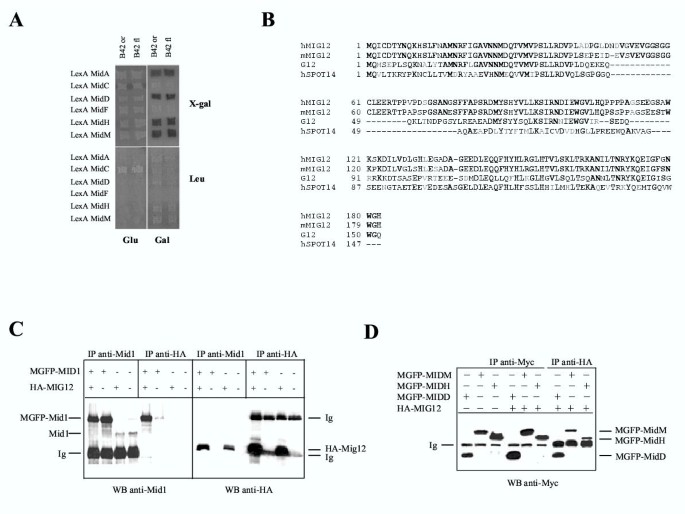
实验目的为寻找Mid1的新型细胞互作蛋白,补充其功能调控网络,明确未被发现的分子调控环节。方法细节:以包含Mid1卷曲螺旋、FNIII重复序列及RFP样结构域的C端片段(MidM)为诱饵,通过酵母双杂交系统筛选NIH3T3细胞cDNA文库,共筛选5×10^6个独立克隆,获得阳性克隆后进行序列比对分析;随后在HEK293细胞中分别转染MycGFP标记的Mid1及HA标记的Mig12,通过免疫沉淀实验验证两者的体内相互作用,并通过Mid1的截短突变体明确互作的关键结构域。结果解读:酵母双杂交筛选得到一个新型基因MIG12,其编码蛋白与Mid1的卷曲螺旋结构域特异性结合;免疫沉淀实验证实,内源性及外源性Mid1与Mig12均存在特异性体内相互作用,且仅包含卷曲螺旋结构域的Mid1突变体即可与Mig12结合。产品关联:文献未提及具体实验产品,领域常规使用酵母双杂交筛选试剂盒、免疫沉淀相关抗体与试剂、Western blot检测系统等。
3.2 Mig12的胚胎表达模式分析
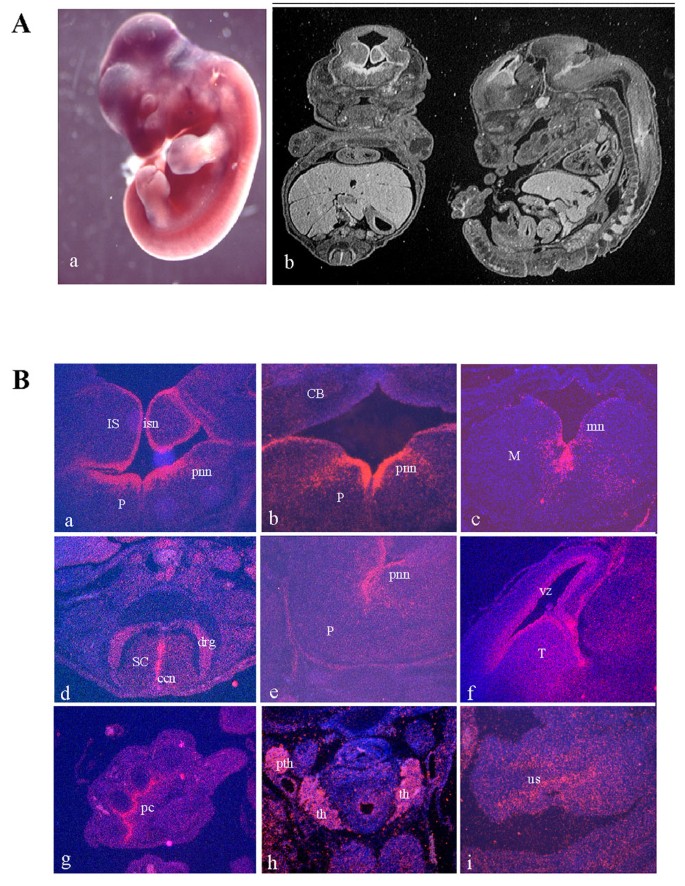
实验目的为明确Mig12在胚胎发育中的组织分布特征,验证其与Mid1的生理相关性及在Opitz综合征受累组织中的表达情况。方法细节:以Mig12的cDNA片段为探针,对E9.5至E14.5的小鼠胚胎进行整体原位杂交及切片原位杂交,通过放射自显影及染色观察其表达部位。结果解读:Mig12在胚胎发育早期(E9.5-E11.5)呈泛表达模式,E14.5时表达显著富集于中枢神经系统中线区域(如后脑的小脑原基、脑桥、延髓神经上皮及脊髓中央管)、泌尿生殖窦、指骨软骨膜等部位,这些区域与Mid1的表达区域高度重叠,且均为Opitz综合征患者的主要受累组织。产品关联:文献未提及具体实验产品,领域常规使用原位杂交探针合成试剂盒、组织切片制备与染色试剂等。
3.3 Mig12与Mid1的细胞内共定位及微管结合分析
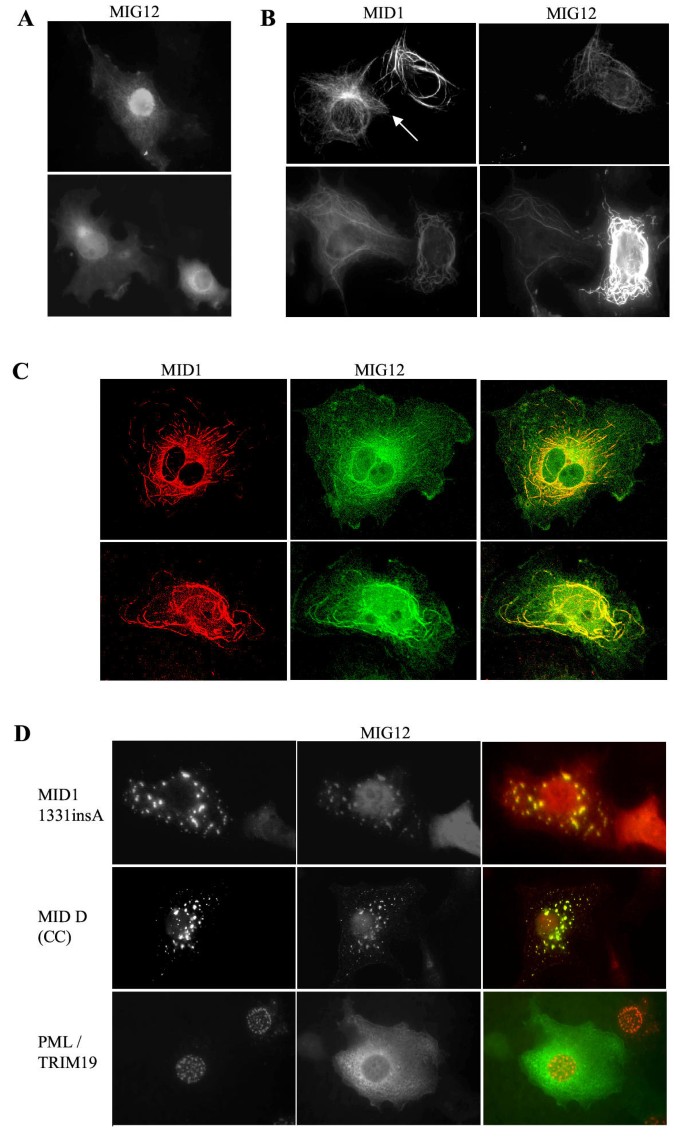
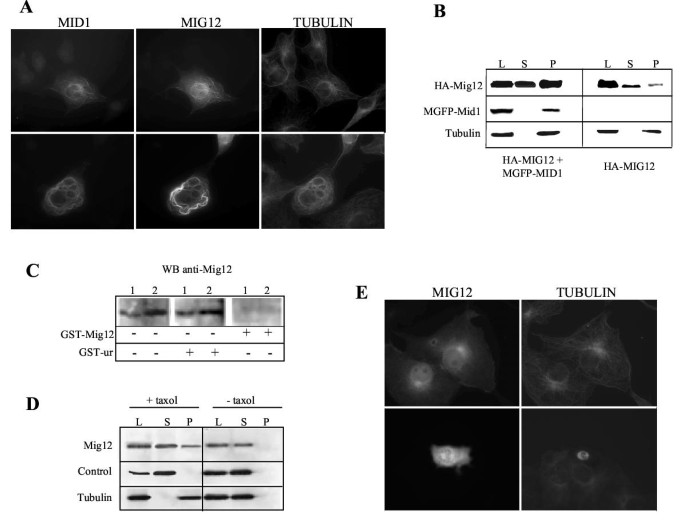
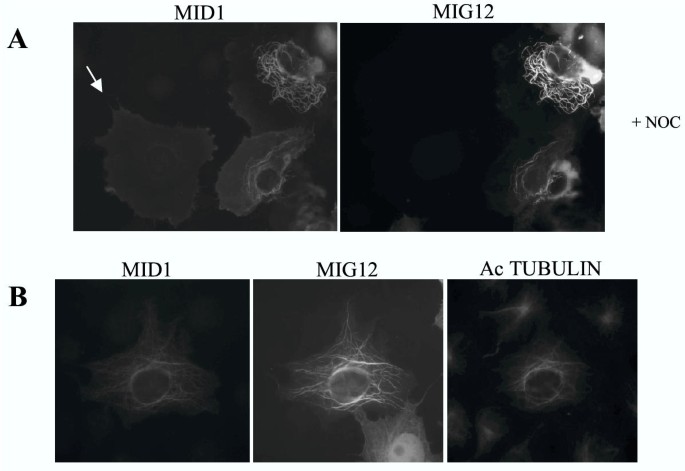
实验目的为解析Mig12与Mid1在细胞内的亚细胞定位特征,明确两者相互作用对微管分布的影响。方法细节:在Cos7细胞中分别或共转染标记的Mig12与Mid1表达载体,通过免疫荧光显微镜及共聚焦显微镜观察蛋白定位;通过紫杉醇处理稳定微管后,进行微管沉降实验,分离聚合微管组分与可溶性组分,通过Western blot检测Mig12与Mid1的分布。结果解读:单独表达时,Mig12弥散分布于细胞核与细胞质,部分富集于微管组织中心区域,且部分存在于聚合微管组分中;与Mid1共表达时,两者共同定位于细胞质中的粗大致密微管束结构,共聚焦显微镜证实两者的共定位;微管沉降实验显示,共转染后Mid1与Mig12均大量存在于聚合微管沉淀中,证实这些微管束为微管结构。产品关联:文献未提及具体实验产品,领域常规使用免疫荧光标记抗体、共聚焦显微镜、微管沉降实验相关试剂等。
3.4 Mig12与Mid1协同稳定微管的功能验证
实验目的为验证Mig12与Mid1协同调控微管稳定性的功能,明确其在微管动态调控中的作用机制。方法细节:在Cos7细胞中共转染Mig12与Mid1,用40μM诺考达唑(微管解聚剂)处理1小时后,通过免疫荧光观察微管结构变化;同时用乙酰化微管抗体(稳定微管的特异性标记)染色,分析微管的稳定性。结果解读:共转染细胞形成的微管束对诺考达唑具有显著抗性,而单独表达Mid1的细胞在诺考达唑处理后微管完全解聚;进一步染色显示,这些微管束富含乙酰化微管,证实其为稳定的微管阵列。产品关联:文献未提及具体实验产品,领域常规使用微管解聚剂、乙酰化微管特异性抗体等。
4. Biomarker研究及发现成果
本研究鉴定的Mig12是一种新型的Mid1互作蛋白,属于潜在的Opitz综合征相关分子标志物,其筛选与验证遵循“互作筛选→体内验证→表达模式分析→功能验证”的完整逻辑链条,为Opitz综合征的发病机制提供了新的分子靶点。
Mig12的筛选与验证逻辑为:通过酵母双杂交筛选Mid1的互作蛋白,获得MIG12基因;通过免疫沉淀实验验证其与Mid1的体内特异性相互作用;通过原位杂交分析其在胚胎中线组织的高表达模式;通过细胞实验验证其与Mid1协同稳定微管的功能。研究过程中,Mig12来源于NIH3T3细胞的cDNA文库,通过免疫沉淀实验证实其与Mid1的卷曲螺旋结构域特异性结合,原位杂交显示其在E14.5小鼠胚胎的中枢神经系统中线、泌尿生殖器官等Opitz综合征受累组织中高表达;细胞实验中,免疫荧光及微管沉降实验证实其可与微管结合,且与Mid1共表达时可形成稳定的微管束,对诺考达唑具有抗性;文献未明确提供Mig12的敏感性与特异性量化数据,但明确其仅与Mid1及包含卷曲螺旋结构域的Mid1突变体相互作用,不与其他TRIM家族蛋白(如TRIM19/PML)结合。核心成果提炼:Mig12是首次被鉴定的Mid1互作蛋白,与Mid1协同调控微管的成束与稳定过程,其在胚胎中线组织的高表达提示其参与胚胎中线发育的关键环节;该发现的创新性在于首次揭示了Mig12-Mid1复合物在微管稳定中的作用机制,为Opitz综合征中线发育异常的发病机制提供了新的分子解释;文献未明确提供相关统计学量化数据(如样本量、P值),但所有实验结果均经过多次重复验证。
