1. 领域背景与文献引入
文献英文标题:Role of the HIV-1 envelope transmembrane domain in intracellular sorting;发表期刊:BMC Cell Biology;影响因子:未公开;研究领域:HIV病毒学、细胞内蛋白分选、膜蛋白运输。
真核细胞表面的跨膜蛋白需经内质网(ER)插入膜结构,再通过分泌通路运输至高尔基体,最终抵达细胞表面,这一过程伴随严格的蛋白分选机制,确保蛋白定位于发挥功能的正确亚细胞结构。领域共识:蛋白的分选基序可存在于胞外域、胞质域或跨膜域(TMD),其中TMD中的潜在带电残基是已明确的内质网滞留信号,通常会导致蛋白被滞留于内质网中,这一机制是细胞蛋白质量控制的重要组成部分。当前研究热点聚焦于不同膜蛋白TMD的结构特征如何调控其细胞内定位,以及病毒蛋白如何利用或逃避细胞分选机制以完成生命周期。然而,HIV-1包膜蛋白(Env)的TMD中存在保守的精氨酸残基,按现有理论应被滞留于内质网,但实际却能高效运输至细胞表面,这一矛盾机制尚未明确,是领域内未解决的核心问题。
针对这一研究空白,本研究旨在解析HIV-1 Env蛋白为何能在TMD含带电残基的情况下仍被运输至细胞表面,明确TMD对其细胞内运输的调控机制,这一研究将为理解HIV-1的病毒组装与传播提供关键分子基础,同时拓展膜蛋白分选机制的认知边界。
2. 文献综述解析
作者以膜蛋白分泌通路的分选机制为基础,先系统梳理TMD带电残基引发内质网滞留的现有研究,再聚焦HIV-1 Env TMD的特殊矛盾,通过对比常规机制与病毒蛋白的异常行为,明确研究切入点。
现有研究已证实,TMD中的单个带电残基即可引发内质网滞留,除非该残基被蛋白复合物的组装所掩盖,这一机制由细胞内的分选机器(如Rer1受体)识别并执行。技术方法上,常用嵌合蛋白构建、免疫荧光定位等手段研究TMD的分选功能,这类方法能精准定位蛋白的亚细胞位置,但部分研究存在样本量有限、缺乏对蛋白相互作用的直接验证等局限性。针对HIV-1 Env的研究显示,其TMD的精氨酸残基可能参与与T细胞受体(TCR)、TLR2等细胞蛋白的相互作用,突变TMD会影响Env的细胞内运输或膜融合能力,但尚未明确其逃避内质网滞留的核心机制。
与现有研究相比,本研究的创新点在于首次明确了HIV-1 Env TMD的长度是其逃避内质网滞留的关键因素,而非精氨酸残基的位置或保守甘氨酸残基的作用,同时证实该TMD在逃避内质网滞留的同时,仍保留与带负电膜蛋白相互作用的能力,解决了长期以来Env TMD带电残基与细胞表面定位的矛盾,为病毒蛋白利用细胞分选机制提供了新的认知。
3. 研究思路总结与详细解析
本研究的核心目标是明确HIV-1 Env TMD逃避内质网滞留的机制,核心科学问题是TMD的哪些结构特征使其能在含带电残基的情况下仍被运输至细胞表面,技术路线遵循“序列分析→嵌合蛋白构建→细胞定位检测→机制验证→功能关联”的闭环逻辑,通过系列实验逐步解析关键调控因素。
3.1 慢病毒包膜蛋白TMD序列保守性分析
实验目的:分析不同慢病毒Env蛋白TMD的序列特征,明确保守的结构元件。
方法细节:比对多种慢病毒(包括HIV-1、HIV-2、SIV等)Env蛋白的TMD及周边区域序列,分析潜在带电残基与甘氨酸残基的分布规律。
结果解读:如图1所示,几乎所有HIV-1分离株的Env TMD中均存在精氨酸残基,少数分离株为赖氨酸,其他慢病毒的Env TMD也普遍存在带电残基,同时多个慢病毒的TMD含保守甘氨酸残基,提示这些残基可能具有重要功能。

产品关联:文献未提及具体实验产品,领域常规使用序列比对软件(如ClustalW)及Uniprot数据库进行序列分析。
3.2 HIV-1 Env TMD的内质网滞留特性验证
实验目的:验证HIV-1 Env TMD是否会引发内质网滞留。
方法细节:构建Tac抗原与不同Env TMD片段的嵌合蛋白(包括含胞质域、仅TMD等不同形式),转染HeLa细胞后,通过免疫荧光染色分别标记细胞表面与总蛋白,共聚焦显微镜观察定位并定量分析表面蛋白比例。
结果解读:如图2所示,含Env TMD的嵌合蛋白(T-E14、T-E15、T-E26)均能高效定位于细胞表面,其中T-E14因胞质域的内吞基序导致部分蛋白位于细胞内,但T-E15(缺失胞质域)几乎完全定位于细胞表面,定量结果显示T-E14的表面定位比例显著低于T-H0(n=4,P<0.01),但仍维持较高水平,证实Env TMD不会引发内质网滞留,且这一特性与胞质域或胞外近膜域无关。
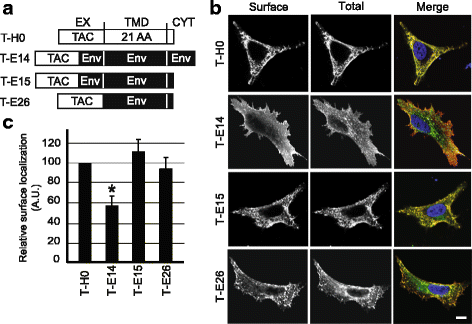
产品关联:实验所用关键产品:抗Tac抗体(7G7)、Alexa-Fluor-647/488偶联二抗(Life Technologies,货号A21235、A11029)、共聚焦显微镜(Zeiss LSM700)。
3.3 Env TMD逃避内质网滞留的关键因素探究
实验目的:明确Env TMD中逃避内质网滞留的关键结构特征,包括甘氨酸残基、精氨酸位置及TMD长度。
方法细节:构建不同突变的嵌合蛋白:将Env TMD的甘氨酸突变为亮氨酸(T-E59)、精氨酸突变为亮氨酸(T-E39)、同时突变两者(T-E60);将精氨酸移至TMD的不同位置(T-E41至T-E46);缩短TMD长度(T-E28缩短2个残基,T-E30缩短4个残基),转染细胞后检测蛋白的细胞定位。
结果解读:如图3所示,甘氨酸或精氨酸突变的嵌合蛋白均能高效定位于细胞表面,各组与T-H0无显著差异(n=3,P=0.246),说明甘氨酸残基不影响其细胞内定位;如图4所示,精氨酸位于TMD不同位置时,蛋白仍定位于细胞表面(n=3,P=0.77),提示精氨酸位置不是关键因素;如图5、6所示,T-E28的定位与T-E26类似,而T-E30几乎完全滞留于内质网,将T-E30的精氨酸突变为亮氨酸后(T-E34),蛋白恢复细胞表面定位,Pearson相关系数显示T-E30与内质网标记物显著共定位(n=4,P<0.01),证实TMD长度是逃避内质网滞留的关键,足够长度的TMD可容忍带电残基的存在而不被滞留。
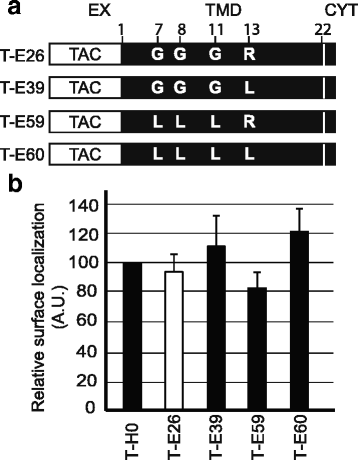
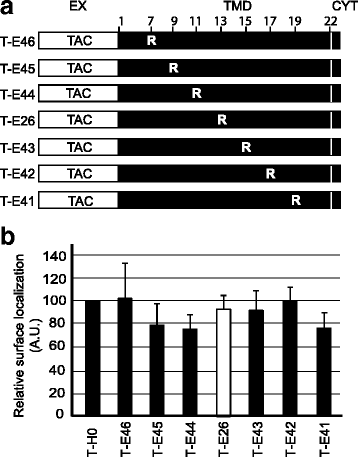
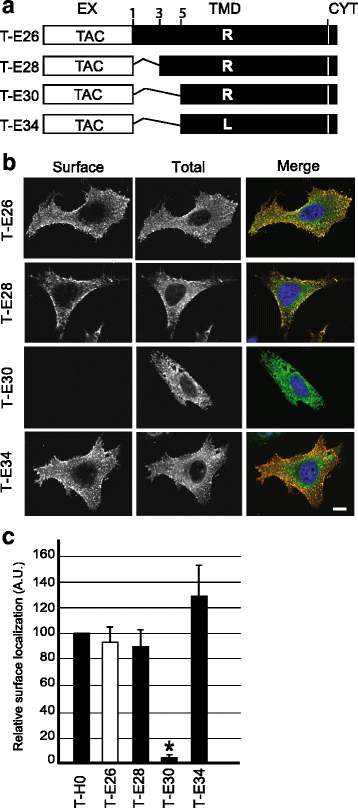
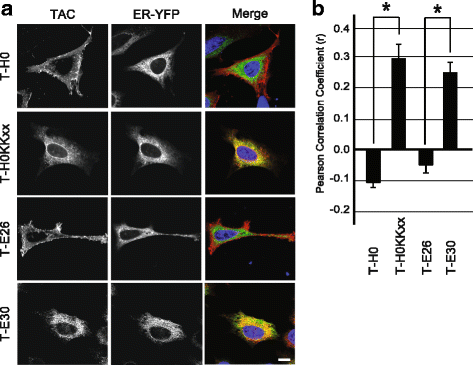
产品关联:实验所用关键产品:抗Tac抗体(7G7)、内质网-YFP标记物、共聚焦显微镜(Zeiss LSM700)、ImageJ分析软件。
3.4 Env TMD与带负电膜蛋白的相互作用验证
实验目的:验证Env TMD的精氨酸残基是否仍能与其他带负电的TMD相互作用,排除长度掩盖带电残基的可能。
方法细节:共表达Tac嵌合蛋白与含天冬氨酸残基的TCR δ亚基-β半乳糖苷酶融合蛋白,免疫沉淀Tac蛋白后检测共沉淀的β半乳糖苷酶活性,评估相互作用强度。
结果解读:如图7所示,含Env TMD的T-E26能与TCR δ亚基高效结合,而精氨酸突变的T-E39、T-E60的结合能力显著降低,甘氨酸突变的T-E59结合能力无显著变化(n≥5,P<0.01),证实Env TMD的精氨酸残基未被长度掩盖,仍能与带负电的TMD发生相互作用。
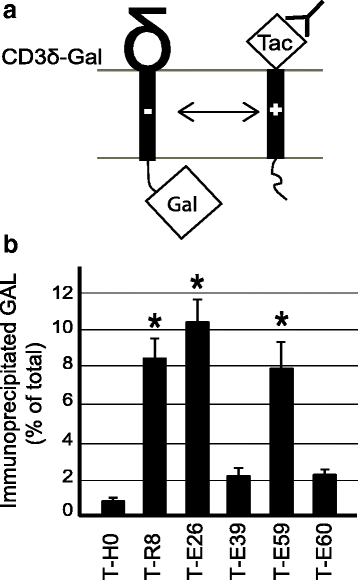
产品关联:实验所用关键产品:抗Tac抗体(7G7)、蛋白A-琼脂糖珠、β半乳糖苷酶检测底物(Chlorophenol Red-β-D-galactopyranoside)。
4. Biomarker研究及发现成果
本研究中,HIV-1 Env TMD的长度与带电残基组合可视为病毒蛋白功能的关键“功能Biomarker”,其结构特征决定了Env的细胞内定位与蛋白相互作用能力,为HIV-1的生命周期调控提供了核心分子标记。
该功能Biomarker为HIV-1 Env的跨膜域,筛选逻辑基于序列保守性分析与功能验证,通过对比不同突变体的功能差异,明确长度与带电残基的协同作用是其核心特征,验证路径为“序列比对→嵌合蛋白构建→细胞定位验证→相互作用验证”的完整链条。
该Biomarker来源于HIV-1 Env蛋白的TMD区域,通过构建不同长度、不同残基突变的嵌合蛋白,采用免疫荧光定位检测其亚细胞分布,免疫共沉淀检测与带负电膜蛋白的相互作用。特异性与敏感性数据显示,当TMD长度足够时,精氨酸残基不会引发内质网滞留,而缩短TMD长度至一定程度后,精氨酸依赖的内质网滞留效应显现,这一特征具有高度特异性;与带负电TMD的相互作用仅依赖于精氨酸残基,与甘氨酸残基无关,敏感性表现为精氨酸突变后相互作用完全丧失。
该功能Biomarker的核心功能是使Env蛋白逃避内质网滞留并运输至细胞表面,同时保留与细胞蛋白(如TCR δ亚基)相互作用的能力,创新性在于首次明确了TMD长度是调控带电残基分选功能的关键因素,打破了“带电残基必然引发内质网滞留”的常规认知。统计学结果显示,T-E30与内质网标记物的共定位显著(n=4,P<0.01),T-E26与TCR δ亚基的结合能力显著高于T-E39(n≥5,P<0.01)。这一发现提示,HIV-1可能通过进化出足够长度的TMD,既逃避内质网滞留以完成病毒组装,又能通过TMD的精氨酸残基与细胞蛋白相互作用,调控细胞生理以促进病毒传播。
