1. 领域背景与文献引入
文献英文标题:Monoclonal antibody 4C5 prevents activation of MMP2 and MMP9 by disrupting their interaction with extracellular HSP90 and inhibits formation of metastatic breast cancer cell deposits;发表期刊:BMC Cell Biology;影响因子:未公开;研究领域:肿瘤学(乳腺癌转移机制与靶向治疗)
肿瘤转移是导致全球癌症患者死亡的首要原因,其中乳腺癌的远处转移(如肺转移)是晚期患者预后不良的核心因素。领域共识:肿瘤转移是多步骤级联过程,包括肿瘤细胞脱离原发灶、侵袭周围组织、进入循环系统、在远处器官定植等,其中细胞外基质的降解是肿瘤侵袭和转移的关键限速步骤。基质金属蛋白酶(基质金属蛋白酶,MMP)家族尤其是MMP2和MMP9,通过降解基底膜的主要成分IV型胶原,为肿瘤细胞侵袭和进入循环系统提供通路,它们通常以无活性的前酶形式分泌,需在胞外通过蛋白水解作用激活。热休克蛋白90(热休克蛋白90,HSP90)作为一种保守的分子伴侣,传统研究聚焦于其胞内功能,即通过维持癌蛋白的稳定性参与肿瘤发生发展,是重要的抗癌药物靶点。近年研究发现HSP90存在胞外分泌形式,具有胞外伴侣活性,参与肿瘤细胞的侵袭过程,但现有研究多集中于HSP90α亚型,关于乳腺癌细胞是否分泌HSP90β亚型、其是否与MMP2和MMP9相互作用,以及针对胞外HSP90的单克隆抗体在乳腺癌转移中的治疗潜力,尚未得到充分验证。基于上述研究空白,本研究旨在明确MDAMB453人乳腺癌细胞分泌的HSP90α和HSP90β与MMP2、MMP9的相互作用机制,同时探究抗HSP90单克隆抗体4C5对该相互作用的调控效应及体内抗乳腺癌转移的功能。
2. 文献综述解析
作者围绕“肿瘤转移的分子机制-胞外HSP90的新功能-靶向胞外HSP90的治疗潜力”的逻辑框架,系统梳理了肿瘤转移领域的核心研究进展,重点聚焦MMP家族的功能及胞外HSP90的调控作用。
现有研究已明确肿瘤转移依赖于细胞外基质的降解,MMP2和MMP9是介导该过程的关键蛋白酶,其激活状态直接影响肿瘤侵袭能力;同时,胞内HSP90作为分子伴侣参与多种癌蛋白的稳定,已成为抗癌药物研发的热门靶点,而近年的研究逐步揭示了胞外HSP90α的分泌特性及其与MMP2的相互作用,证实其可促进MMP2的激活进而增强肿瘤细胞侵袭性。此外,前期研究发现抗HSP90单克隆抗体4C5可通过阻断胞膜表面HSP90与HER-2的相互作用抑制乳腺癌细胞侵袭,还能抑制黑色素瘤的体内转移,但这些研究未涉及HSP90β的胞外功能,也未明确单抗4C5是否通过调控HSP90与MMP的相互作用发挥抗转移效应。现有研究的优势在于初步建立了胞外HSP90与肿瘤侵袭的关联,局限性则在于对HSP90β的胞外功能研究缺失,且针对胞外HSP90的单抗在乳腺癌转移中的具体作用机制尚不清晰。本研究的创新价值在于首次证实乳腺癌细胞可分泌HSP90β亚型,且HSP90α和β均能与MMP2、MMP9相互作用并调控其激活,同时明确了单抗4C5通过阻断该相互作用抑制MMP激活,进而发挥体内抗乳腺癌肺转移的效应,填补了HSP90β胞外功能及单抗4C5作用机制的研究空白。
3. 研究思路总结与详细解析
本研究以“胞外HSP90调控乳腺癌转移的机制及靶向干预”为核心科学问题,整体研究框架为:细胞实验验证HSP90的分泌及与MMP的相互作用→细胞实验明确单抗4C5对MMP激活的调控机制→动物实验验证单抗4C5的体内抗转移效应,形成了从分子机制到体内功能的完整研究闭环,最终证实胞外HSP90是乳腺癌转移的关键调控因子,单抗4C5是潜在的抗转移治疗试剂。
3.1 乳腺癌细胞HSP90分泌及与MMP相互作用验证
实验目的:明确MDAMB453人乳腺癌细胞是否主动分泌HSP90α和HSP90β亚型,以及分泌的HSP90是否与MMP2、MMP9存在相互作用。
方法细节:培养MDAMB453细胞至汇合后,更换无血清培养基继续培养24小时,收集细胞裂解液和培养上清液,将上清液通过超滤离心浓缩100倍;采用免疫印迹(免疫印迹,Western blot)技术,分别用抗HSP90α、抗HSP90β及抗β-肌动蛋白抗体检测细胞裂解液和浓缩上清中的蛋白,以β-肌动蛋白排除胞内蛋白污染;通过免疫共沉淀实验,先用抗MMP2或抗MMP9抗体沉淀上清中的蛋白复合物,再用抗HSP90α、抗HSP90β抗体进行免疫印迹检测;同时进行反向免疫共沉淀实验,用抗HSP90α或抗HSP90β抗体沉淀上清蛋白,再检测MMP2、MMP9的存在。
结果解读:免疫印迹结果显示,MDAMB453细胞的浓缩上清中可检测到HSP90α和HSP90β的蛋白条带,且上清中无β-肌动蛋白信号,证明两种HSP90亚型均为细胞主动分泌,而非胞内蛋白污染;免疫共沉淀结果显示,抗MMP2或抗MMP9抗体沉淀的复合物中存在HSP90α和HSP90β,反向免疫共沉淀进一步证实HSP90α和HSP90β主要与无活性的pro-MMP2、pro-MMP9结合,同时也能与少量激活形式的MMP结合。
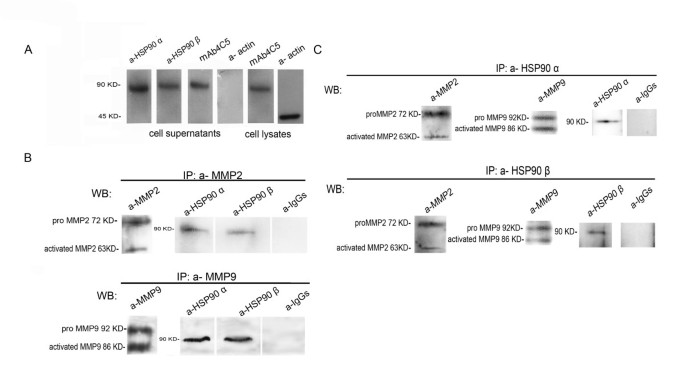
产品关联:实验所用关键产品:Chemicon的HSP90α多克隆抗体、HSP90β多克隆抗体、MMP2多克隆抗体,Santa Cruz Biotechnology的MMP9多克隆抗体、β-肌动蛋白单克隆抗体,Sigma的明胶-琼脂糖珠、Protein G-琼脂糖珠、Protein A-琼脂糖珠,Gibco的RPMI培养基、胎牛血清,Millipore的超滤离心浓缩装置。
3.2 单抗4C5对MMP激活及HSP90-MMP相互作用的影响
实验目的:探究抗HSP90单克隆抗体4C5对MMP2、MMP9分泌及激活的影响,以及是否通过阻断胞外HSP90与MMP的相互作用发挥效应。
方法细节:在MDAMB453细胞的无血清培养基中加入200μg/ml的单抗4C5,同时设置无关抗体处理组作为对照,培养24小时后收集上清液并浓缩;采用酶谱法(酶谱法,Zymography)检测上清中MMP2、MMP9的活性,通过明胶降解的透明条带判断激活形式的存在;同时采用免疫印迹技术检测上清中pro-MMP2、pro-MMP9及激活形式MMP的蛋白水平;通过免疫共沉淀实验,用抗MMP2或抗MMP9抗体沉淀对照组和单抗4C5处理组的上清蛋白复合物,再用抗HSP90α、抗HSP90β抗体检测复合物中的HSP90。
结果解读:酶谱法和免疫印迹结果均显示,单抗4C5处理组的上清中仍存在pro-MMP2和pro-MMP9,但未检测到激活形式的MMP条带,证明单抗4C5不影响MMP的分泌,但完全抑制其激活;免疫共沉淀结果显示,对照组中抗MMP2/9抗体沉淀的复合物中存在HSP90α和HSP90β,而单抗4C5处理组中无相应条带,证明单抗4C5可有效阻断胞外HSP90与MMP2、MMP9的相互作用。
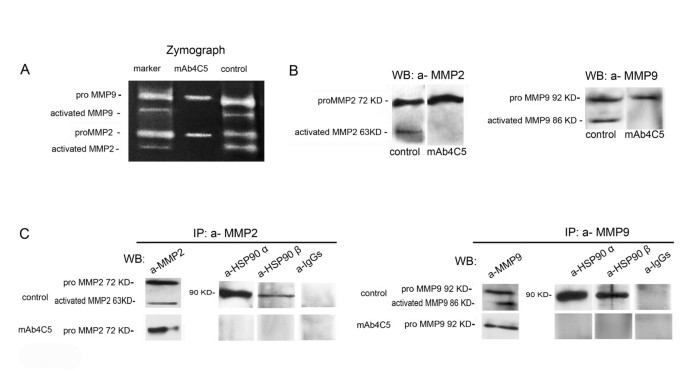
产品关联:实验所用关键产品:自制的抗HSP90单克隆抗体4C5,其他产品同3.1。
3.3 单抗4C5抑制乳腺癌细胞肺转移的体内实验
实验目的:验证单抗4C5在体内对MDAMB453乳腺癌细胞肺转移的抑制作用,并明确其作用机制。
方法细节:将MDAMB453细胞用DiI荧光染料标记,调整细胞密度至1×10^6个/300μl,分别与100μg/ml的单抗4C5或无关抗体混合;将20只8-10周龄的雌性SCID小鼠随机分为两组,每组10只,通过尾静脉注射上述细胞悬液;24小时后处死小鼠,灌注肺组织以清除未结合的肿瘤细胞,制作肺组织冰冻切片,用共聚焦显微镜观察肺内转移灶及血管内肿瘤细胞的滞留情况;定量分析两组小鼠肺内转移灶的数量,以及肿瘤细胞滞留于肺血管内的比例。
结果解读:宏观观察显示,对照组小鼠肺组织可见大量荧光标记的肿瘤转移灶,而单抗4C5处理组的转移灶数量显著减少;显微镜观察显示,处理组肺组织内的肿瘤细胞沉积明显少于对照组,定量分析显示单抗4C5对肺转移灶的抑制率达86.67%(n=10,P<0.001);进一步观察发现,处理组中58.76%的肺血管内可见肿瘤细胞滞留,而对照组仅为15.4%(n=10,P<0.01),证明单抗4C5通过抑制肿瘤细胞的外渗过程,阻断其向肺组织的浸润,进而抑制转移灶形成。
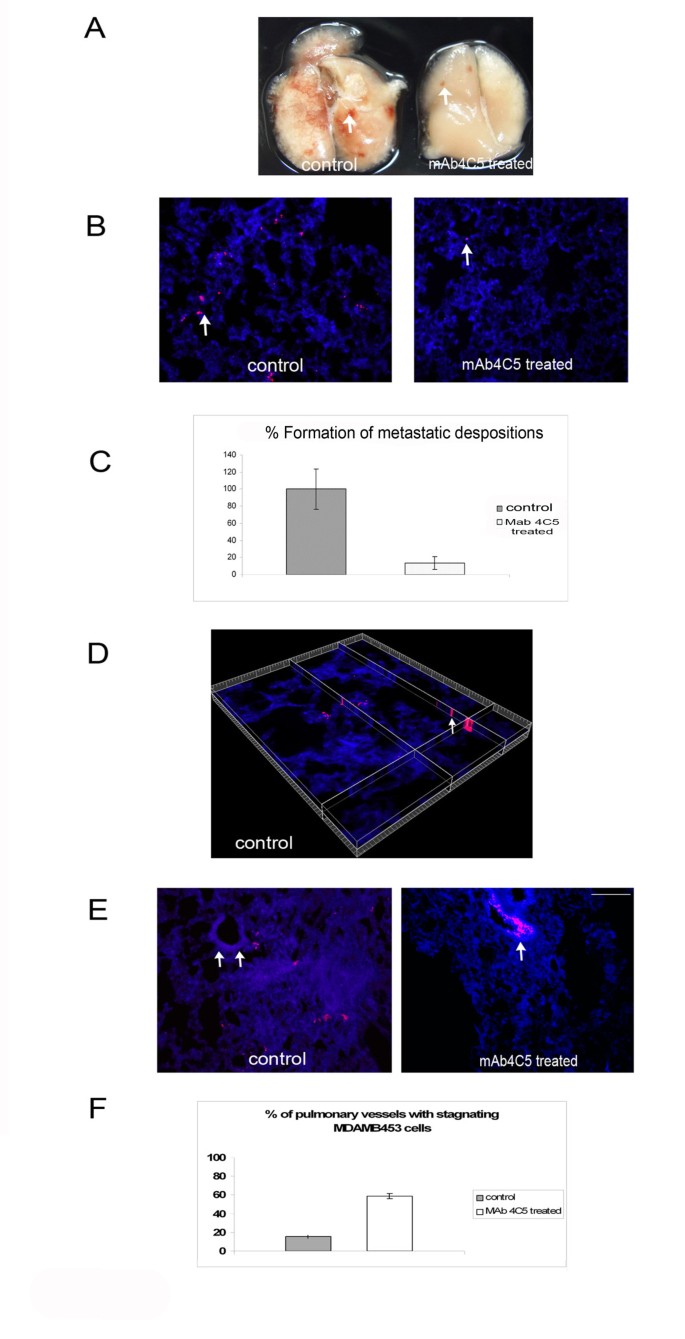
产品关联:实验所用关键产品:DiI荧光染料,Jackson Laboratory的SCID小鼠,其他产品同前。
4. Biomarker研究及发现成果解析
本研究聚焦的Biomarker为胞外热休克蛋白90(包括α和β亚型),该Biomarker属于功能性Biomarker,通过与MMP2、MMP9相互作用调控其激活,进而参与乳腺癌细胞的侵袭与转移过程。
Biomarker定位:胞外HSP90α和β是乳腺癌转移的功能性调控Biomarker,筛选与验证逻辑为:基于前期胞外HSP90α与MMP2相互作用的研究基础,进一步验证乳腺癌细胞是否分泌HSP90β并参与MMP调控,通过细胞实验(免疫印迹、免疫共沉淀)明确其分泌特性与相互作用,通过酶谱法验证其对MMP激活的调控功能,最终通过动物实验证实其在乳腺癌转移中的作用,形成了从分子互作到体内功能的完整验证链条。
研究过程详述:该Biomarker的来源为MDAMB453人乳腺癌细胞的无血清培养上清,属于肿瘤细胞主动分泌的胞外蛋白;验证方法包括:免疫印迹技术检测其分泌情况,免疫共沉淀实验验证与MMP2、MMP9的相互作用,酶谱法检测其对MMP激活的调控效应,动物实验验证其在体内转移中的功能;特异性方面,胞外HSP90α和β均能特异性结合pro-MMP2和pro-MMP9,且单抗4C5可特异性阻断该相互作用;敏感性方面,动物实验中单抗4C5对肺转移灶的抑制率达86.67%(n=10,P<0.001),血管内肿瘤细胞滞留比例的差异具有统计学意义(P<0.01),证明该Biomarker的功能调控效应显著。
核心成果提炼:胞外HSP90α和β作为乳腺癌转移的功能性Biomarker,其核心功能是通过与MMP2、MMP9的相互作用促进MMP的激活,进而增强乳腺癌细胞的外渗能力,最终促进肺转移灶的形成;本研究的创新性在于首次发现乳腺癌细胞可分泌HSP90β亚型,且该亚型与HSP90α共同参与MMP的激活调控,同时证实抗HSP90单克隆抗体4C5可通过阻断胞外HSP90与MMP的相互作用,有效抑制乳腺癌的体内转移,为乳腺癌转移的靶向治疗提供了新的靶点与潜在试剂;统计学结果显示,动物实验中转移灶抑制率为86.67%(n=10,P<0.001),血管内滞留比例的组间差异具有统计学意义(P<0.01),充分证实了该Biomarker的功能效应及单抗的治疗潜力。
