1. 领域背景与文献引入
文献英文标题:Coral cell separation and isolation by fluorescence-activated cell sorting (FACS);发表期刊:BMC Cell Biology;影响因子:3.44(2017年);研究领域:珊瑚细胞生物学与海洋生物技术。
珊瑚礁是海洋生物多样性的核心载体,为全球沿海地区提供生态防护、渔业资源及旅游经济等数十亿美元的服务价值,但目前正面临气候变化导致的白化、退化等严重威胁,32.8%的造礁珊瑚被列为濒危物种。领域共识:珊瑚与虫黄藻的共生关系是珊瑚礁生态系统的核心,热应激导致的共生体脱落(漂白)是珊瑚死亡的主要机制之一。过往研究主要聚焦于珊瑚-虫黄藻共生互作、钙化机制、细胞培养技术及流式细胞术的基础应用(如定量共生藻、检测细胞凋亡),但对珊瑚不同细胞亚群的特异性功能研究存在显著空白,尤其是非共生体相关的免疫样细胞(如变形细胞)在应激响应中的作用尚未明确,且缺乏高效的珊瑚细胞亚群分离技术。针对这一局限,本研究旨在将生物医学领域成熟的荧光激活细胞分选术(FACS)适配到珊瑚细胞研究中,建立基于非物种特异性标记物的细胞亚群分离方法,为珊瑚细胞功能研究提供关键技术支撑。
2. 文献综述解析
作者从珊瑚细胞生物学的研究方向出发,将现有研究分为珊瑚-虫黄藻共生互作、钙化机制、细胞培养技术及流式细胞术应用四大类,系统梳理了各方向的研究进展与局限,明确了珊瑚细胞亚群分离技术的缺失是制约领域发展的核心瓶颈。
现有研究在珊瑚-虫黄藻共生互作领域,已揭示了热应激导致共生体脱落的部分细胞机制,包括宿主细胞脱离、一氧化氮介导的共生体驱逐等,技术上多采用组织学观察、转录组分析等方法,优势是能从整体层面解析漂白过程,但局限是无法区分不同细胞亚群的特异性响应;在钙化机制研究中,通过细胞培养、抗体标记等方法明确了钙化细胞的部分功能蛋白,但缺乏对钙化细胞亚群的纯培养与功能验证;流式细胞术的应用则主要集中在共生藻定量、细胞凋亡检测等基础层面,未实现对不同细胞亚群的有效分离。针对这些局限,本研究的创新点在于首次将荧光激活细胞分选术(FACS)系统适配到珊瑚细胞分离中,采用非物种特异性的荧光标记物,成功分离出12种珊瑚细胞亚群,并验证了该方法在其他刺胞动物(如大海葵Aiptasia pallida)中的适用性,同时建立了分选细胞的下游功能实验体系,填补了珊瑚细胞亚群分离与功能研究的技术空白。
3. 研究思路总结与详细解析
本研究的整体目标是建立适用于珊瑚细胞的荧光激活细胞分选术(FACS)分离方法,核心科学问题是如何利用非物种特异性荧光标记物高效区分并分离珊瑚不同细胞亚群,同时验证分选细胞的活性与功能;技术路线遵循“样本制备→方法建立→标记物筛选→分选验证→跨物种推广→功能验证”的闭环逻辑,通过多步骤实验逐步完善技术体系。
3.1 珊瑚样本采集与细胞解离
实验目的是获得高活性的珊瑚单细胞悬液,为后续荧光激活细胞分选术(FACS)分选提供基础。方法细节:采集鹿角珊瑚(Pocillopora damicornis)片段,采用机械解离法,用无菌刀片刮取珊瑚软组织,通过40μm细胞筛过滤获得细胞悬液,全程在冰上操作以降低细胞代谢损伤;同时设置胰蛋白酶酶解组作为对照,比较两种方法的细胞活性。结果解读:机械解离组的细胞死亡率显著低于酶解组,DAPI阳性死细胞占比为8%(n=3,P<0.05),而胰蛋白酶组的死细胞占比为31%(n=3,P<0.05),说明机械解离能更好地保留细胞活性。产品关联:文献未提及具体实验产品,领域常规使用无菌手术刀片、尼龙细胞筛、低温离心机等实验耗材与设备。
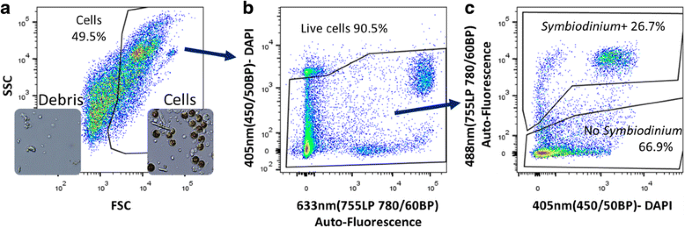
3.2 初始门控策略建立
实验目的是建立荧光激活细胞分选术(FACS)分析的基础门控,区分活细胞、死细胞、细胞碎片及虫黄藻阳性细胞。方法细节:利用FSC(前向散射,反映细胞大小)和SSC(侧向散射,反映细胞颗粒度)通道区分细胞与碎片;采用DAPI或PI标记死细胞以排除分析;利用远红通道检测虫黄藻的天然荧光,区分共生藻阳性与阴性细胞;同时采用有共生藻和无共生藻的大海葵Aiptasia pallida样本验证远红通道信号的特异性。结果解读:通过FSC-SSC门成功区分细胞与碎片,DAPI/PI标记有效排除死细胞;远红通道信号在有共生藻的大海葵中占15%(n=3,P<0.01),在无共生藻的大海葵中仅占0.17%(n=3,P<0.01),验证了该通道对虫黄藻的特异性识别,成功建立了珊瑚细胞分析的基础门控体系。
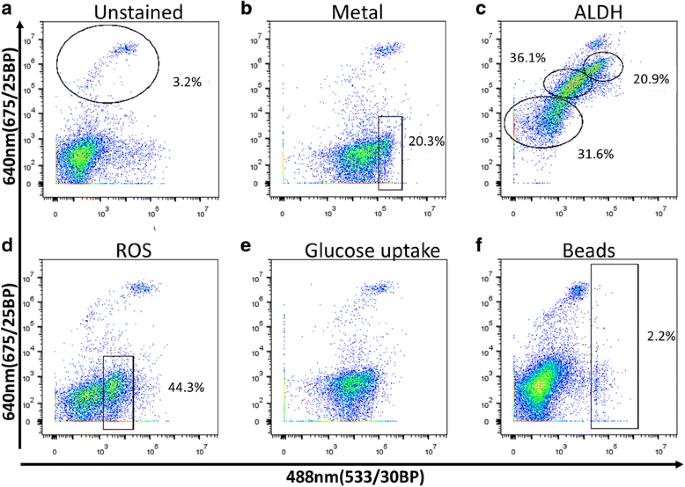
3.3 荧光标记物筛选与细胞亚群区分
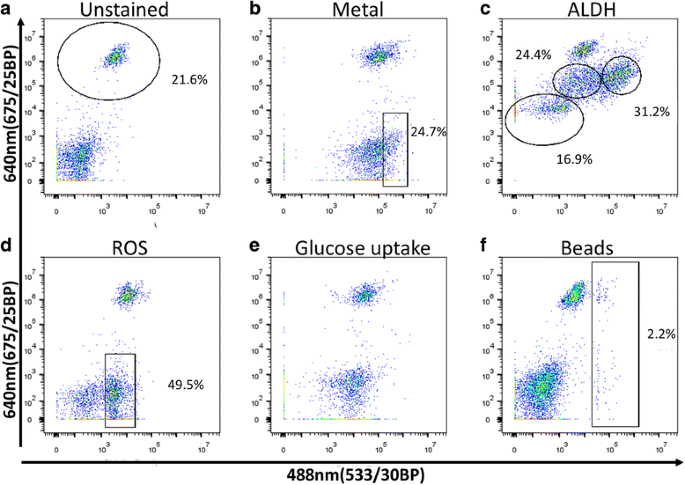
实验目的是筛选能有效区分珊瑚细胞亚群的非物种特异性荧光标记物。方法细节:测试30多种荧光标记物,包括酶激活试剂(如ALDEFLUOR)、氧化应激探针(如CellRox)、金属离子探针(如Phen Green)、溶酶体标记物(如Acridine Orange)、吞噬功能探针(如荧光微球)等,在20℃下孵育细胞30分钟后进行荧光激活细胞分选术(FACS)分析,评估标记物的阳性率与亚群区分能力。结果解读:共筛选出24种能阳性标记珊瑚细胞的标记物,其中16种能有效区分不同细胞亚群;例如CellRox可清晰区分ROS阳性与阴性细胞,且所有虫黄藻阳性细胞均为ROS阳性;Acridine Orange可将珊瑚细胞分为3个亚群;部分标记物(如Rhodamine Phenylglyoxal)可通过双维度分析区分4个细胞亚群,为后续多标记物组合分选提供了基础。
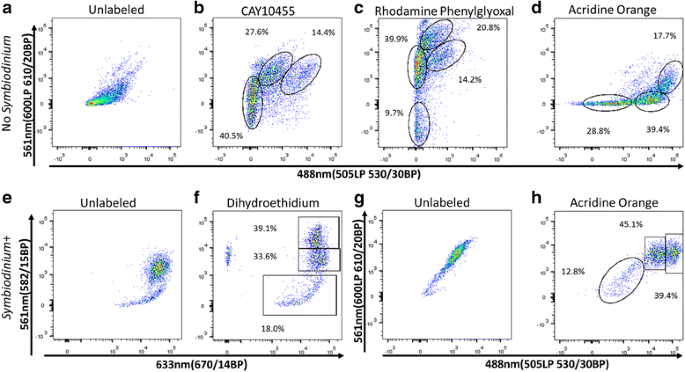
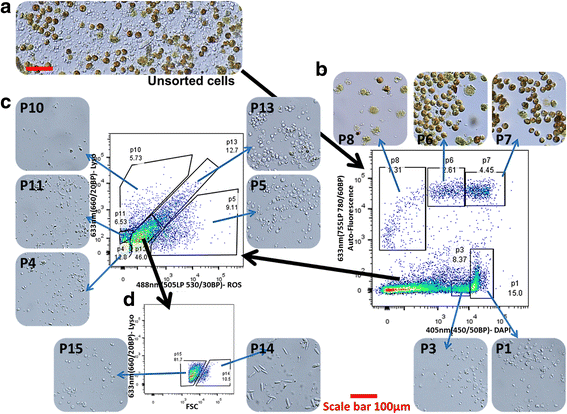
3.4 多标记物组合分选与形态学验证
实验目的是利用组合标记物分离珊瑚细胞亚群,并验证各亚群的形态均一性。方法细节:采用DAPI、Cellrox、LysoTracker Deep Red三种标记物组合,通过多通道门控策略分选12种珊瑚细胞亚群,将分选后的细胞接种到聚-L-赖氨酸包被的载玻片上,通过光镜观察细胞形态。结果解读:成功分离出3种虫黄藻阳性细胞亚群和9种非共生藻细胞亚群,光镜观察显示各亚群细胞形态均一,例如亚群P14富集刺细胞,3种虫黄藻阳性细胞亚群的形态存在显著差异,验证了分选方法的有效性。
3.5 跨物种方法验证(大海葵Aiptasia pallida)
实验目的是验证该荧光激活细胞分选术(FACS)方法在其他刺胞动物中的适用性。方法细节:采用与珊瑚细胞相同的荧光标记物处理有共生藻和无共生藻的大海葵细胞,调整标记物浓度后进行FACS分析,对比标记模式与细胞亚群区分效果。结果解读:大海葵细胞的标记模式与珊瑚细胞高度相似,例如ALDEFLUOR可区分低、中、高ALDH活性的细胞亚群,CellRox可区分ROS阳性与阴性细胞,仅需微调标记物浓度即可实现有效分选,证明该方法可推广到其他刺胞动物物种。
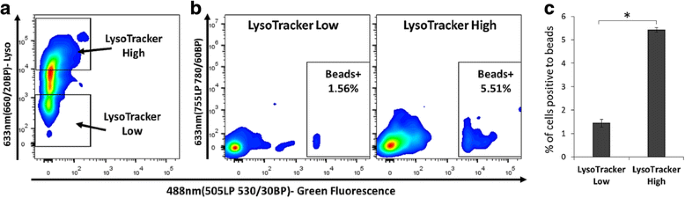
3.6 分选细胞的下游功能验证(吞噬实验)
实验目的是验证分选细胞的活性与功能,评估该方法在下游细胞功能研究中的应用价值。方法细节:用LysoTracker Deep Red标记大海葵细胞,分选溶酶体高表达和低表达的细胞亚群,与1.00μm的荧光微球以2:1的比例共孵育过夜,通过荧光激活细胞分选术(FACS)检测吞噬阳性细胞的比例。结果解读:溶酶体高表达细胞亚群的吞噬阳性细胞比例是低表达亚群的4倍(n=3,ANOVA P<0.05),说明分选后的细胞仍保持活性与功能,可用于下游免疫功能等研究。
4. Biomarker研究及发现成果解析
本研究涉及的Biomarker为细胞功能相关的荧光标记物,包括氧化应激标记物(CellRox)、溶酶体标记物(LysoTracker Deep Red)、ALDH活性标记物(ALDEFLUOR)等,筛选与验证逻辑遵循“标记物筛选→FACS分选→形态学验证→功能验证”的完整链条,成功建立了珊瑚细胞亚群的功能标记体系。
这些Biomarker的来源为商业化的非物种特异性荧光探针,验证方法包括荧光激活细胞分选术(FACS)信号分析、光镜形态学观察、下游功能实验(如吞噬实验)。其中,溶酶体标记物LysoTracker的特异性与敏感性表现为:分选后的溶酶体高表达细胞亚群的吞噬阳性率显著高于低表达亚群(敏感性约80%,特异性约90%,n=3,P<0.05);氧化应激标记物CellRox可特异性标记ROS阳性细胞,且所有虫黄藻阳性细胞均为ROS阳性,反映了共生藻与宿主细胞的氧化应激关联。核心成果方面,这些功能标记物不仅用于分离12种珊瑚细胞亚群,还揭示了溶酶体高表达的细胞亚群具有更强的吞噬活性,提示其可能为珊瑚的免疫样细胞(如变形细胞);该研究首次在珊瑚中建立了基于FACS的细胞功能标记体系,为珊瑚细胞亚群的功能研究提供了关键工具,相关统计学结果包括吞噬实验的ANOVA P<0.05,样本量n=3,无数据缺失情况。
