1. 领域背景与文献引入
文献英文标题:Immunosuppressive activity enhances central carbon metabolism and bioenergetics in myeloid-derived suppressor cells in vitro models;发表期刊:BMC Cell Biology;影响因子:未公开;研究领域:肿瘤免疫代谢(髓源性抑制细胞调控)
髓源性抑制细胞(MDSCs)是肿瘤微环境中关键的免疫抑制细胞亚群,2007年领域内统一其命名后,相关研究逐步聚焦于其免疫抑制机制与临床转化价值。现有研究已明确MDSCs通过表达诱导型一氧化氮合酶(iNOS)和精氨酸酶1(ARG1)代谢L-精氨酸,抑制CD4+和CD8+T细胞的增殖与功能,从而促进肿瘤免疫逃逸。近年来,肿瘤免疫代谢成为前沿研究方向,发现免疫细胞的功能状态与其代谢重编程密切相关,MDSCs也存在糖酵解增强等代谢特征,但MDSCs免疫抑制活性与代谢调控的具体分子机制,尤其是腺苷酸活化蛋白激酶(AMPK)在其中的作用尚未明确,这一空白限制了靶向MDSCs的肿瘤免疫治疗策略开发。
针对上述研究空白,本研究通过原代骨髓细胞诱导的MDSCs和永生化MSC-1细胞两种模型,动态监测MDSCs成熟过程中的代谢变化与生物能状态,首次证实AMPK是介导MDSCs代谢重编程与免疫抑制功能的关键调控分子,为肿瘤免疫治疗提供了新的代谢靶点。
2. 文献综述解析
作者以MDSCs的免疫抑制功能与代谢调控的关联为核心,按实验模型(原代细胞模型、永生化细胞模型)、代谢通路(糖酵解、谷氨酰胺代谢、三羧酸循环)、分子调控(AMPK信号、精氨酸代谢酶)三个维度对现有研究进行分类评述。
现有研究已证实MDSCs通过iNOS和ARG1介导的L-精氨酸代谢抑制T细胞功能,且MDSCs在肿瘤微环境中存在代谢重编程,表现为糖酵解活性增强、谷氨酰胺摄取增加,以满足其免疫抑制功能的能量需求;部分研究提示AMPK作为细胞能量传感器可能参与免疫细胞的代谢调控,但针对MDSCs的研究仅停留在代谢现象的观察,缺乏对免疫抑制活性与代谢调控动态关联的监测,也未明确AMPK在其中的具体调控机制。同时,现有研究多采用单一实验模型,缺乏原代细胞与永生化细胞模型的对比验证,结论的普适性有待提升。
本研究的创新点在于首次动态监测了MDSCs成熟过程中的代谢变化与生物能状态,同时采用原代骨髓细胞诱导模型和永生化MSC-1细胞抑制模型,双向验证了免疫抑制活性与中心碳代谢的直接关联;首次明确AMPK是连接MDSCs代谢重编程与免疫抑制功能的关键分子,通过抑制剂实验证实抑制AMPK可显著降低MDSCs的免疫抑制活性,为靶向MDSCs的肿瘤免疫治疗提供了新的作用靶点,弥补了现有研究中机制不清、模型单一的局限性。
3. 研究思路总结与详细解析
本研究的整体研究目标是明确MDSCs免疫抑制活性与中心碳代谢、生物能状态的关联,以及AMPK在其中的调控作用;核心科学问题为MDSCs的免疫抑制功能是否依赖代谢重编程,AMPK如何介导代谢重编程与免疫抑制活性的耦合;技术路线采用“模型构建→代谢监测→分子验证→功能验证”的闭环逻辑,通过两种互补实验模型系统解析免疫抑制与代谢调控的机制。
3.1 MDSCs免疫抑制活性的模型验证
实验目的:确认原代骨髓细胞诱导的MDSCs和永生化MSC-1细胞的免疫抑制功能,明确iNOS和ARG1是MDSCs免疫抑制活性的核心效应分子。
方法细节:从6-8周龄C57BL/6小鼠骨髓中提取单个核细胞,在含40ng/ml粒细胞-巨噬细胞集落刺激因子(GM-CSF)和白细胞介素-6(IL-6)的培养基中培养4天,诱导生成MDSCs;同时将永生化MSC-1细胞用100μM的iNOS抑制剂1400W和5μM的ARG1抑制剂BEC处理48h,抑制其精氨酸代谢酶活性。采用Griess反应检测细胞培养上清中的硝酸盐/亚硝酸盐浓度(反映iNOS活性),酶活实验检测ARG1活性;通过Transwell共培养体系将MDSCs与Jurkat T细胞共培养,24-32h后检测Jurkat细胞的密度与活力。
结果解读:
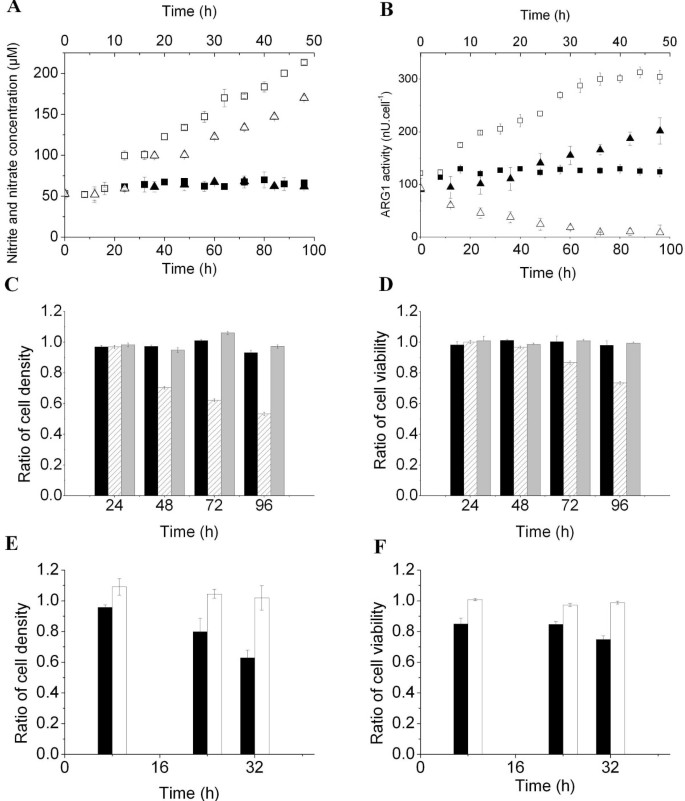
图1结果显示,未诱导的骨髓细胞中iNOS和ARG1活性极低,上清中硝酸盐/亚硝酸盐浓度稳定在62.86±4.25μM,ARG1活性为124.93±3.48nU/cell(n=3),对Jurkat细胞无明显抑制作用;经GM-CSF和IL-6诱导24h后,iNOS和ARG1活性显著升高,96h时ARG1活性升至304.30±4.11nU/cell(n=3,P<0.05),共培养的Jurkat细胞密度和活力分别降低46.6±1.07%和26.47±0.89%(n=3,P<0.05)。MSC-1细胞经抑制剂处理后,iNOS和ARG1活性被显著抑制,共培养的Jurkat细胞密度和活力与对照组无显著差异,证明MDSCs的免疫抑制功能依赖iNOS和ARG1的活性。
产品关联:文献未提及具体实验产品,领域常规使用重组细胞因子、酶活检测试剂盒、血细胞计数板等试剂与仪器。
3.2 MDSCs免疫抑制相关的中心碳代谢谱分析
实验目的:解析MDSCs免疫抑制活性与中心碳代谢(糖酵解、谷氨酰胺代谢、三羧酸循环)的动态关联。
方法细节:采用生物化学分析仪检测细胞培养上清中葡萄糖、L-谷氨酰胺(L-Gln)的浓度变化,计算细胞的营养摄取率;通过超高效液相色谱-串联质谱(UPLC-MS/MS)检测细胞内糖酵解中间产物(葡萄糖-6-磷酸G-6-P、果糖-6-磷酸F-6-P)、三羧酸循环(TCA)中间产物(α-酮戊二酸α-KG、延胡索酸、苹果酸)的浓度。
结果解读:
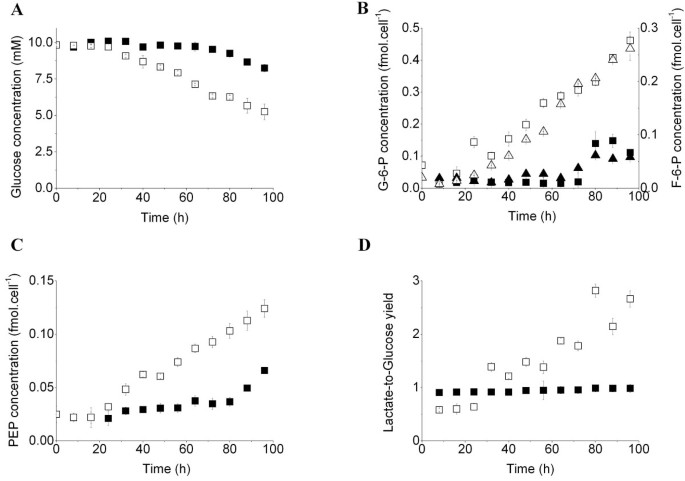
图2结果显示,骨髓细胞诱导为MDSCs后,葡萄糖摄取率从几乎为0升至0.243±0.008pmol/cell/h(n=3,P<0.05),糖酵解中间产物G-6-P和F-6-P的细胞内浓度分别以5.173±0.084×10^-3和3.573±0.005×10^-3fmol/cell/h的速率积累,乳酸/葡萄糖产率从0.61±0.02升至2.0以上,提示糖酵解活性显著增强。
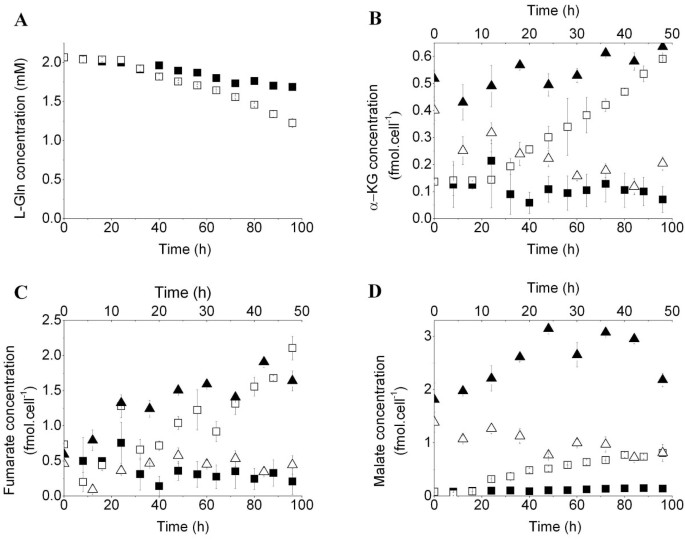
图3结果显示,MDSCs的L-Gln摄取率从0.021±0.005pmol/cell/h升至0.040±0.002pmol/cell/h(n=3,P<0.05),TCA循环中间产物α-KG、延胡索酸、苹果酸的细胞内浓度显著升高,其中延胡索酸的积累速率为20.378±0.005×10^-3fmol/cell/h(n=3,P<0.05),提示谷氨酰胺代谢和TCA循环活性增强。MSC-1细胞抑制iNOS/ARG1后,葡萄糖和L-Gln摄取率分别降至0.153±0.008pmol/cell/h和0.052±0.001pmol/cell/h(n=3,P<0.05),TCA中间产物浓度显著下降,证明MDSCs的免疫抑制活性伴随中心碳代谢的全面增强。
产品关联:文献未提及具体实验产品,领域常规使用生物化学分析仪、UPLC-MS/MS系统等仪器。
3.3 MDSCs免疫抑制过程中的生物能状态分析
实验目的:分析MDSCs免疫抑制过程中的生物能状态变化,寻找关联的核苷酸标志物。
方法细节:通过UPLC-MS/MS检测细胞内嘌呤(GTP+ATP+ADP+AMP)、嘧啶(CTP+UTP+UDPGNAc)的浓度,计算NTP比值([ATP+GTP]/[UTP+CTP])、ATP/ADP比值、AMP/ATP比值等核苷酸标志物,反映细胞的代谢活性与能量状态。
结果解读:
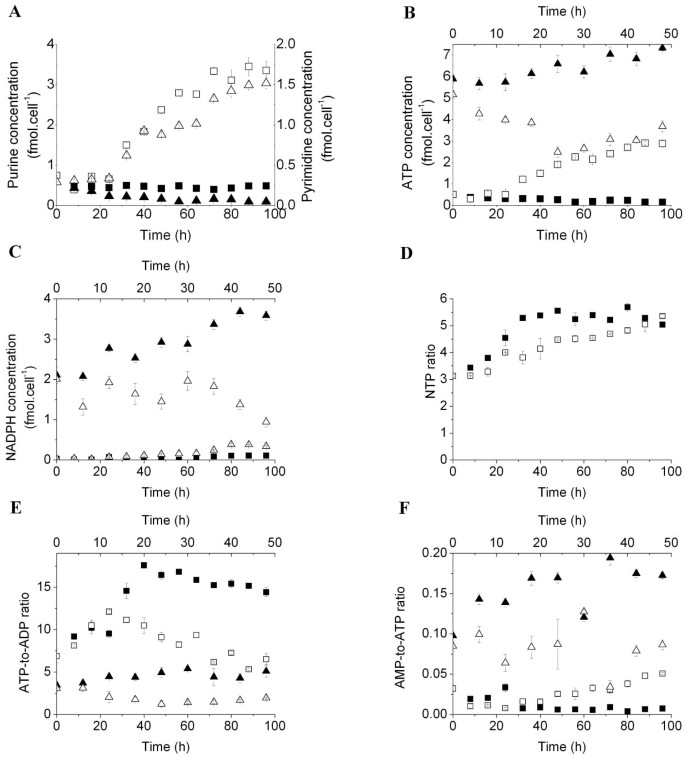
图4结果显示,骨髓细胞诱导为MDSCs后,嘌呤浓度以0.030±0.007fmol/cell/h的速率积累(n=3,P<0.05),ATP浓度从初始值升至7.33±0.12fmol/cell(n=3,P<0.05),NTP比值从3.14±0.07升至5.36±0.06(n=3,P<0.05),提示细胞代谢活性增强;同时AMP/ATP比值显著升高(是对照组的5倍,n=3,P<0.05),ATP/ADP比值降低,提示AMPK可能被激活。MSC-1细胞抑制iNOS/ARG1后,ATP浓度从5.16±0.20fmol/cell降至2.49±0.25fmol/cell(n=3,P<0.05),AMP/ATP比值显著降低,证明免疫抑制活性与细胞生物能状态正相关。
产品关联:文献未提及具体实验产品,领域常规使用UPLC-MS/MS系统、核苷酸定量试剂盒等。
3.4 AMPK在MDSCs免疫抑制中的调控作用验证
实验目的:验证AMPK是否介导MDSCs的代谢重编程与免疫抑制活性。
方法细节:采用蛋白质免疫印迹(Western blot)检测MDSCs中磷酸化AMPK(p-AMPK)的表达水平;用5μM的AMPK特异性抑制剂Compound C(Comp-C)预处理骨髓细胞15min,然后用GM-CSF和IL-6诱导MDSCs,检测细胞的葡萄糖摄取率、iNOS/ARG1活性,以及共培养后Jurkat细胞的密度与活力。
结果解读:
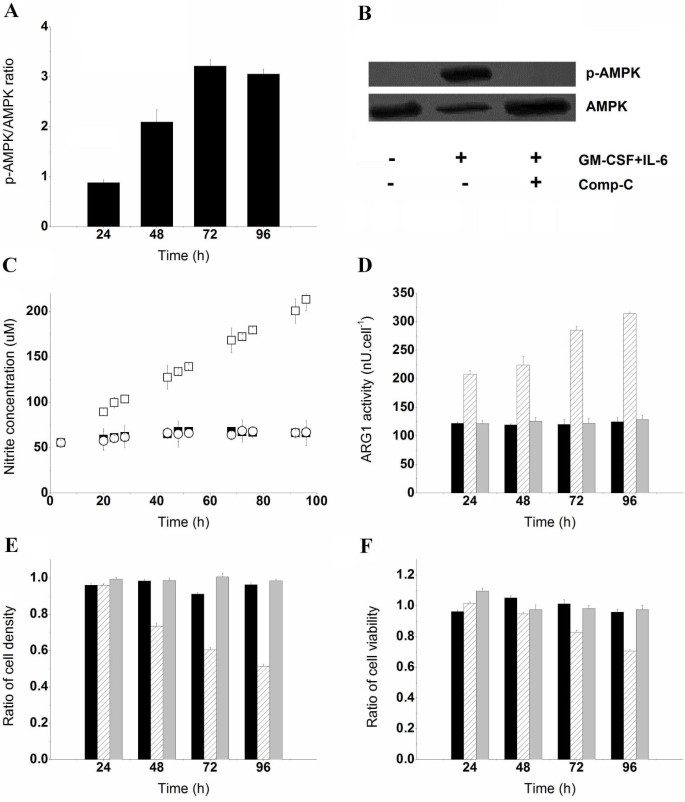
图5结果显示,骨髓细胞诱导为MDSCs后,p-AMPK的表达水平显著升高,而未诱导的骨髓细胞中几乎检测不到p-AMPK;Comp-C预处理后,p-AMPK的表达被完全抑制,葡萄糖摄取率降至0.157±0.011pmol/cell/h(n=3,P<0.05),iNOS和ARG1活性未被诱导升高,共培养的Jurkat细胞密度和活力与对照组无显著差异,证明AMPK是介导MDSCs代谢重编程与免疫抑制活性的关键分子。
产品关联:实验所用关键产品:Santa Cruz Biotechnology的AMPK α1/2抗体、p-AMPK α1/2(Thr172)抗体;Sigma的Compound C。
4. Biomarker研究及发现成果解析
本研究涉及的Biomarker包括功能调控Biomarker(磷酸化AMPK,p-AMPK)和伴随代谢Biomarker(葡萄糖摄取率、L-谷氨酰胺摄取率、TCA循环中间产物浓度),其中p-AMPK是核心调控Biomarker,筛选与验证逻辑为“代谢标志物提示→分子表达验证→抑制剂功能验证”的完整链条。
p-AMPK的来源为MDSCs细胞内的磷酸化蛋白,验证方法包括蛋白质免疫印迹检测其表达水平,以及AMPK抑制剂实验验证其功能;特异性方面,p-AMPK仅在具有免疫抑制活性的MDSCs中高表达,在未诱导的骨髓细胞和抑制iNOS/ARG1的MSC-1细胞中低表达,特异性较强;敏感性方面,AMP/ATP比值在MDSCs诱导24h后即显著升高,可早期提示AMPK的激活。伴随代谢Biomarker中,葡萄糖摄取率、L-Gln摄取率在MDSCs诱导24h后显著升高,TCA循环中间产物浓度在24h后持续积累,可作为MDSCs免疫抑制活性的早期伴随标志物。
本研究的核心成果是首次明确p-AMPK作为MDSCs免疫抑制活性的调控Biomarker,其激活与MDSCs的代谢重编程和免疫抑制功能正相关,抑制AMPK可显著降低MDSCs的免疫抑制活性(Jurkat细胞密度和活力恢复至对照组水平,n=3,P<0.05);同时,葡萄糖摄取率、L-Gln摄取率等代谢标志物可作为MDSCs免疫抑制活性的伴随Biomarker,用于监测MDSCs的功能状态。该成果的创新性在于首次建立了AMPK与MDSCs免疫抑制功能的直接关联,为肿瘤免疫治疗提供了新的代谢靶点,具有潜在的临床转化价值。
