1. 领域背景与文献引入
文献英文标题:Single cell RNA-Seq reveals pre-cDCs fate determined by transcription factor combinatorial dose;发表期刊:BMC Molecular and Cell Biology;影响因子:未公开;研究领域:经典树突状细胞分化调控(免疫细胞生物学)
经典树突状细胞(cDC)是连接先天免疫与适应性免疫的核心免疫细胞,能够识别病原体信号、捕获并呈递抗原以激活T细胞,维持免疫记忆与免疫耐受。根据功能与表型差异,人类经典树突状细胞分为CD141⁺经典树突状细胞1(cDC1)和CD1c⁺经典树突状细胞2(cDC2)两个亚型,分别主导CD8⁺细胞毒性T细胞应答和CD4⁺辅助T细胞应答。前经典树突状细胞(pre-cDC)是两种经典树突状细胞的直接前体细胞,由骨髓中的共同树突状细胞祖细胞分化而来并迁移至外周组织完成终末分化。领域共识:近年来的研究通过流式细胞分选结合批量RNA测序技术,发现人和小鼠的前经典树突状细胞存在异质性,包含预承诺向经典树突状细胞1或经典树突状细胞2分化的亚群,但这些研究依赖细胞表面标记的分选策略,未直接通过转录组特征解析亚群差异,且前经典树突状细胞命运承诺的关键分子驱动机制仍不明确。现有研究已鉴定出多个与经典树突状细胞分化相关的转录因子,如IRF8调控经典树突状细胞1发育、IRF4调控经典树突状细胞2发育,但转录因子间的组合调控效应及其剂量作用尚未被系统揭示。本研究针对这一核心空白,采用单细胞RNA测序技术解析人外周血前经典树突状细胞的转录组异质性,旨在揭示前经典树突状细胞命运决定的关键转录调控机制,为免疫细胞分化的调控网络研究提供新范式。
2. 文献综述解析
作者对领域内现有研究按“技术方法类型”和“研究结论深度”进行分类评述,重点对比批量RNA测序与单细胞RNA测序在解析细胞异质性中的应用,以及现有研究在前经典树突状细胞命运调控机制中的不足。
现有研究主要通过流式细胞分选结合批量RNA测序技术,发现人和小鼠的前经典树突状细胞存在两个预承诺亚群,分别定向分化为经典树突状细胞1和经典树突状细胞2,这些研究证实了前经典树突状细胞的异质性,但依赖于细胞表面标记的分选策略,未直接通过转录组特征解析亚群差异;同时,现有研究鉴定了多个经典树突状细胞分化相关的转录因子,包括经典树突状细胞1特异性的IRF8、BATF3,经典树突状细胞2特异性的IRF4、ZEB2等,但这些研究多聚焦于单个转录因子的功能,未揭示转录因子间的组合调控效应。现有研究的局限性在于,未利用单细胞转录组技术直接捕捉前经典树突状细胞的转录组异质性,且未明确前经典树突状细胞命运决定的核心分子驱动机制,尤其是转录因子的剂量调控作用。
本研究的创新价值在于,首次采用单细胞RNA测序技术结合转录因子调控网络分析,直接从转录组层面解析前经典树突状细胞的亚群特征,并揭示转录因子的组合剂量(而非单个因子的表达水平)是前经典树突状细胞命运决定的关键,填补了前经典树突状细胞分化调控分子机制的空白,为细胞分化的转录调控研究提供了新的视角。
3. 研究思路总结与详细解析
本研究的核心目标是解析人前经典树突状细胞命运决定的关键转录调控机制,核心科学问题是前经典树突状细胞预承诺亚群的转录组特征及命运决定的分子基础,技术路线遵循“细胞分离与混合测序→单细胞转录组质控与分群→关键基因筛选→转录因子调控网络分析→多数据集验证”的闭环逻辑,通过多组学技术与生物信息学分析结合,系统揭示转录因子组合剂量的调控作用。
3.1 细胞分离与单细胞RNA测序实验设计
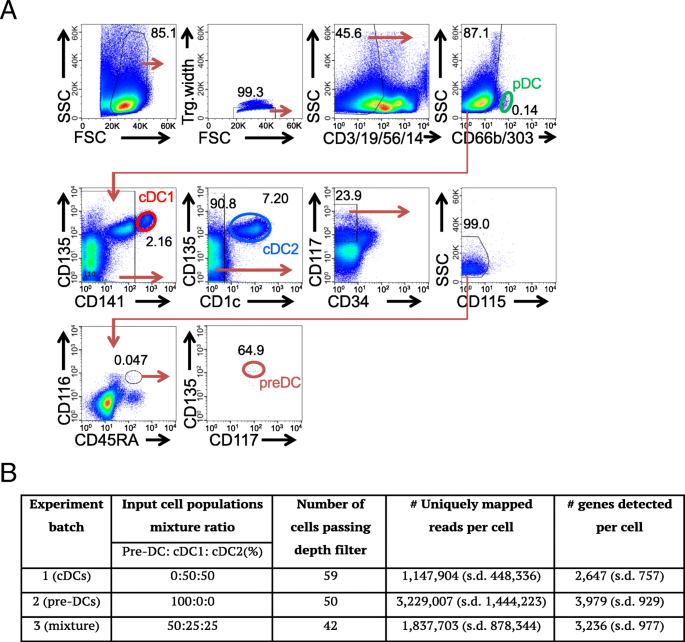
实验目的:验证单细胞转录组能否不依赖细胞表面标记,直接从混合细胞群体中区分前经典树突状细胞、经典树突状细胞1和经典树突状细胞2,并消除批次效应的影响。
方法细节:从人外周血中通过磁珠富集结合流式细胞分选,分离得到前经典树突状细胞(Lin⁻CD45RA⁺CD115⁻CD116⁺CD117⁺Flt3⁺)、经典树突状细胞1(CD141⁺)和经典树突状细胞2(CD1c⁺)细胞;将细胞分为三个批次进行混合:批次1为经典树突状细胞1与经典树突状细胞2按1:1混合,批次2为仅前经典树突状细胞,批次3为前经典树突状细胞、经典树突状细胞1、经典树突状细胞2按2:1:1混合;采用Fluidigm C1平台进行单细胞捕获与RNA测序文库构建,使用Illumina NextSeq500进行75bp单端测序,每个样本测序深度约400M reads。
结果解读:通过测序深度过滤(>100,000比对reads)、线粒体比例过滤(<30%)和表达基因数过滤(>1000),最终获得135个高质量单细胞转录组数据;多维尺度分析显示,不同批次的细胞可被清晰分为前经典树突状细胞集群和经典树突状细胞集群,且经典树突状细胞集群可进一步分为经典树突状细胞1和经典树突状细胞2亚群,与细胞表面标记的表达完全一致,表明单细胞转录组可独立于表面标记区分细胞类型,且批次效应可忽略。
产品关联:实验所用关键产品:BD的CD135抗体(4G8, PE)、Biolegend的CD117抗体(A3C6E2, Biotin)、Miltenyi的抗生物素磁珠与LS MACS磁柱、Fluidigm C1单细胞测序平台、Illumina NextSeq500测序仪、ERCC ExFold RNA-Spike-Ins(Ambion)。
3.2 单细胞转录组质控与细胞分群验证
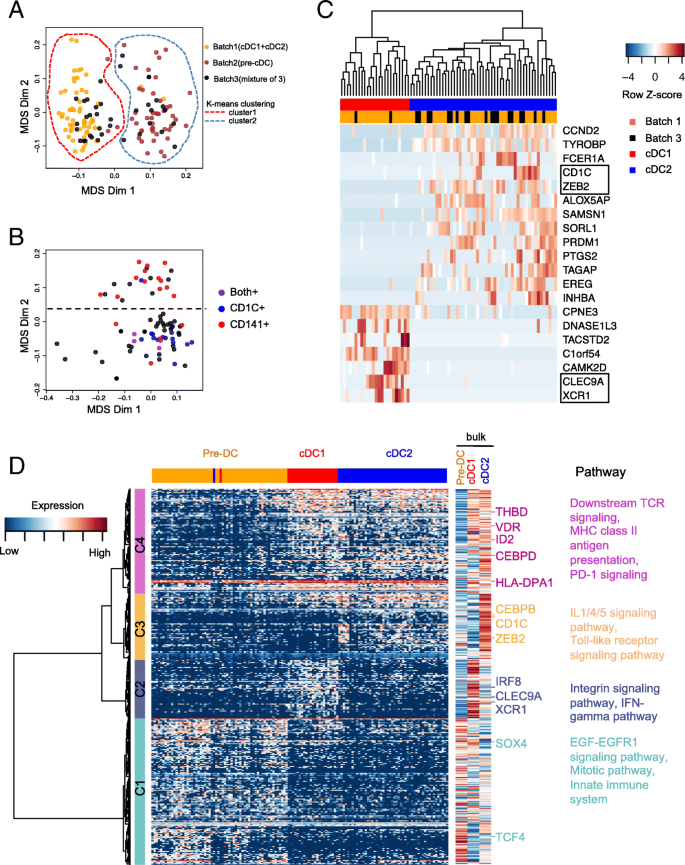
实验目的:进一步验证单细胞转录组数据的可靠性,明确前经典树突状细胞、经典树突状细胞1、经典树突状细胞2的转录组特征差异。
方法细节:对135个高质量单细胞进行差异表达基因分析,通过单因素方差分析筛选在至少两个细胞群体中差异表达的基因(假发现率FDR<0.05,|log2倍数变化|>1),共得到380个差异基因;对这些基因进行层次聚类,并结合批量RNA测序数据验证表达模式的一致性;采用ConsensusPathDB进行通路富集分析。
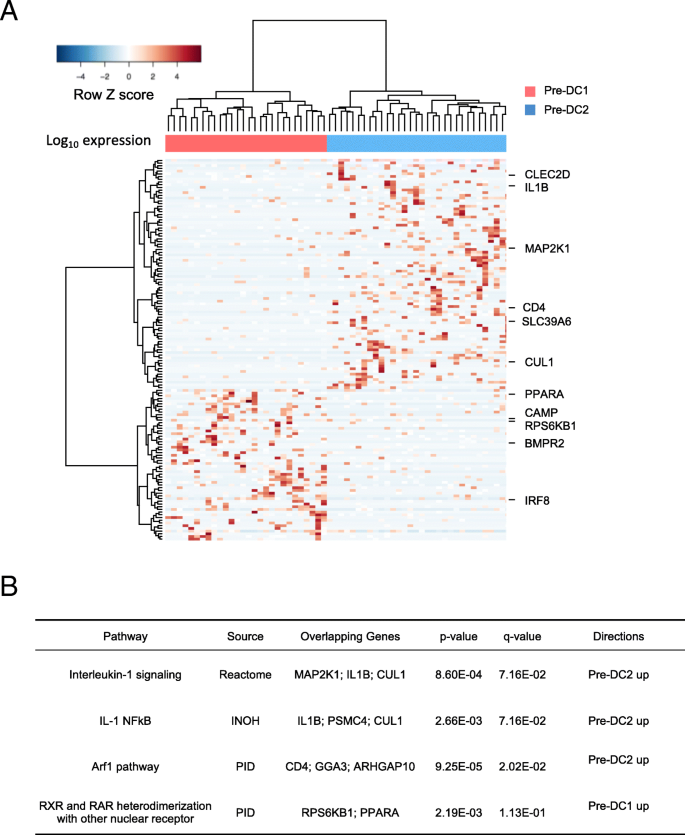
结果解读:380个差异基因可分为4个聚类:聚类1基因在前经典树突状细胞中高表达,富集于EGF-EGFR1信号通路和有丝分裂通路,提示前经典树突状细胞的增殖前体特征;聚类2基因在经典树突状细胞1中高表达,包括CLEC9A、XCR1和IRF8,富集于整合素信号通路和IFN-γ通路,与经典树突状细胞1的功能特征一致;聚类3基因在经典树突状细胞2中高表达,包括CD1c、CEBPB和ZEB2,富集于IL1/4/5信号通路和Toll样受体信号通路,符合经典树突状细胞2的功能特征;聚类4基因在经典树突状细胞1和经典树突状细胞2中均高表达,富集于TCR信号通路和MHC II类抗原呈递通路,反映成熟经典树突状细胞的免疫激活功能;单细胞与批量RNA测序的基因表达模式高度一致,证实了数据的可靠性。
产品关联:文献未提及具体实验产品,领域常规使用差异表达分析软件(如DESeq2、SCDE)、通路富集分析工具(如ConsensusPathDB)。
3.3 pre-cDC异质性相关关键基因筛选
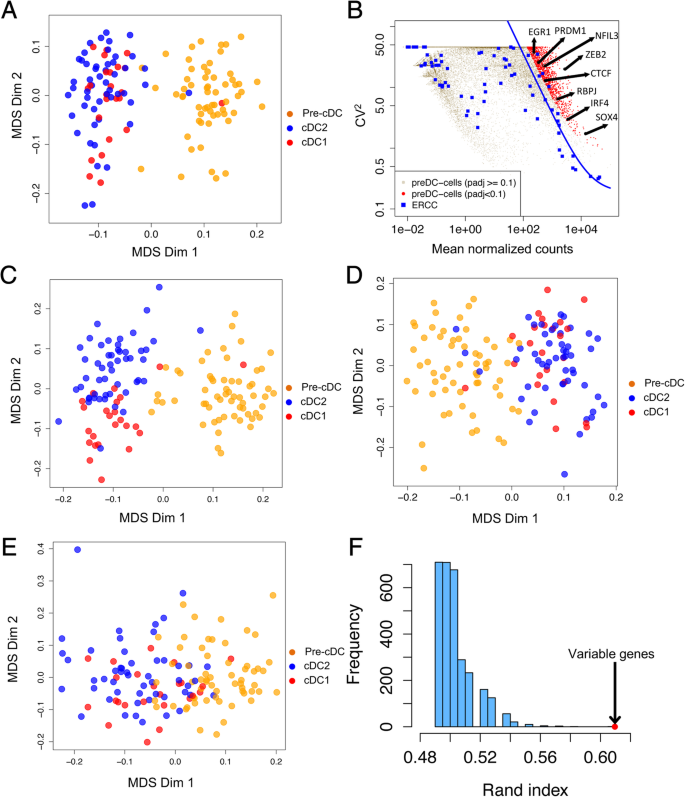
实验目的:筛选与前经典树突状细胞命运承诺相关的关键基因,解析前经典树突状细胞的转录组异质性。
方法细节:采用Brennecke等的方法,基于ERCC spike-in估计技术噪声,筛选前经典树突状细胞中表达变异性显著高于技术噪声的基因(FDR<0.1,至少在30个单细胞中检测到表达),共得到842个高可变基因;通过多维尺度分析这些基因对细胞分群的影响,并与随机基因、细胞周期基因的分群效果对比。
结果解读:842个高可变基因可有效区分经典树突状细胞1和经典树突状细胞2,且能反映前经典树突状细胞的异质性,而随机选择的基因或细胞周期基因无法有效区分经典树突状细胞亚群;通路富集分析显示,这些高可变基因富集于TGF-β信号通路、整合素信号通路等,提示前经典树突状细胞中已启动向经典树突状细胞分化的转录程序,但全局转录组无法直接区分前经典树突状细胞的两个亚群。
产品关联:文献未提及具体实验产品,领域常规使用单细胞转录组变异分析工具(如SCDE)、多维尺度分析算法。
3.4 核心转录因子调控网络与命运决定机制解析
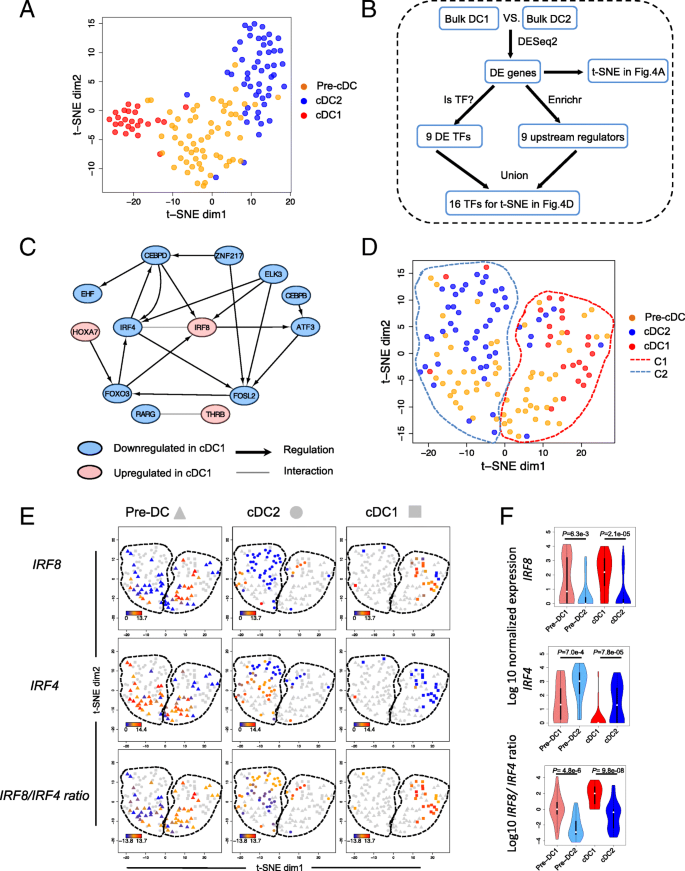
实验目的:解析前经典树突状细胞命运决定的核心转录调控机制,鉴定关键转录因子。
方法细节:通过批量RNA测序筛选经典树突状细胞1与经典树突状细胞2的差异表达基因(Benjamini-Hochberg校正P值<0.05,|log2倍数变化|>1),得到234个经典树突状细胞特征基因;进一步筛选差异表达的转录因子,或靶基因富集于经典树突状细胞特征基因的转录因子,共得到16个候选主调控转录因子;通过t分布邻域嵌入(t-SNE)分析这些转录因子的表达对前经典树突状细胞分群的影响,并分析IRF8与IRF4的表达比值与亚群的关联。
结果解读:经典树突状细胞特征基因无法区分前经典树突状细胞的亚群,而16个候选主调控转录因子可将前经典树突状细胞分为两个亚群(pre-cDC1和pre-cDC2),分别与经典树突状细胞1和经典树突状细胞2的转录组特征接近;IRF8在经典树突状细胞1和pre-cDC1中高表达,IRF4在经典树突状细胞2和pre-cDC2中高表达,但单个转录因子的表达无法完全区分前经典树突状细胞亚群;IRF8/IRF4的表达比值在pre-cDC1和pre-cDC2间差异显著(P=4.8e-6,n=50,Wilcoxon秩和检验),是前经典树突状细胞命运承诺的关键指标;通路富集分析显示,pre-cDC1富集于RXR/RAR信号通路,pre-cDC2富集于IL-1相关通路,提示两个亚群的功能特征差异。
产品关联:文献未提及具体实验产品,领域常规使用转录因子调控网络分析工具(如String、ChEA数据库)、t-SNE聚类算法。
3.5 多数据集验证与pre-cDC亚群特征解析
实验目的:验证候选主调控转录因子及IRF8/IRF4比值在前经典树突状细胞命运决定中的作用,并解析两个前经典树突状细胞亚群的转录特征。
方法细节:将本研究的分析方法应用于三个已公开的单细胞RNA测序数据集(Breton et al.、Villani et al.、See et al.),验证候选主调控转录因子对前经典树突状细胞亚群的区分能力;采用SCDE分析pre-cDC1和pre-cDC2的差异表达基因,并进行通路富集分析。
结果解读:在三个独立数据集中,候选主调控转录因子均可有效区分前经典树突状细胞的两个预承诺亚群,且IRF8/IRF4比值与亚群的关联一致;pre-cDC1与pre-cDC2的差异表达基因通路分析显示,pre-cDC1富集于RXR/RAR信号通路,该通路可促进树突状细胞的抗原呈递和分化,pre-cDC2富集于IL-1相关通路,与经典树突状细胞2的功能特征一致;这些结果证实了转录因子组合剂量调控前经典树突状细胞命运的结论的可靠性。
产品关联:文献未提及具体实验产品,领域常规使用公共数据集(如GEO数据库)、差异表达分析软件(SCDE)。
4. Biomarker研究及发现成果
本研究鉴定的核心Biomarker是“转录因子IRF8与IRF4的表达比值”,该Biomarker是前经典树突状细胞命运承诺的关键调控指标,通过单细胞转录组分析与多数据集验证,明确了其在前经典树突状细胞分化中的核心作用。
Biomarker定位:该Biomarker属于“转录调控类Biomarker”,筛选逻辑为“批量RNA测序筛选经典树突状细胞1与经典树突状细胞2的差异表达基因→富集差异表达转录因子及其靶基因→单细胞转录组验证转录因子表达与前经典树突状细胞亚群的关联→比值分析确定核心调控指标”,完整的验证链条包括“单细胞转录组分群→通路富集分析→多独立数据集验证”。
研究过程详述:Biomarker的来源为人外周血前经典树突状细胞、经典树突状细胞1、经典树突状细胞2的单细胞转录组数据,验证方法包括t-SNE聚类分析、Wilcoxon秩和检验、多数据集交叉验证;特异性与敏感性方面,IRF8/IRF4比值在pre-cDC1和pre-cDC2间差异显著(P=4.8e-6,n=50),可有效区分两个预承诺亚群,在三个独立数据集中的验证结果一致,具有良好的重复性。
核心成果:该Biomarker的功能关联在于,其表达比值直接决定前经典树突状细胞向经典树突状细胞1或经典树突状细胞2的命运承诺,比值高的前经典树突状细胞预承诺向经典树突状细胞1分化,比值低的预承诺向经典树突状细胞2分化;创新性在于首次提出“转录因子组合剂量决定细胞分化命运”的概念,突破了传统单个转录因子调控的认知;统计学结果显示,IRF8/IRF4比值在pre-cDC1与pre-cDC2间的差异具有极显著统计学意义(P=4.8e-6,n=50),且在三个独立数据集中均得到验证,无未明确的关键数据。
