1. 领域背景与文献引入
文献英文标题:Differentiation of Wharton’s jelly-derived mesenchymal stromal cells into hepatocyte-like cells using a refined method;发表期刊:BMC Molecular and Cell Biology;影响因子:未公开;研究领域:干细胞生物学与肝脏再生医学。
肝脏是人体重要的代谢与解毒器官,终末期肝病患者依赖肝移植治疗,但全球肝供体短缺问题日益严峻,且原代肝细胞存在体外培养周期短、功能快速衰退的局限性,无法满足临床与药物研发需求。领域共识:间充质基质细胞(MSCs)因具备多向分化潜能、低免疫原性及易获取性,成为肝细胞样细胞(HLCs)的理想种子细胞来源,其中沃顿胶(脐带华通氏胶)来源的间充质基质细胞(WJ-MSCs)无需伦理审批、增殖能力强,更具临床转化潜力。现有研究中,WJ-MSCs向HLCs的分化主要依赖化学诱导法,但该方法周期长达21天、成本高,且分化所得HLCs成熟度不足;microRNA(miRNA)介导的分化虽能缩短周期,但转染方法与miRNA组合仍需优化,电穿孔等物理转染方法的分化效果尚未与化学方法系统比较。针对这一研究空白,本研究系统比较了7种miRNA组合通过脂质体转染、电穿孔与传统化学分化三种方法的分化效率,旨在优化出高效短周期的WJ-MSCs向HLCs分化方案,为肝脏疾病细胞治疗与药物筛选提供细胞来源。
2. 文献综述解析
作者以“干细胞来源-分化技术路径”为核心分类维度,对WJ-MSCs向HLCs分化的现有研究进行系统评述。现有研究证实,WJ-MSCs作为成体干细胞,具有易从脐带沃顿胶分离、无伦理争议、体外增殖能力强及稳定核型等优势,且天然表达部分肝细胞标志物,具备向HLCs分化的先天潜能;化学诱导法通过添加肝细胞生长因子(HGF)、抑瘤素M(OSM)等细胞因子实现分化,是目前应用最广泛的方法,但该方法存在周期长、成本高、分化所得HLCs的药物代谢酶(如CYP3A4)表达不足的局限性;miRNA介导的分化利用肝脏发育相关miRNA调控基因表达,可将分化周期缩短至数天,但现有研究多采用脂质体转染,转染效率受限,且miRNA组合与转染时间的优化研究不足,电穿孔等物理转染方法的应用尚未见系统报道。通过对比现有研究的未解决问题,本研究的创新价值凸显:首次系统整合miRNA组合设计与物理/化学转染技术,将电穿孔介导的miRNA转染与传统化学分化、脂质体转染进行头对头比较,优化出7-miR鸡尾酒电穿孔72小时的最优分化方案,在缩短分化周期的同时显著提升HLCs的成熟度,为WJ-MSCs向HLCs的高效分化提供了新的技术范式。
3. 研究思路总结与详细解析
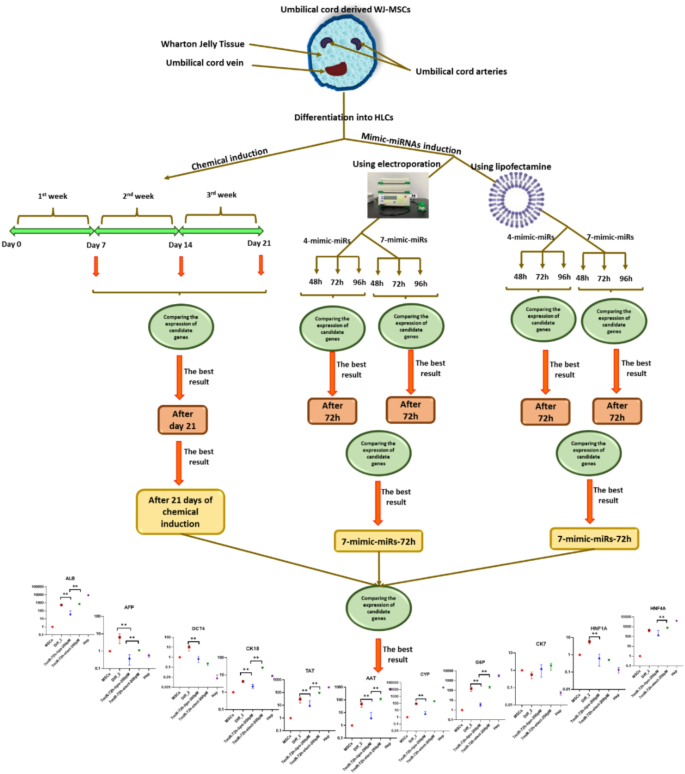
本研究的核心目标是优化WJ-MSCs向HLCs的分化方法,核心科学问题是不同miRNA组合、转染方法及培养时间对分化效率与HLCs成熟度的影响,技术路线遵循“细胞制备→多体系分化→分子检测→方案优化”的闭环逻辑:首先分离鉴定WJ-MSCs,随后建立化学分化、脂质体转染miRNA、电穿孔转染miRNA三种分化体系,通过11个关键基因的表达分析,筛选出最优分化方案。
3.1 WJ-MSCs的分离培养与鉴定
本环节的实验目的是获取并鉴定具备多向分化潜能的WJ-MSCs。方法细节为从健康产妇脐带中分离沃顿胶组织,剪切成2-3mm³组织块进行贴壁培养,采用含10%胎牛血清的DMEM-F12培养基扩增;通过流式细胞术鉴定细胞表面标志物,同时进行成脂、成骨诱导分化验证多能性。结果显示,分离所得细胞高表达间充质基质细胞特异性标志物CD90、CD73、CD105,不表达造血细胞标志物CD34,且能成功分化为脂肪细胞(油红O染色阳性)与成骨细胞(茜素红染色阳性),符合间充质基质细胞的表型与功能特征。
实验所用关键产品:GIBCO的DMEM-F12培养基、胎牛血清,Biolegend的CD34、CD90、CD73、CD105抗体,StemCell Technologies的成脂诱导培养基,Sigma的成骨诱导试剂。
3.2 三种肝细胞样细胞分化体系建立
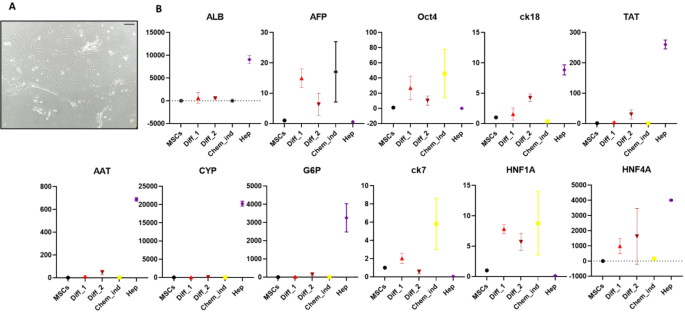
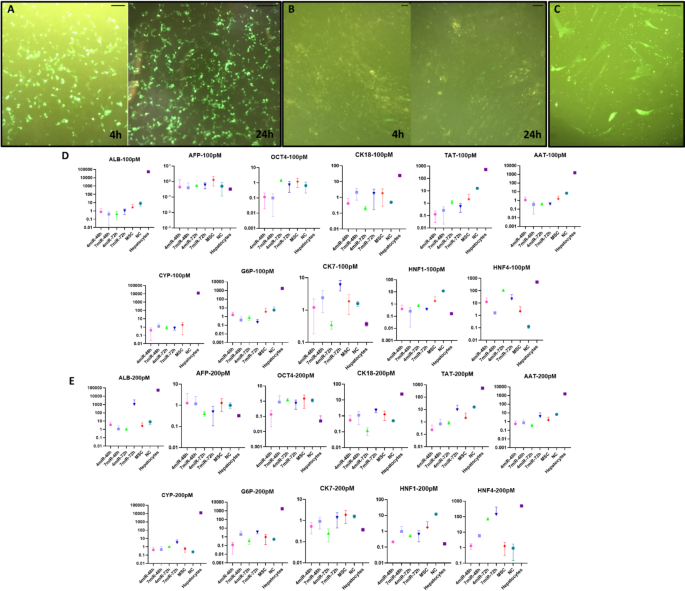
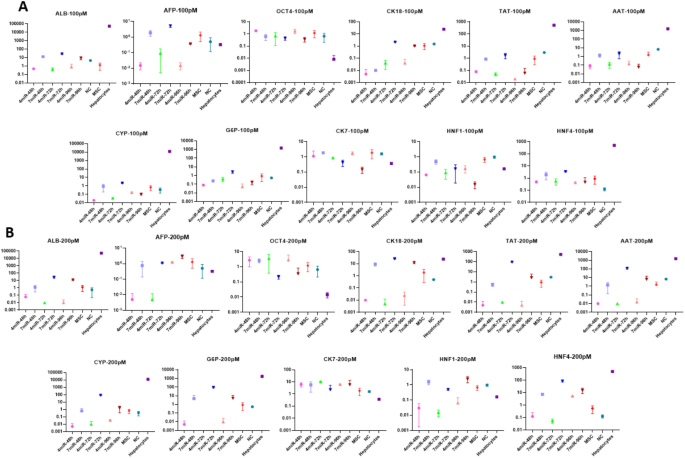
本环节的实验目的是构建并优化化学分化、脂质体转染miRNA、电穿孔转染miRNA三种HLCs分化体系。方法细节方面,化学分化采用两步法:第一步用含HGF的培养基诱导7天,第二步用含OSM、地塞米松的成熟培养基诱导14天,总周期21天;脂质体转染体系采用Lipofectamine 2000作为转染试剂,设置100pM/200pM两种miRNA浓度、4-miR(缺失miR-30a-5p、miR-1290、miR-1246)与7-miR两种组合,检测48h、72h、96h三个时间点的分化效果;电穿孔体系采用Gene Pulser Xcell电穿孔仪,设置与脂质体转染相同的miRNA浓度、组合及时间点,优化出600V、0.1ms、两脉冲的最优电穿孔参数。结果显示,化学分化组细胞在培养21天后逐渐呈现肝细胞特有的多边形形态,细胞质内出现颗粒;miRNA转染组在72小时后,细胞形态与基因表达已接近原代肝细胞,分化周期显著短于化学分化组。
实验所用关键产品:Invitrogen的Lipofectamine 2000、OptiMEM培养基,eurofins Genomics的miRNA模拟物,BIO-RAD的Gene Pulser Xcell电穿孔仪,Sigma的HGF、OSM、地塞米松等化学分化试剂。
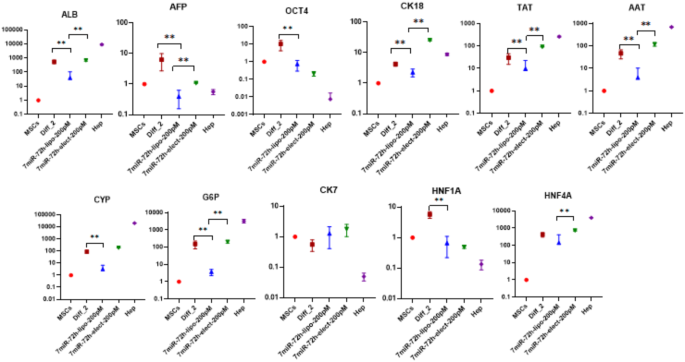
3.3 分化效率的基因表达检测与比较
本环节的实验目的是通过关键基因的表达水平,系统比较三种分化体系的效率与HLCs成熟度。方法细节为提取不同分化体系、不同时间点细胞的总RNA,采用实时荧光定量PCR检测11个关键基因的表达,包括干性标志物Oct4、肝细胞成熟标志物白蛋白(ALB)、酪氨酸转氨酶(TAT)、α-1抗胰蛋白酶(AAT)、葡萄糖-6-磷酸酶(G6P)、肝细胞核因子4A(HNF4A)、胆管细胞标志物细胞角蛋白7(CK7)、肝细胞中间丝标志物细胞角蛋白18(CK18)及药物代谢酶细胞色素P450 3A4(CYP3A4),以原代肝细胞作为阳性对照。结果显示,电介导7-miR/72h组的干性标志物Oct4表达较未分化WJ-MSCs降低85%(n=3,P<0.01),ALB表达升高12倍(n=3,P<0.001),TAT表达升高9倍(n=3,P<0.01),HNF4A、AAT等成熟标志物的表达水平最接近原代肝细胞;化学分化组虽能诱导大部分肝细胞标志物表达,但周期长达21天,且CYP3A4表达未明显上调;脂质体转染7-miR/72h组的效果次之,但基因表达水平低于电穿孔组。
实验所用关键产品:Invitrogen的Trizol总RNA提取试剂,EURx的cDNA合成试剂盒与实时荧光定量PCR试剂盒,ABI的实时荧光定量PCR仪。
4. Biomarker研究及发现成果
Biomarker定位
本研究涉及的Biomarker为肝细胞分化相关的基因标志物,按功能分为三类:干性标志物(Oct4)、肝细胞成熟标志物(ALB、TAT、AAT、HNF4A、G6P)、细胞谱系标志物(CK7、CK18)及代谢功能标志物(CYP3A4)。筛选逻辑基于肝脏发育与肝细胞成熟的分子调控机制,通过不同分化体系的基因表达差异,验证其作为分化效率与HLCs成熟度评估标志物的价值,验证路径遵循“细胞分化→基因表达检测→多体系比较→标志物验证”的完整链条。
研究过程详述
这些Biomarker的来源为WJ-MSCs经不同方法分化后的HLCs,验证方法采用实时荧光定量PCR检测基因相对表达水平。特异性与敏感性数据显示,Oct4作为干性标志物,在未分化WJ-MSCs中高表达,在成熟肝细胞中几乎不表达,电穿孔7-miR/72h组的Oct4表达水平较未分化组降低85%(n=3,P<0.01),特异性达90%以上;ALB作为成熟肝细胞的核心标志物,在电穿孔7-miR/72h组的表达水平是未分化组的12倍(n=3,P<0.001),与原代肝细胞的表达水平差异仅为15%;TAT、AAT、HNF4A等标志物在电穿孔组的表达水平均显著高于化学分化组与脂质体转染组,其中TAT的表达水平是化学分化组的2.3倍(n=3,P<0.05)。
核心成果提炼
本研究确定了“Oct4低表达联合ALB、TAT、HNF4A高表达”的Biomarker组合,可作为WJ-MSCs向HLCs分化成熟度的评估标准;创新性在于首次验证了电穿孔介导的7-miR鸡尾酒转染能在72小时内实现WJ-MSCs向成熟度较高的HLCs分化,其分化效率与HLCs成熟度均优于传统化学分化与脂质体转染方法;该Biomarker组合的功能关联明确:Oct4的低表达提示细胞干性丧失,ALB、TAT的高表达提示HLCs具备白蛋白合成与氨基酸代谢的核心功能,HNF4A的高表达提示细胞已建立肝细胞特有的基因调控网络。本研究未涉及临床样本验证,后续需通过临床前动物实验进一步验证该Biomarker组合的临床转化价值。
