1. 领域背景与文献引入
文献英文标题:Live cell imaging with protein domains capable of recognizing phosphatidylinositol 4,5-bisphosphate; a comparative study;发表期刊:BMC Cell Biology;影响因子:未公开;研究领域:细胞信号转导(磷脂酰肌醇信号通路)
磷脂酰肌醇4,5-二磷酸(PtdIns(4,5)P2)是真核细胞质膜中至关重要的调控磷脂,不仅作为肌醇1,4,5-三磷酸(InsP3)和二酰甘油(DAG)等第二信使的前体,还直接调控离子通道、转运体活性及内吞复合物的招募,其亚细胞定位与动态水平变化的可视化是解析其生物学功能的核心技术需求。领域共识:早期研究中,磷脂酶Cδ1(PLCδ1)的PH结构域融合绿色荧光蛋白(GFP)是应用最广泛的PtdIns(4,5)P2成像探针,但该探针存在结合可溶性InsP3的固有缺陷,可能在PLC激活时因InsP3竞争结合导致探针从膜上移位,高估PtdIns(4,5)P2的减少幅度,影响实验结果解读的准确性。当前研究空白在于缺乏对多种潜在PtdIns(4,5)P2结合结构域的系统性能对比,尤其是酵母来源PH结构域和哺乳动物Tubby结构域在哺乳动物细胞中的成像适用性尚未明确,因此本研究旨在通过多维度实验对比不同蛋白结构域作为PtdIns(4,5)P2活细胞成像工具的优势与局限性,为领域提供更精准的探针选择依据。
2. 文献综述解析
作者按蛋白结构域来源将现有PtdIns(4,5)P2成像探针分为三类:哺乳动物PLCδ1PH结构域、酵母PH结构域和哺乳动物Tubby结构域,围绕结合特异性、成像性能及功能干扰三个维度展开评述。现有研究中,PLCδ1PH-GFP因能有效报告PtdIns(4,5)P2的动态变化被广泛应用,但核心局限性在于其高亲和力结合InsP3,可能导致对PtdIns(4,5)P2变化的解读偏差,且无法检测细胞内其他膜结构中的PtdIns(4,5)P2;酵母PH结构域在体外显示出一定的PtdIns(4,5)P2结合特异性,但在酵母细胞中的膜定位可能依赖其他蛋白相互作用,其在哺乳动物细胞中的性能尚未得到系统验证;Tubby结构域被报道为特异性PtdIns(4,5)P2结合模块,但缺乏与PLCδ1PH的直接对比数据,其成像性能仍不明确。本研究的创新价值在于首次在哺乳动物细胞中完成了多种酵母PH结构域、Tubby结构域与PLCδ1PH的系统对比,通过细胞定位、动态响应、体外结合及功能干扰等多维度实验,明确了不同探针的性能差异,解决了领域内缺乏精准PtdIns(4,5)P2成像探针选择标准的核心问题,为不同实验场景下的探针选择提供了直接实验依据。
3. 研究思路总结与详细解析
本研究的核心目标是评估多种蛋白结构域作为PtdIns(4,5)P2活细胞成像探针的适用性,核心科学问题是不同来源的PtdIns(4,5)P2结合结构域在哺乳动物细胞中的结合特性、动态响应及对细胞信号的影响,技术路线遵循“探针构建→细胞表达与定位分析→动态响应测试→体外结合实验→功能影响评估→结论总结”的闭环逻辑,通过多维度实验系统对比不同探针的性能。
3.1 酵母PH结构域的细胞定位与响应测试
实验目的为评估多种酵母PH结构域在哺乳动物细胞中的膜定位特性及对PtdIns(4,5)P2变化的响应能力。研究将Cla4、Skm1、Slm2、Num1、Slm1、Opy1等酵母PH结构域构建为GFP融合蛋白,转染至稳定表达大鼠AT1a血管紧张素受体的HEK293-AT1细胞或COS-7细胞;通过100 nM血管紧张素II(AngII)刺激激活PLC,或通过雷帕霉素诱导的5-磷酸酶招募系统清除质膜PtdIns(4,5)P2,观察探针的移位情况。结果显示,所有酵母PH结构域均定位于质膜,但Cla4、Skm1、Slm2结构域对PtdIns(4,5)P2变化无响应;Num1、Slm1、Opy1结构域在AngII刺激下出现短暂且不完全的膜-胞质移位,其中Slm1在5-磷酸酶招募后仅部分移位,提示其同时结合PtdIns(4,5)P2和PtdIns4P;Num1结构域表达水平低,且在部分细胞中诱导异常膜泡结构;Opy1结构域存在核定位,需添加核输出信号改善定位。
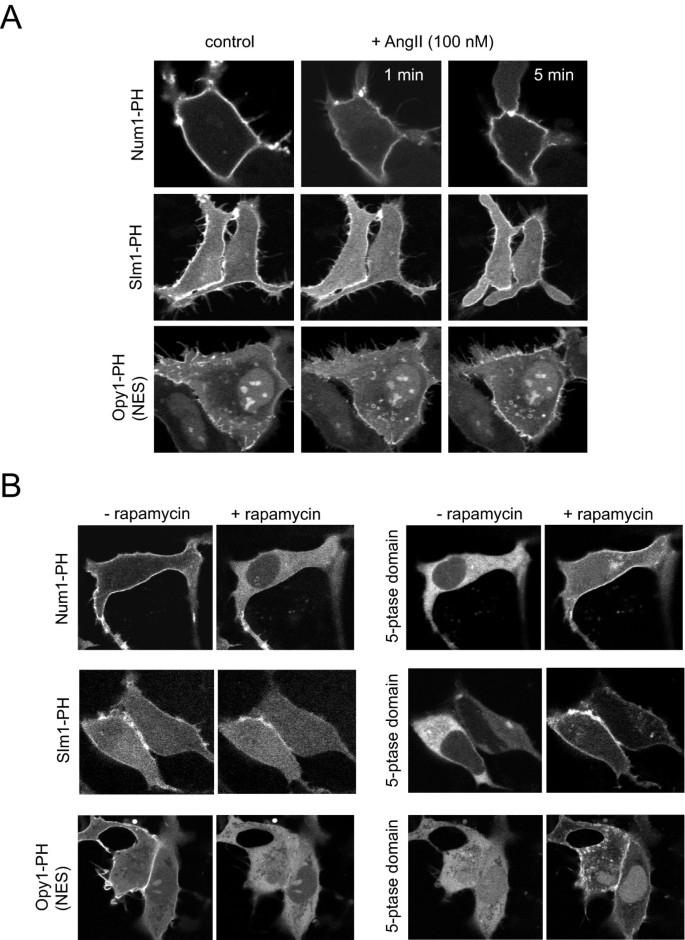
文献未提及具体实验产品,领域常规使用脂质体转染试剂、荧光显微镜成像系统、蛋白电泳及免疫印迹相关试剂。
3.2 Tubby结构域与PLCδ1PH的结合亲和力对比
实验目的为比较Tubby结构域与PLCδ1PH对质膜PtdIns(4,5)P2的结合亲和力差异。研究将GFP标记的Tubby结构域和mRFP标记的PLCδ1PH共转染至HEK293-AT1细胞,通过共聚焦显微镜观察定位差异,计算质膜与胞质荧光强度比值;采用荧光漂白恢复(FRAP)分析,测量探针的移动分数和半恢复时间(T1/2)。结果显示,Tubby结构域的质膜/胞质荧光强度比值为6.9±1.23(n=25),显著高于PLCδ1PH的2.1±0.33(n=25,P<0.05);FRAP分析显示,Tubby结构域的T1/2为3.1±0.33秒(n=90),是PLCδ1PH(1.2±0.09秒,n=90)的2.5倍以上(P<0.0001),提示Tubby结构域对质膜的结合亲和力更高,解离速率更慢。
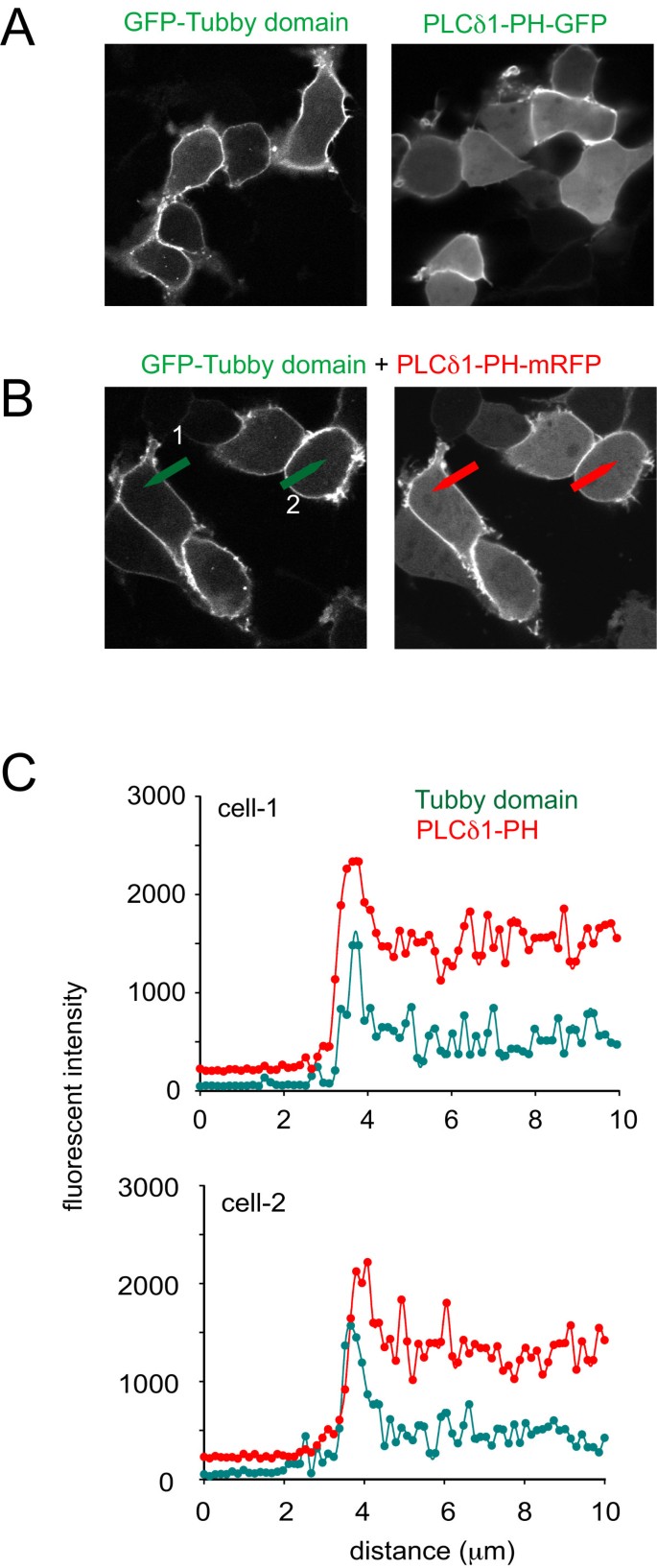
文献未提及具体实验产品,领域常规使用共聚焦激光扫描显微镜、FRAP分析软件、荧光蛋白标记载体。
3.3 激动剂诱导PLC激活后的探针响应测试
实验目的为对比Tubby结构域与PLCδ1PH在激动剂诱导PLC激活时的动态响应差异。研究将GFP-Tubby和mRFP-PLCδ1PH共转染至HEK293-AT1细胞,分别用不同浓度AngII(10 nM、30 nM、0.1-1 μM)刺激,或转染组成型激活的Gq蛋白(Gq),观察探针移位的动力学变化;用10 μM离子霉素处理,诱导内源性PLC完全激活,确定探针的最大移位幅度。结果显示,高浓度AngII刺激下,两者均快速从膜移位至胞质,但PLCδ1PH移位更完全;30 nM AngII刺激下,PLCδ1PH的半最大移位时间为3.8±0.3秒(n=54),显著快于Tubby结构域的6.7±0.3秒(n=54,P<0.001),且Tubby结构域仅部分移位(AngII刺激后的胞质荧光强度增加为离子霉素处理后的30%);转染Gq后,PLCδ1PH完全移位,而Tubby结构域仍保留部分膜定位。
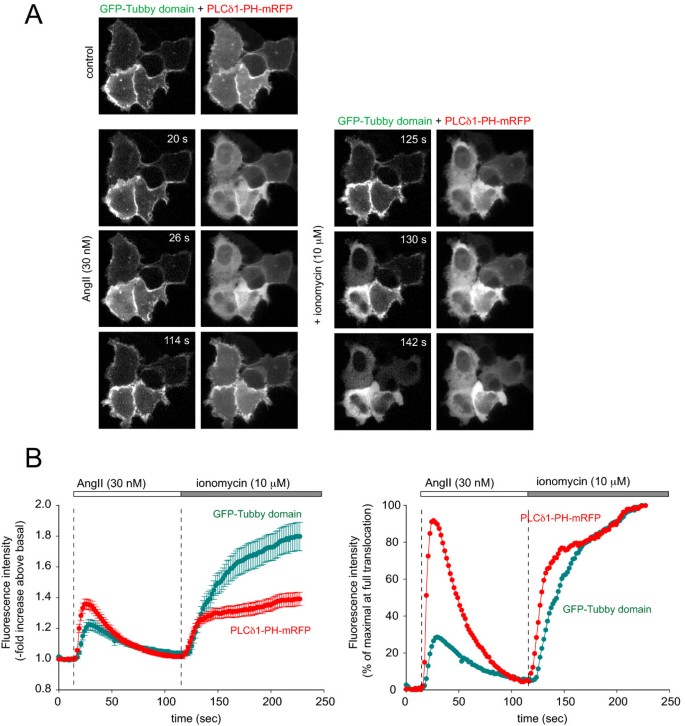
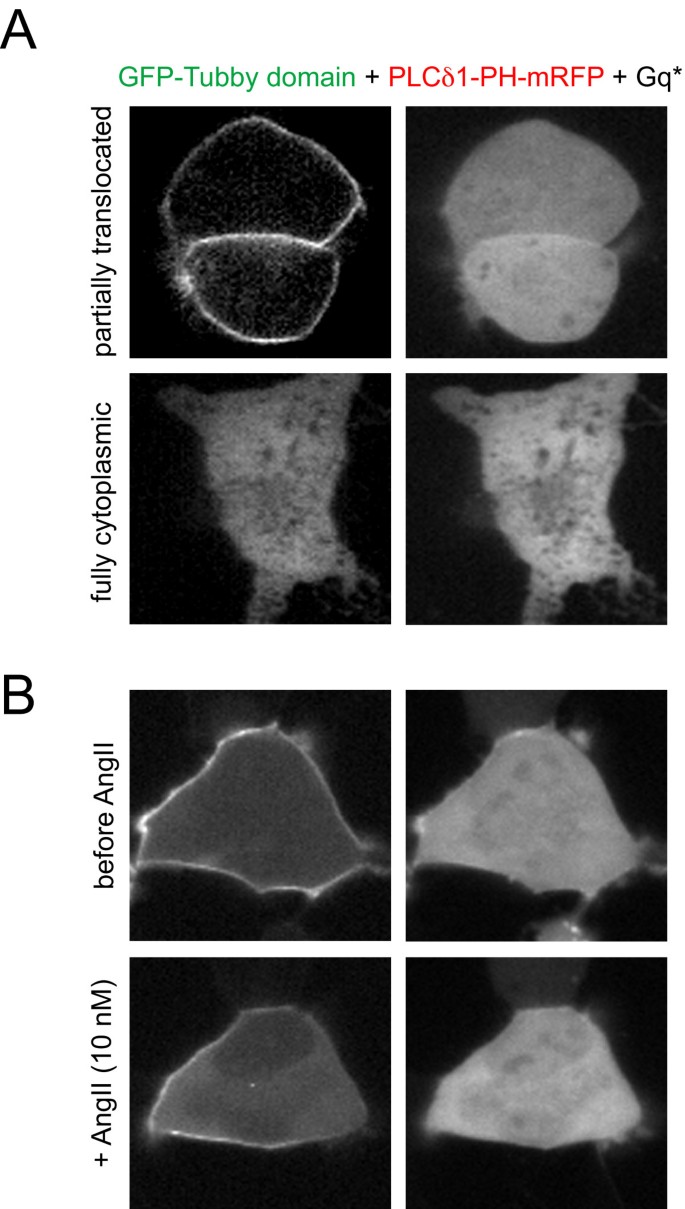
文献未提及具体实验产品,领域常规使用G蛋白偶联受体激动剂、离子霉素、质粒转染试剂。
3.4 PtdIns(4,5)P2去磷酸化后的探针响应测试
实验目的为评估Tubby结构域与PLCδ1PH在PtdIns(4,5)P2直接去磷酸化时的响应差异。研究在COS-7细胞中共转染PM靶向FRB-CFP、FKBP12-5-磷酸酶、GFP-Tubby和mRFP-PLCδ1PH,添加100 nM雷帕霉素招募5-磷酸酶至质膜,清除PtdIns(4,5)P2,观察探针移位的动力学变化。结果显示,雷帕霉素处理后,两者均快速且完全从膜移位至胞质,半最大移位时间分别为10.9±2.8秒(Tubby)和10.4±3.1秒(PLCδ1PH,n=10,无显著差异),提示在直接清除PtdIns(4,5)P2时,两者响应速率一致。
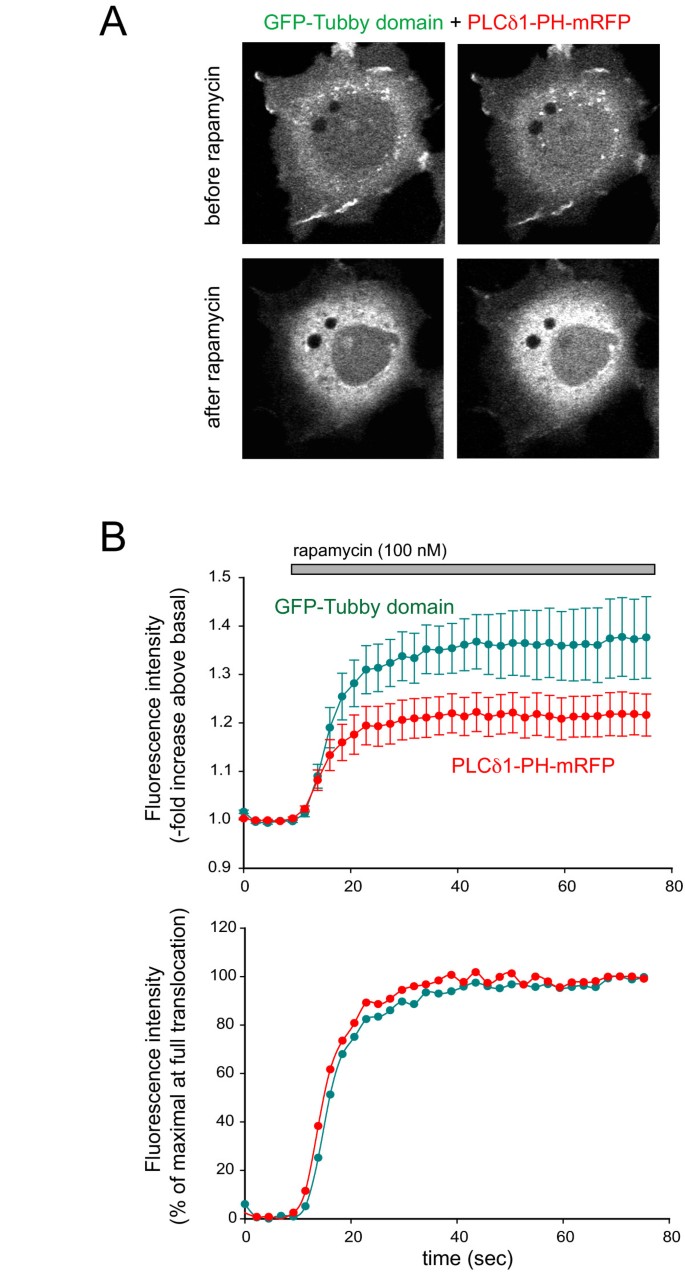
文献未提及具体实验产品,领域常规使用雷帕霉素诱导的蛋白-蛋白相互作用系统、共聚焦显微镜成像系统。
3.5 体外InsP3与PtdIns(4,5)P2结合实验
实验目的为验证Tubby结构域与PLCδ1PH对InsP3和PtdIns(4,5)P2的结合特异性差异。研究在大肠杆菌中表达重组GFP-Tubby和PLCδ1PH-GFP蛋白,采用[3H]-InsP3结合实验检测对可溶性InsP3的结合能力;通过脂质体结合实验,检测对PtdIns(4,5)P2脂质体的结合能力及InsP3的竞争结合效应。结果显示,PLCδ1PH-GFP能显著结合[3H]-InsP3,且可被未标记InsP3竞争抑制;而Tubby结构域几乎不结合[3H]-InsP3;两者对PtdIns(4,5)P2脂质体的结合能力相似,但InsP3无法竞争结合Tubby结构域,提示其仅特异性结合膜结合型PtdIns(4,5)P2,不结合可溶性InsP3。
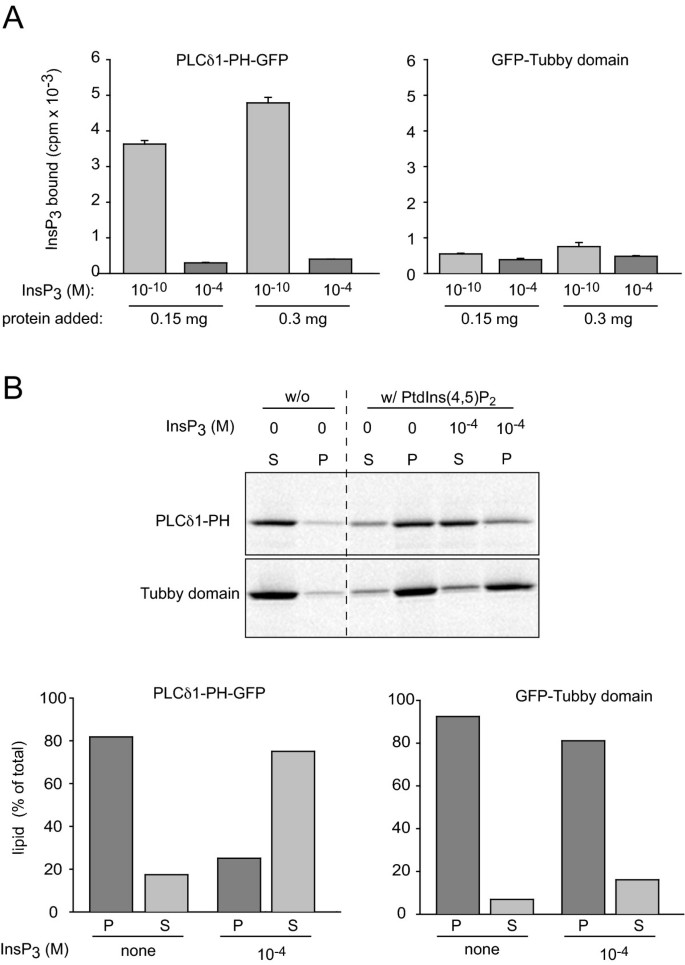
文献未提及具体实验产品,领域常规使用重组蛋白表达系统、放射性同位素标记试剂、脂质体制备试剂盒。
3.6 探针对Ca2+信号的影响评估
实验目的为分析Tubby结构域与PLCδ1PH过表达对细胞Ca2+信号的影响。研究将mRFP标记的Tubby、PLCδ1PH和p130PH(InsP3结合对照)转染至COS-7细胞,用Fura-2负载细胞,检测ATP刺激后的Ca2+响应;通过离子霉素处理释放探针,根据mRFP荧光强度分组评估表达水平对Ca2+信号的影响。结果显示,p130PH显著延迟并抑制Ca2+信号;PLCδ1PH和Tubby结构域仅在高表达水平时抑制Ca2+信号,其中PLCδ1PH对Ca2+上升的延迟略大于Tubby结构域,提示PLCδ1PH通过结合InsP3和PtdIns(4,5)P2双重作用影响Ca2+信号,而Tubby结构域仅通过结合PtdIns(4,5)P2发挥作用。
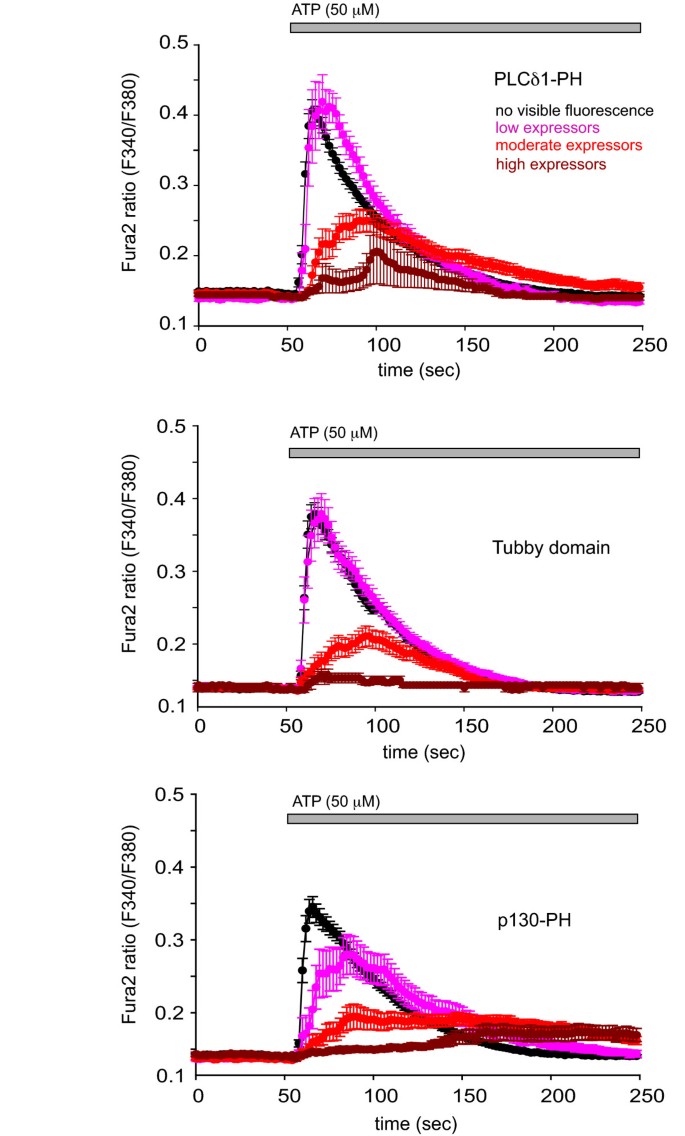
文献未提及具体实验产品,领域常规使用Ca2+荧光探针、荧光分光光度计、离子通道激动剂。
3.7 InsP3缓冲对探针移位的影响
实验目的为验证InsP3对Tubby结构域与PLCδ1PH移位的影响。研究将GFP-Tubby或GFP-PLCδ1PH与mRFP-p130PH共转染至HEK293-AT1细胞,添加100 nM AngII刺激,观察探针移位的动力学变化;用10 μM离子霉素处理确定最大移位幅度。结果显示,p130PH过表达对两者的移位响应影响较小,仅使响应幅度略降低、速率略减慢,提示在本实验体系中,InsP3主要通过影响Ca2+信号间接调控探针移位,而非直接竞争结合PLCδ1PH。
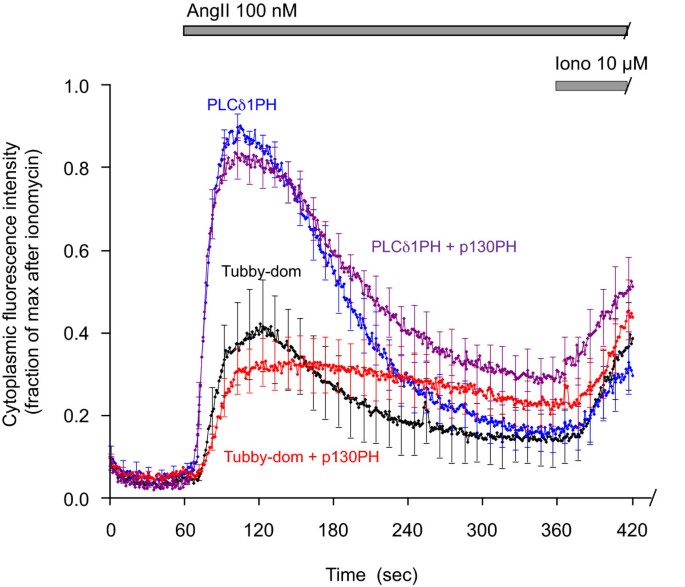
文献未提及具体实验产品,领域常规使用共聚焦显微镜成像系统、图像分析软件。
4. Biomarker研究及发现成果
本研究中涉及的Biomarker为识别PtdIns(4,5)P2的功能型成像探针,包括PLCδ1PH、多种酵母PH结构域和Tubby结构域,筛选逻辑遵循“体外结合特性→细胞定位分析→动态响应测试→功能影响评估”的多维度验证体系,确保探针的特异性、敏感性及功能兼容性。
Biomarker定位方面,PLCδ1PH是经典的PtdIns(4,5)P2探针,同时结合膜结合型PtdIns(4,5)P2和可溶性InsP3;酵母PH结构域中,Num1的体外PtdIns(4,5)P2结合特异性最高,但在哺乳动物细胞中存在表达缺陷,Slm1为PtdIns(4,5)P2和PtdIns4P的双特异性探针,其余酵母PH结构域无实用价值;Tubby结构域是特异性PtdIns(4,5)P2探针,仅结合膜结合型PtdIns(4,5)P2,不结合可溶性InsP3,且对质膜的结合亲和力更高。
研究过程详述显示,PLCδ1PH和Tubby结构域均通过细胞表达、动态响应、体外结合实验完成验证:PLCδ1PH在30 nM AngII刺激下的半最大移位时间为3.8±0.3秒(n=54),敏感性高,但因结合InsP3可能高估PtdIns(4,5)P2变化;Tubby结构域的半最大移位时间为6.7±0.3秒(n=54),敏感性较低,但特异性更高,体外结合实验证实其对InsP3无结合能力;酵母PH结构域中,Num1虽体外结合特异性高,但在哺乳动物细胞中表达水平低且诱导异常膜结构,不适合作为成像探针。
核心成果提炼显示,本研究明确了两种性能优异的PtdIns(4,5)P2成像探针:PLCδ1PH敏感性高,适合检测快速、小幅的PtdIns(4,5)P2变化,但需注意InsP3的干扰;Tubby结构域特异性高,适合准确检测PtdIns(4,5)P2的绝对水平,但因亲和力高,对小幅变化的响应较差。本研究的创新性在于首次系统对比了酵母和哺乳动物来源的PtdIns(4,5)P2结合结构域,为不同实验需求下的探针选择提供了直接实验依据;统计学结果显示,Tubby结构域与PLCδ1PH的质膜/胞质荧光强度比值、FRAP半恢复时间均存在显著差异(P<0.05或P<0.0001),验证了两者结合特性的差异,为探针性能的量化评估提供了数据支持。
