1. 领域背景与文献引入
文献英文标题:The Flot2 component of the lipid raft changes localization during neural differentiation of P19C6 cells;发表期刊:BMC Molecular and Cell Biology;影响因子:未公开;研究领域:神经分化与脂筏生物学
神经分化是中枢神经系统形成和功能维持的核心生物学过程,脂筏作为细胞膜上富含糖鞘脂和胆固醇的微结构域,参与信号转导、细胞黏附、神经突延伸及神经营养因子受体功能调控等关键事件,是神经发育领域的研究热点。领域发展关键节点可追溯至1997年Simons等提出的脂筏功能模型,后续研究逐渐揭示其在神经信号调控中的核心作用;当前研究热点聚焦于脂筏相关蛋白在神经分化中的调控机制、脂筏作为神经疾病治疗靶点的潜力等方向。目前未解决的核心问题在于,脂筏支架蛋白Flot2在神经分化中的具体定位变化及与Src家族激酶的相互作用机制尚未明确,现有研究多集中在PC12、SH-SY5Y等单一神经样细胞模型,缺乏P19C6这类多能胚胎癌细胞系中的系统分析。针对这一研究空白,本研究以P19C6细胞为模型,分析Flot2及Fyn在神经分化过程中的表达与定位变化,明确其相互作用关系,为揭示脂筏在神经分化中的调控机制提供实验依据。
2. 文献综述解析
作者按脂筏生物学基础、Flot家族蛋白功能、Src家族激酶在神经分化中的作用三个核心维度梳理现有研究,构建了清晰的评述逻辑。现有研究表明,脂筏通过结合酰化蛋白调控细胞内信号传导,Flot2作为脂筏支架蛋白,通过棕榈酰化和豆蔻酰化修饰定位于脂筏,参与内吞运输和细胞骨架调控,但其在神经分化中的具体功能尚未阐明;Src家族激酶Fyn参与神经分化启动和神经突延伸过程,其活性受Y528位点磷酸化调控,与脂筏的关联机制已有报道,但与Flot2的相互作用在神经分化中的研究仍存在不足。现有研究的局限性主要体现在:多使用单一神经样细胞模型,缺乏多能干细胞分化模型中的系统分析;对Flot2与Fyn的共定位及功能关联研究不够深入,未明确两者在神经分化中的协同调控机制。本研究的创新价值在于,首次以P19C6多能胚胎癌细胞系为模型,系统分析神经分化过程中Flot2和Fyn的表达、脂筏定位变化及共定位关系,填补了该细胞模型中脂筏相关研究的空白,明确了Flot2与Fyn在神经分化中的功能关联,为脂筏调控神经分化的机制提供新的实验证据。
3. 研究思路总结与详细解析
本研究的整体框架为:以明确Flot2及Fyn在P19C6细胞神经分化过程中的表达、脂筏定位变化及相互作用为研究目标,围绕“Flot2在神经分化中的脂筏定位变化是否与Fyn的激活及相互作用相关”这一核心科学问题,采用“细胞模型构建→蛋白表达检测→脂筏组分分离→共定位验证”的闭环技术路线展开实验。
3.1 P19C6细胞神经分化模型构建与验证
实验目的:构建P19C6细胞神经分化模型并验证分化效率。方法细节:将P19C6细胞以1×10^6个细胞的密度悬浮培养于含1μM全反式维甲酸的DMEM/DMEM/F12混合培养基中,5天后形成拟胚体,经胰酶消化后接种于聚-D-赖氨酸包被的培养皿,继续培养至第8天;通过免疫印迹检测干细胞标志物Oct-3和神经标志物微管相关蛋白2(MAP2)的表达,同时观察细胞形态变化。结果解读:免疫印迹结果显示,第0天(未分化)仅检测到Oct-3表达,第4-8天MAP2表达逐渐升高,第8天Flot2表达较第0天升高1.6倍(n=4,P<0.05);细胞形态观察显示分化后细胞出现典型的神经突延伸,证实神经分化模型构建成功。
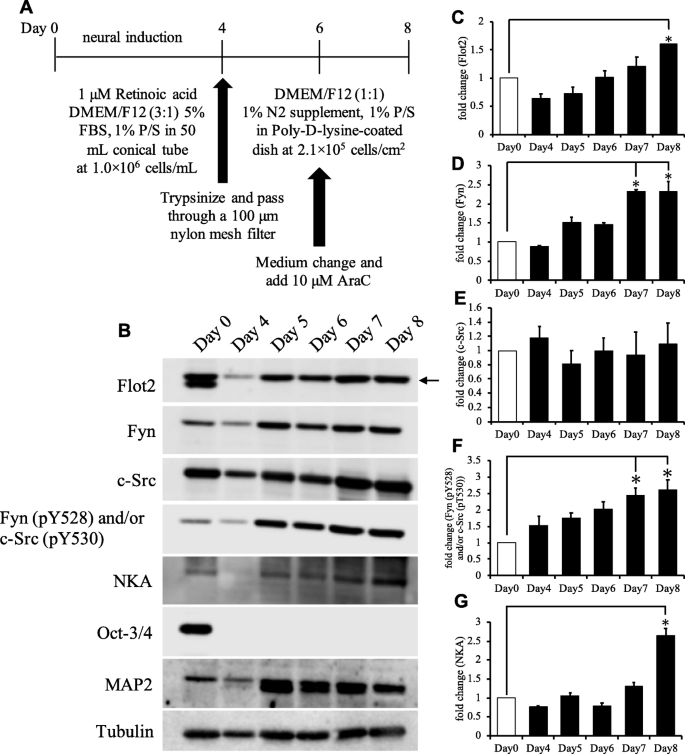
实验所用关键产品:全反式维甲酸(Sigma-Aldrich)、抗Oct-3抗体(Santa Cruz Biotechnology,sc-5279)、抗MAP2抗体(Sigma-Aldrich,M 9942)、抗Flot2抗体(BD Biosciences,610383)。
3.2 神经分化过程中Flot2、Fyn及c-Src的蛋白表达检测
实验目的:检测P19C6细胞神经分化过程中Flot2、Fyn、c-Src及磷酸化Fyn(pY528)/c-Src(pY530)的表达变化。方法细节:收集未分化(第0天)和分化后第4-8天的细胞,制备全细胞裂解液,采用免疫印迹法检测各蛋白表达水平,以α-微管蛋白为内参,进行灰度值定量分析。结果解读:Flot2表达随分化进程逐渐升高,第8天较第0天升高1.6倍(n=4,P<0.05);Fyn表达在第7-8天较第0天升高2.3倍(n=4,P<0.05);c-Src表达无显著变化;磷酸化Fyn(pY528)/c-Src(pY530)水平在第8天较第0天升高2.7倍(n=4,P<0.05);Na/K ATPase(NKA)表达第8天较第0天升高2.6倍(n=4,P<0.05),与前期研究结果一致。实验所用关键产品:抗Fyn抗体(Abcam,ab125016)、抗c-Src抗体(Cell Signaling Technology,#2109)、抗磷酸化Fyn(pY528)/c-Src(pY530)抗体(BD Biosciences,612668)、抗α-微管蛋白抗体(Thermo Fisher Scientific)。
3.3 脂筏组分分离与蛋白定位分析
实验目的:分析Flot2、Fyn、c-Src及磷酸化形式在脂筏(DRM组分)和非脂筏组分中的定位变化。方法细节:采用蔗糖密度梯度离心法分离未分化和分化后细胞的DRM组分(蔗糖浓度30%与5%界面的组分,即Frs4-6),通过甲基-β-环糊精(MβCD)处理验证脂筏组分特异性;采用免疫印迹法检测各组分中目标蛋白的表达,计算DRM组分中的回收率。结果解读:MβCD处理后,DRM组分中Flot2、Fyn、c-Src及磷酸化形式的表达显著降低,证实Frs4-6为特异性脂筏组分;分化后DRM组分中Flot2的回收率显著升高,Fyn在DRM组分中的回收率无显著变化,但磷酸化Fyn(pY528)/c-Src(pY530)在DRM组分中的回收率降低,非DRM组分中升高;c-Src在DRM组分中的回收率降低。提示分化后Flot2向脂筏富集,而失活形式的Fyn/c-Src从脂筏向非脂筏转移,推测DRM组分中活性形式Fyn的含量升高。
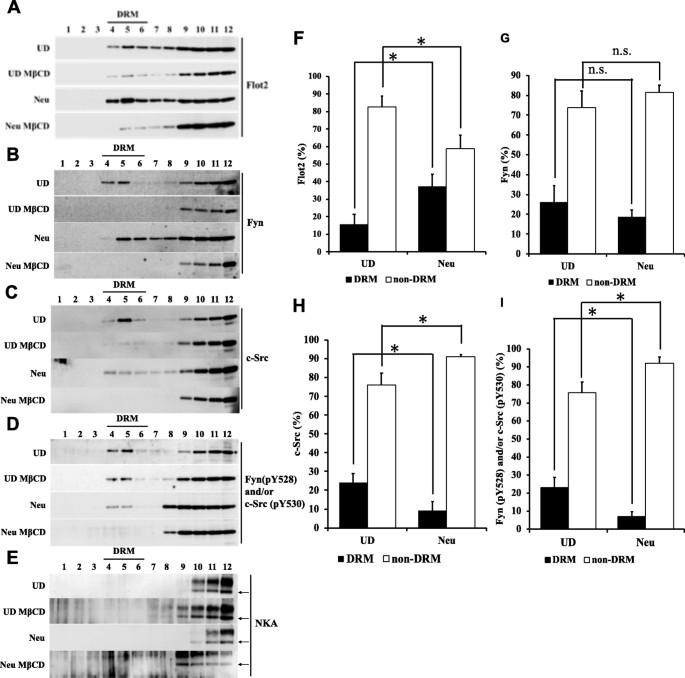
实验所用关键产品:甲基-β-环糊精(Sigma-Aldrich)、免疫印迹相关抗体同前。
3.4 Flot2与Fyn的免疫荧光共定位分析
实验目的:验证Flot2与Fyn在P19C6细胞神经分化过程中的共定位关系。方法细节:将未分化和分化后细胞用霍乱毒素B亚基(CTB,脂筏标志物)、抗Flot2抗体、抗Fyn抗体染色,通过激光共聚焦显微镜观察定位及共定位情况。结果解读:未分化细胞中Flot2主要定位于细胞膜附近,Fyn呈斑点状分布,两者部分共定位;分化后细胞中Flot2定位于神经突和胞体,与CTB标记的脂筏共定位,且Fyn与Flot2在神经突中部分共定位(箭头所示),证实分化后Flot2与Fyn在脂筏中的共定位增强。
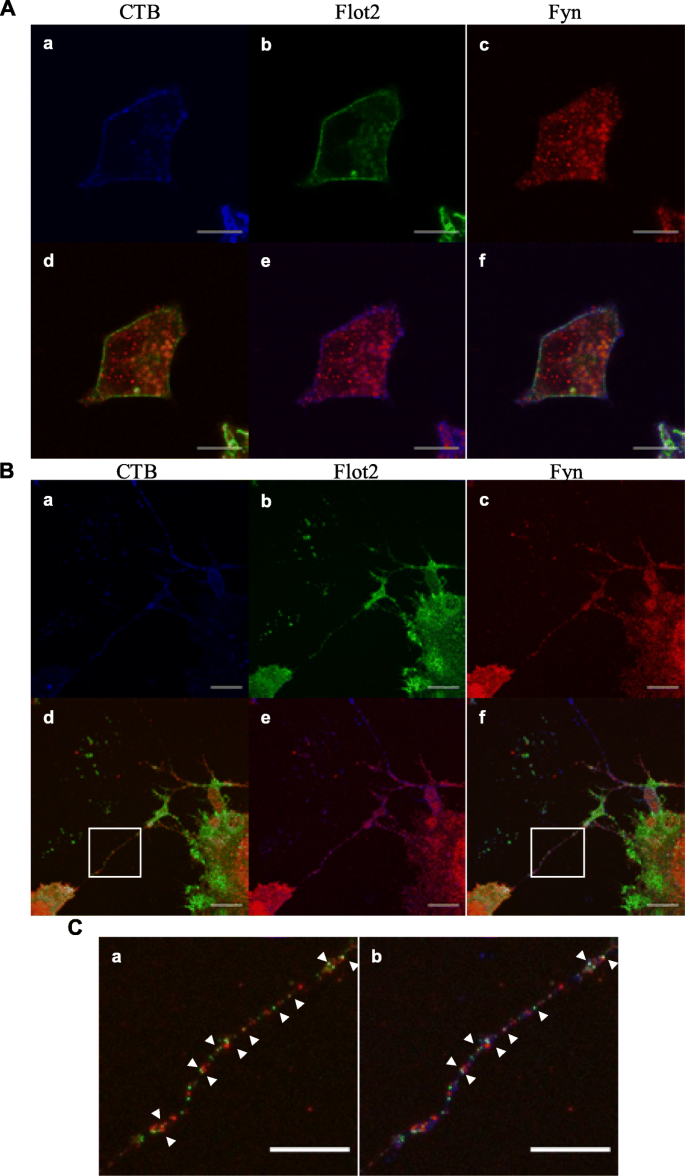
实验所用关键产品:Alexa Fluor 488标记的CTB(Thermo Fisher Scientific,C22841)、荧光二抗(Abcam,ab175660;Sigma-Aldrich,C2306)。
4. Biomarker研究及发现成果解析
本研究聚焦于神经分化过程中的功能Biomarker,涉及的Biomarker类型为脂筏支架蛋白Flot2和Src家族激酶Fyn,筛选与验证逻辑为:基于脂筏在神经分化中的已知作用,选择Flot2和Fyn作为研究对象,通过细胞模型验证→脂筏定位验证→共定位验证的完整逻辑链条分析其功能关联。
研究过程详述:Biomarker来源为P19C6细胞的全细胞裂解液及脂筏组分;验证方法包括免疫印迹定量检测表达水平、蔗糖密度梯度离心分析脂筏定位、免疫荧光共定位分析相互作用;特异性数据显示,分化后Flot2在DRM组分中的回收率显著升高(n=6,P<0.05),Fyn与Flot2在神经突中的共定位信号显著增强。
核心成果提炼:Flot2作为脂筏支架蛋白,在P19C6细胞神经分化过程中表达上调并向脂筏富集,与Fyn部分共定位;推测DRM组分中活性形式Fyn的含量升高,可能通过磷酸化Flot2参与神经分化过程中的细胞骨架重塑和内吞运输;该研究首次在P19C6细胞中揭示Flot2与Fyn的功能关联,为脂筏调控神经分化的机制提供新的实验依据,无临床样本相关的预后或诊断数据。
