1. 领域背景与文献引入
文献英文标题:Partial identification by site-directed mutagenesis of a cell growth inhibitory site on the human galectin-1 molecule;发表期刊:BMC Cell Biology;影响因子:未公开;研究领域:细胞生物学(半乳糖凝集素-1的结构与功能调控)
领域共识:半乳糖凝集素(galectins)是一类进化保守的β-半乳糖苷结合蛋白家族,最初被认为仅参与糖基化分子的结合与交联,后续研究证实其具备独立于糖结合功能的生物学活性,包括细胞生长调控、免疫调节及肿瘤转移调控等。该领域的关键发展节点可追溯至1991年,Wells等首次提出小鼠半乳糖凝集素-1同源物兼具糖结合能力与细胞生长抑制活性;1996年研究进一步发现,重组人半乳糖凝集素-1对细胞生长的调控呈双相性,且生长抑制活性可能独立于其β-半乳糖苷结合位点,但该生长抑制功能的具体结构位点尚未明确。当前研究热点聚焦于半乳糖凝集素-1在肿瘤微环境中的作用机制,以及如何分离其不同功能以开发靶向抗肿瘤试剂,未解决的核心问题包括生长抑制位点的精准定位、该位点与糖结合功能的分子独立性验证,以及突变体在肿瘤治疗中的应用潜力。
针对上述研究空白,本研究旨在通过定点突变技术,系统鉴定人半乳糖凝集素-1上独立于β-半乳糖苷结合位点的细胞生长抑制位点,明确其结构基础与功能独立性,为后续开发仅保留生长抑制功能的抗肿瘤候选分子提供实验依据,具有重要的学术价值与转化应用潜力。
2. 文献综述解析
作者对领域内现有研究的分类维度主要为研究结论(糖结合与生长抑制功能的关联性)和技术方法(重组蛋白表达系统、定点突变策略)。现有研究的关键结论显示,早期实验已证实半乳糖凝集素-1具备细胞生长抑制活性,且部分研究推测该活性与糖结合功能相互独立,但缺乏直接的结构证据;部分研究通过GST融合蛋白表达系统发现,大分子量的融合标签可能干扰生长抑制活性,但对糖结合功能无显著影响。现有技术方法的优势在于,GST融合蛋白系统可实现重组半乳糖凝集素-1的高效表达,但存在标签过大可能遮蔽蛋白功能位点的局限性;定点突变技术可精准修饰蛋白氨基酸位点,但部分突变体存在表达量低、溶解度差的问题,限制了功能验证的开展。
通过对比现有研究的未解决问题,本研究的创新价值凸显:首次采用ProEX系统表达带N端六聚组氨酸标签的重组半乳糖凝集素-1,该标签分子量更小且无需蛋白酶切割即可保留糖结合与生长抑制双功能,解决了GST标签干扰功能的问题;通过构建系列定点突变体,直接证实了生长抑制位点与糖结合位点的独立性,并首次定位了25-30位氨基酸环区为生长抑制位点的核心区域,填补了领域内对该功能位点结构认知的空白。
3. 研究思路总结与详细解析
本研究的整体框架为:以鉴定人半乳糖凝集素-1的细胞生长抑制位点为核心目标,围绕“生长抑制功能与糖结合功能是否独立”“生长抑制位点的具体结构区域”两大科学问题,采用“重组蛋白构建→定点突变→双功能验证→结构定位”的闭环技术路线,通过多维度实验明确了生长抑制位点的结构基础与功能独立性。
3.1 重组半乳糖凝集素-1的克隆、突变与表达
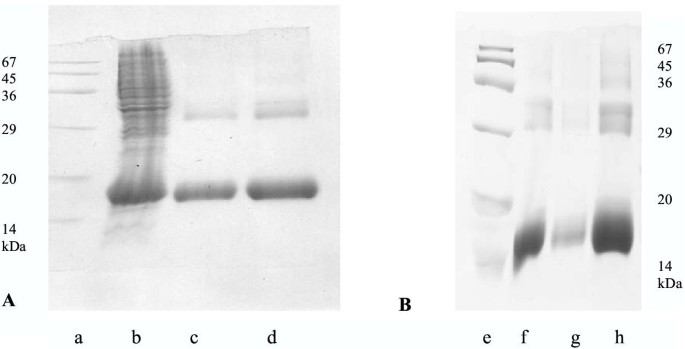
本环节的核心目标是构建可稳定保留双功能的重组半乳糖凝集素-1及系列突变体,为后续功能验证提供实验材料。实验方法上,研究人员从人成纤维细胞cDNA中扩增半乳糖凝集素-1基因,克隆至ProEX HTb载体以表达带N端六聚组氨酸标签的重组蛋白;通过重叠延伸PCR技术引入定点突变,构建系列氨基酸替换突变体;将重组质粒转化至大肠杆菌DH5α,经IPTG诱导表达后,采用Ni-NDA亲和层析纯化蛋白,部分突变体(如M1R)进一步经凝血酶切割去除N端标签。
SDS-PAGE分析结果显示,野生型六聚组氨酸-半乳糖凝集素-1的分子量约为16 kDa,部分样本中存在约32 kDa的二聚体条带,与此前GST融合蛋白的实验结果一致;部分突变体(如R49G、D47N)的可溶性蛋白表达量较低,且易在表达后形成沉淀;野生型蛋白无需切割即可保留完整的血凝活性(终点滴度为1 μg/ml)和细胞生长抑制活性(50%生长抑制浓度I₅₀=5 μg/ml),活性显著优于此前的GST融合蛋白系统。实验所用关键产品:ProEX表达系统、Ni-NDA-琼脂糖亲和层析柱,分子生物学试剂购自Gibco-BRL,其他常规试剂购自Sigma。
3.2 突变体的糖结合活性验证
本环节的核心目标是验证突变体的β-半乳糖苷结合功能,明确糖结合位点与生长抑制位点的独立性。实验方法上,采用胰酶处理的兔红细胞进行血凝实验,通过系列三倍稀释确定血凝终点;对血凝活性降低的突变体,先以250 μg/ml的浓度预处理红细胞,再用野生型蛋白进行血凝实验,以区分是糖结合能力缺失还是红细胞交联能力缺失;同时通过Sephadex G-50凝胶过滤层析分析突变体的二聚化状态。
结果显示,P79R和C131S突变体的血凝活性显著降低,但预处理红细胞后不影响野生型蛋白的血凝活性,说明该突变体的糖结合位点被破坏,而非二聚化能力受损;凝胶过滤层析结果显示,P79R突变体仍以二聚体形式存在,进一步证实糖结合功能与二聚化功能相互独立;野生型及K29M、K29T等突变体则保留了正常的血凝活性,说明其糖结合位点未受影响。

3.3 突变体的细胞生长抑制活性验证
本环节的核心目标是检测突变体的细胞生长抑制功能,定位生长抑制位点的关键氨基酸区域。实验方法上,采用WI 38或GM 1604A人二倍体成纤维细胞进行微孔板增殖实验,通过ELISA分光光度计检测固定染色细胞的吸光度,计算50%生长抑制浓度(I₅₀);分析不同位点突变对生长抑制活性的影响,关联结构与功能的关系。
结果显示,P79R突变体完全保留了与野生型相当的细胞生长抑制活性,但糖结合活性几乎丧失,直接证实了生长抑制功能与糖结合功能的独立性;K29M、K29T、M1R突变体完全丧失生长抑制活性,但仍保留正常的血凝活性;D27N突变体的生长抑制活性显著降低;A28R突变体的糖结合与生长抑制活性均明显降低,提示25-30位氨基酸环区为生长抑制位点的核心部分;M1R突变体经凝血酶切割去除N端标签后,恢复了部分生长抑制活性,说明N端区域对生长抑制功能的发挥具有重要作用。
3.4 生长抑制位点的结构定位
本环节的核心目标是结合蛋白三维结构模型,明确生长抑制位点的空间位置。实验方法上,基于Bourne等提出的半乳糖凝集素-1三维结构模型,分析已鉴定的关键突变位点的空间分布,定位生长抑制相关的结构区域。
结果显示,生长抑制位点(模型中阴影区域c)位于蛋白N端附近的25-30位氨基酸环区,该区域连接两个内部β链,与β-半乳糖苷结合位点(区域a)、二聚化界面(区域b)在空间上相互独立;N端区域与该环区的距离约为8-10埃,因此N端的修饰或突变会影响生长抑制功能的发挥。

4. Biomarker研究及发现成果
本研究中涉及的Biomarker为人半乳糖凝集素-1的细胞生长抑制结构域,属于蛋白功能结构域类Biomarker,其筛选与验证逻辑为:通过定点突变构建系列氨基酸替换突变体,分别验证突变体的糖结合活性与生长抑制活性,筛选出仅影响单一功能的突变体,进而定位与生长抑制功能直接相关的结构区域。
该Biomarker的来源为人半乳糖凝集素-1蛋白,验证方法包括定点突变技术、红细胞血凝实验、人二倍体成纤维细胞增殖实验;特异性表现为25-30位氨基酸环区的突变仅影响细胞生长抑制功能,而不影响β-半乳糖苷结合功能,如K29M突变体完全丧失生长抑制活性,但血凝活性与野生型无显著差异;敏感性方面,野生型半乳糖凝集素-1的50%生长抑制浓度为5 μg/ml(n=3,文献未明确P值),关键位点突变后活性变化显著,可通过细胞增殖实验精准检测。
核心成果方面,本研究首次鉴定了人半乳糖凝集素-1上独立于糖结合位点的细胞生长抑制位点,明确25-30位氨基酸环区及N端区域为该位点的关键部分;该发现的创新性在于,首次将半乳糖凝集素-1的糖结合功能与生长抑制功能在结构层面分离,为开发仅保留生长抑制功能的抗肿瘤候选分子提供了基础,如P79R突变体可作为潜在的抗肿瘤试剂,其无天然半乳糖凝集素-1的促有丝分裂活性,且不会与细胞外基质中的半乳糖苷发生非特异性结合;此外,该突变体还可用于鉴定生长抑制功能的细胞表面受体,为后续机制研究提供工具。目前研究尚未涉及临床样本验证,后续可通过肿瘤细胞转染、异种移植动物模型进一步验证其抗肿瘤效果。
