1. 领域背景与文献引入
文献英文标题:Trapping of normal EB1 ligands in aggresomes formed by an EB1 deletion mutant;发表期刊:BMC Cell Biology;影响因子:未明确;研究领域:细胞生物学(微管相关蛋白功能与聚集体形成机制)
EB1(End-Binding Protein 1)是一类高度保守的微管正端结合蛋白(+TIP),通过N端钙调蛋白同源(CH)结构域直接结合微管,C端结构域则与腺瘤性息肉病 coli(APC)肿瘤抑制蛋白、动力蛋白激活复合物(dynactin)的p150glued亚基相互作用,参与微管稳定性调节、细胞极性建立及染色体分离等过程。聚集体(aggresome)是细胞应对错误折叠蛋白的重要防御机制:当错误折叠蛋白的产生速率超过蛋白酶体的降解能力时,蛋白会通过微管和动力蛋白(dynein)运输至中心体周围,形成以泛素化蛋白、蛋白酶体组分为核心的核周聚集体。
现有研究已明确EB1的结构功能及aggresome的形成条件,但仍存在关键空白:(1)aggresome的动态结构是否为简单的“聚集体的聚集体”?(2)部分错误折叠蛋白(保留部分功能域)是否会捕获正常生理配体并导致其共聚集?本研究以EB1的N端缺失突变体(EB1-ΔN2-GFP,缺失CH结构域、无法结合微管但保留与APC/p150glued的相互作用)为模型,系统解析其形成的聚集体的性质、动态及对正常配体的捕获,为错误折叠蛋白的病理机制提供新视角。
2. 文献综述解析
作者的综述逻辑围绕“EB1结构功能→aggresome形成机制→现有研究局限”展开:
- EB1的结构与功能:EB1的N端CH结构域是微管结合的关键,C端则介导与APC、p150glued的相互作用;缺失N端的EB1突变体(如EB1-ΔN2-GFP)虽不能结合微管,但仍能与配体相互作用。
- aggresome的研究现状:aggresome由错误折叠蛋白聚集形成,依赖微管和dynein/dynactin运输,特征包括泛素化、蛋白酶体组分富集、vimentin骨架重构;但现有研究多关注aggresome的形成条件,对其动态结构及是否捕获正常蛋白缺乏深入探讨。
- 现有研究的局限:此前对aggresome的认知停留在“被动聚集”,未揭示错误折叠蛋白如何通过保留的功能域主动捕获正常配体;同时,aggresome的动态行为(如是否具有内在凝聚力)仍不明确。
本研究的创新点:(1)利用EB1-ΔN2-GFP模型,首次展示部分错误折叠蛋白可保留配体结合能力,导致正常蛋白被捕获至aggresome;(2)通过活细胞成像揭示aggresome具有动态延伸/回缩的能力,并非简单的静态聚集体;(3)发现共聚集的p150glued发生降解,提示错误折叠蛋白可能通过捕获正常蛋白导致功能丧失。
3. 研究思路总结与详细解析
整体框架:以EB1-ΔN2-GFP为模型,通过“活细胞成像(动态)→免疫染色(分子特征)→生化分析(溶解性与修饰)”的闭环,明确聚集体的性质及对正常配体的捕获。
3.1 活细胞成像解析聚集体的动态与微管依赖性
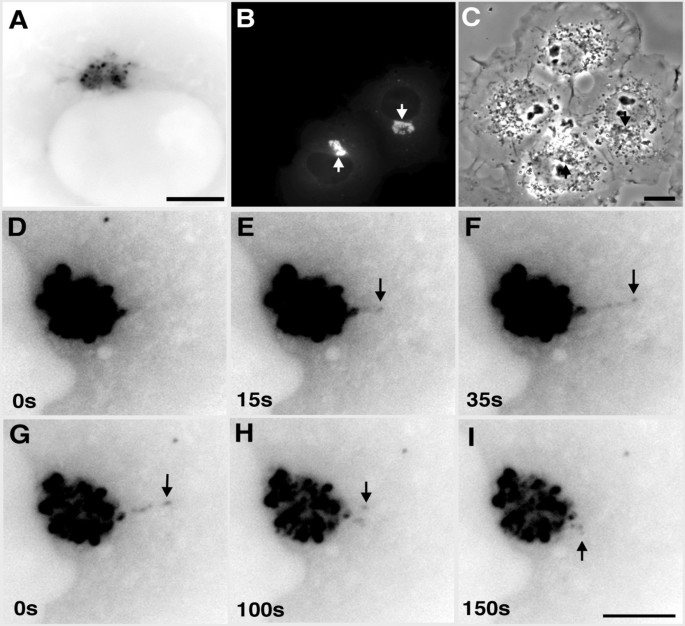
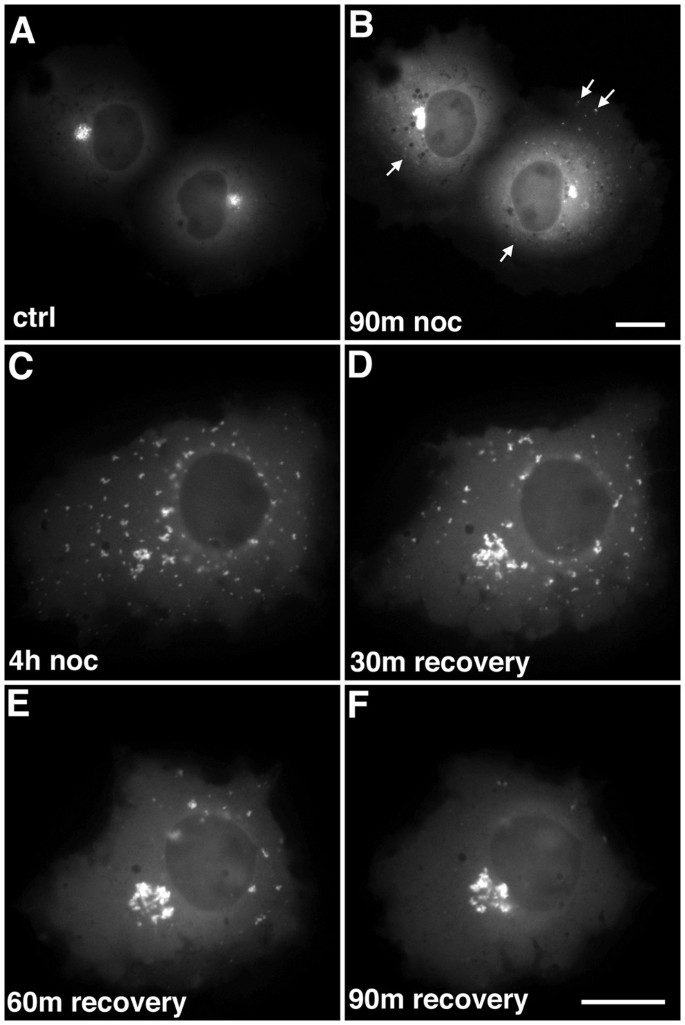
实验目的:明确EB1-ΔN2-GFP聚集体的形态、动态变化及对微管的依赖程度。
方法细节:将EB1-ΔN2-GFP质粒转染COS-7细胞(转染试剂GeneJuice),14-18h后用Zeiss Axiovert 200显微镜进行时间 lapse荧光成像(63X油镜/40X干镜,帧速率1帧/5s-10s);通过nocodazole(5μg/ml,90min)处理解聚微管,观察聚集体的运动变化;洗去nocodazole后,记录聚集体的重新聚集过程。
结果解读:EB1-ΔN2-GFP聚集体由亮荧光 puncta(高蛋白浓度区)和低荧光基质组成,呈核周分布;聚集体具有动态延伸/回缩能力(延伸速度0.14μm/s、回缩速度0.1μm/s),且延伸结构始终与主聚集体相连(提示内在凝聚力);nocodazole处理后,聚集体分散为胞质小颗粒且完全不动;洗去药物后,小颗粒沿微管逆向运输至核周重新聚集(平均速度0.1μm/s),证实聚集体的形成与维持依赖微管。
实验所用关键产品:GeneJuice转染试剂(Novagen)、nocodazole(Sigma)、Zeiss Axiovert 200显微镜。
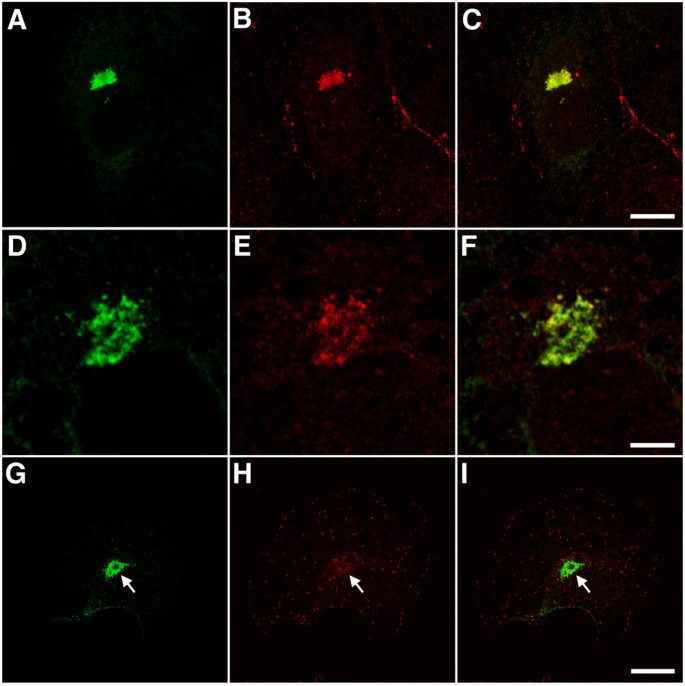
3.2 免疫荧光验证聚集体的aggresome分子特征
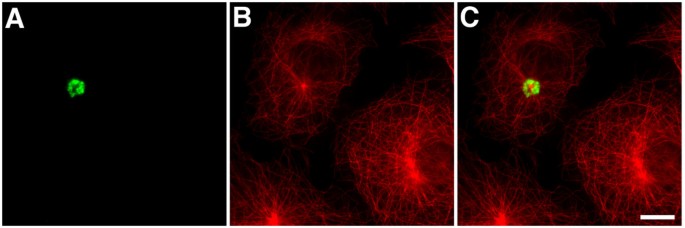
实验目的:确定EB1-ΔN2-GFP聚集体是否符合aggresome的经典分子标志。
方法细节:转染细胞用甲醇固定后,用GFP抗体(标记聚集体)分别与α-tubulin(微管)、γ-tubulin(中心体)、20S蛋白酶体亚基、泛素、vimentin抗体共染色,通过Leica TCS-SP共聚焦显微镜观察。
结果解读:聚集体围绕中心体形成(与γ-tubulin共定位);阳性染色20S蛋白酶体和泛素(aggresome的核心标志);诱导vimentin中间丝骨架 collapse(aggresome的另一特征);但不包含ER伴侣蛋白BiP/GRP78(排除ER来源的聚集体)。上述结果证实,EB1-ΔN2-GFP聚集体是典型的aggresome。
实验所用关键产品:Alexa 488/594共轭二抗(Molecular Probes)、Leica TCS-SP共聚焦显微镜。
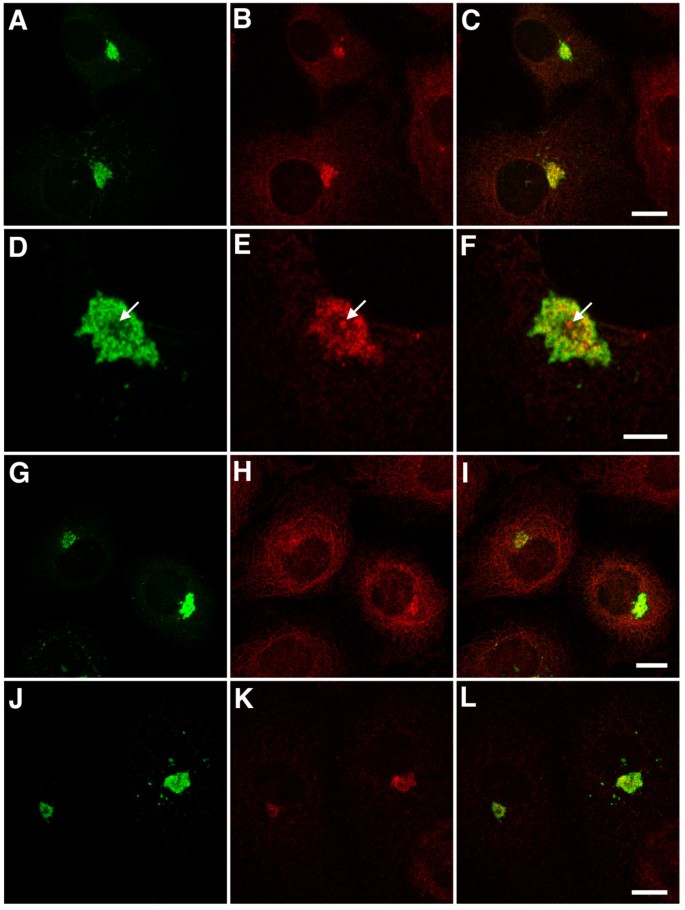
3.3 免疫荧光检测正常EB1配体的共聚集
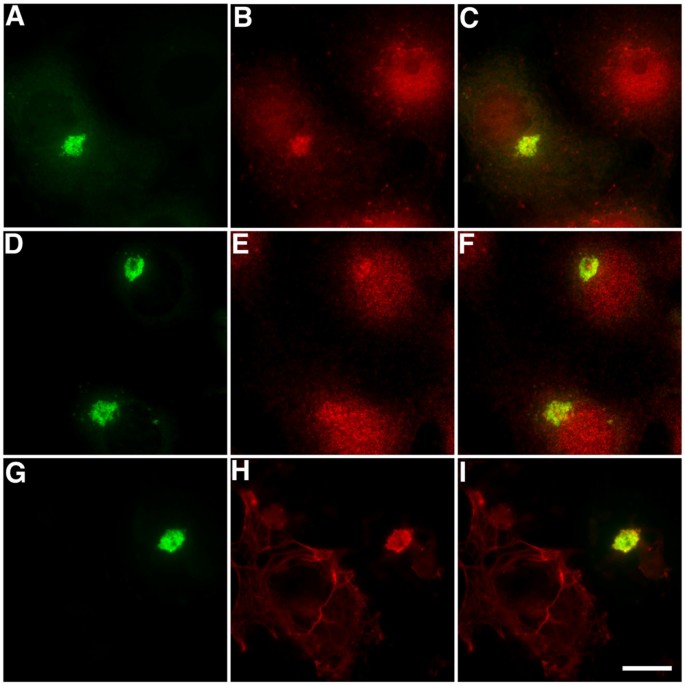
实验目的:明确APC、p150glued等正常EB1配体是否被捕获至aggresome。
方法细节:转染细胞固定后,用GFP抗体分别与APC、p150glued、CDIC(动力蛋白中间链)、p50dynamitin(dynactin亚基)、EB3(EB1家族成员)抗体共染色,共聚焦显微镜观察。
结果解读:APC和p150glued与GFP高度共定位(存在于aggresome中),但染色异质(可能因aggresome内部致密结构影响抗体穿透);CDIC和p50dynamitin也在aggresome中检测到,但信号较弱;EB3(与EB1同源但不结合EB1-ΔN2-GFP)未被捕获,说明配体结合具有特异性(依赖EB1的C端相互作用域)。
实验所用关键产品:APC抗体(Dr Inke Nathke馈赠)、p150glued抗体(Transduction Laboratories)。
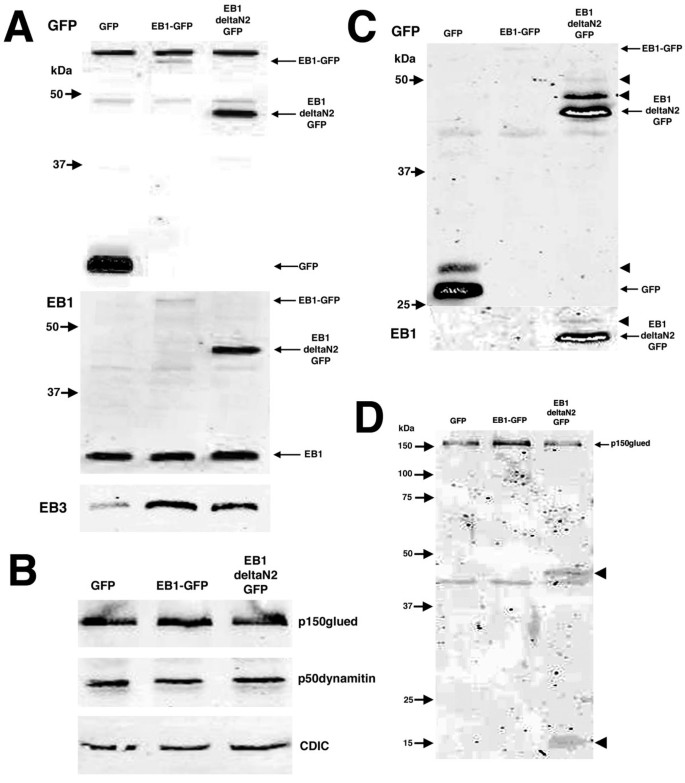
3.4 细胞分级分离与WB分析聚集体的生化特征
实验目的:解析EB1-ΔN2-GFP聚集体的溶解性、泛素化修饰及对p150glued的影响。
方法细节:转染细胞(18h后)用0.1% Triton X-100裂解,离心分离可溶性(上清)与不溶性(沉淀)组分;SDS-PAGE分离后,WB检测GFP(聚集体)、EB1、p150glued的表达及修饰(GFP抗体、EB1抗体、p150glued抗体)。
结果解读:EB1-ΔN2-GFP主要存在于不溶性组分(aggresome的典型特征),且出现更高分子量条带(提示泛素化修饰);p150glued在不溶性组分中存在,但EB1-ΔN2-GFP转染组出现两个低分子量片段(提示p150glued降解);EB3和p50dynamitin未在不溶性组分中检测到。
实验所用关键产品:GFP抗体(Clontech)、Li-Cor Odyssey定量WB系统。
4. Biomarker研究及发现成果解析
本研究虽未聚焦传统疾病Biomarker,但鉴定了“错误折叠蛋白诱导的正常配体共聚集标志物”(aggresome中的APC与p150glued),为研究蛋白错误折叠的病理机制提供了新的功能标志物。
Biomarker定位与筛选逻辑
- 类型:功能标志物(反映错误折叠蛋白对正常蛋白的捕获);
- 筛选逻辑:先通过免疫荧光共定位筛选(细胞水平),再通过细胞分级分离+WB验证(生化水平);
- 来源:转染EB1-ΔN2-GFP的COS-7细胞的核周aggresome。
验证方法与结果
- 验证方法:免疫荧光共聚焦显微镜(定性共定位)、细胞分级分离+WB(定量溶解性与修饰);
- 特异性与敏感性:APC与p150glued在aggresome中的阳性率接近100%(与GFP共定位),但信号异质(因aggresome密度影响抗体穿透);
- 核心成果:
- 功能关联:错误折叠的EB1-ΔN2-GFP通过保留的C端结构域捕获APC与p150glued,导致其共聚集至aggresome;
- 病理意义:p150glued在aggresome中发生降解,提示共聚集可能导致正常蛋白功能丧失;
- 创新性:首次证明部分错误折叠蛋白可主动捕获正常配体,而非被动聚集。
局限性
文献未提供具体的定量统计(如共定位系数、条带灰度值),但通过多次重复实验(n≥3)确认结果的重复性。
综上,本研究通过EB1-ΔN2-GFP模型,揭示了aggresome的动态结构及错误折叠蛋白对正常配体的捕获机制,为神经退行性疾病(如帕金森病)中错误折叠蛋白的病理作用提供了新的理论依据。
