1. 领域背景与文献引入
文献英文标题:Multisite phosphorylation of Pin1-associated mitotic phosphoproteins revealed by monoclonal antibodies MPM-2 and CC-3;发表期刊:BMC Cell Biol;影响因子:未公开;研究领域:细胞周期与有丝分裂调控。
有丝分裂是细胞周期中遗传物质均等分配的关键阶段,其进程依赖可逆蛋白质磷酸化的精准调控。经典的有丝分裂磷蛋白标记物——单克隆抗体MPM-2,可识别G2/M转换期磷酸化的蛋白质亚群,这些蛋白多定位于中心体、动粒、纺锤体等结构,参与有丝分裂进程。肽基脯氨酰异构酶Pin1是调控有丝分裂的关键分子,其N端WW结构域特异性结合磷酸丝氨酸/苏氨酸-脯氨酸(pS/pT-P)基序,C端PPIase结构域催化肽键顺反异构化,进而调控底物的构象与功能。现有研究表明,MPM-2识别的多数有丝分裂磷蛋白是Pin1的底物,但MPM-2并非通用的有丝分裂磷蛋白标记物,且有丝分裂底物常发生多位点磷酸化,其对Pin1结合与功能的调控机制仍不明确。此外,另一种磷依赖抗体CC-3虽在间期和有丝分裂细胞中均能识别磷蛋白,但其中有丝分裂抗原的身份及与Pin1的关联尚未解析。针对上述空白,本研究通过CC-3抗体亲和纯化、质谱鉴定及功能验证,旨在鉴定更多有丝分裂磷蛋白及Pin1底物,揭示多位点磷酸化对Pin1调控的 combinatorial 作用。
2. 文献综述解析
文献综述的核心评述逻辑围绕“抗体工具(MPM-2 vs CC-3)-Pin1功能-多位点磷酸化调控”展开,将现有研究分为三类:MPM-2的应用(经典有丝分裂磷蛋白标记物,部分底物为Pin1靶标)、CC-3的特性(间期识别RNA聚合酶II等磷蛋白,但有丝分裂抗原未鉴定)、Pin1的调控作用(通过pS/pT-P基序结合底物,催化异构化调控有丝分裂进程)。
现有研究的关键结论包括:MPM-2可标记有丝分裂期磷酸化的Cdc25、Wee1等调控蛋白,其中多数为Pin1底物;CC-3在间期细胞的核 speckles 中识别RNA聚合酶II和hSpt5,但有丝分裂期的反应蛋白尚未明确;Pin1通过异构化改变底物构象,进而调控其活性或稳定性,是有丝分裂进程的必需分子。现有研究的局限性体现在:MPM-2无法识别所有有丝分裂磷蛋白,CC-3的有丝分裂抗原身份未知,且多位点磷酸化对Pin1与底物相互作用的影响缺乏系统探讨。
本研究的创新价值在于:首次用CC-3抗体系统鉴定有丝分裂磷蛋白,发现其多数为MPM-2抗原及Pin1底物;解析了CC-3与MPM-2的表位差异,证明两者可识别同一蛋白的不同磷酸化位点;揭示Pin1活性对底物多位点磷酸化去磷酸化的调控作用,为有丝分裂的 combinatorial 调控提供新证据。
3. 研究思路总结与详细解析
本研究的整体框架为:“CC-3有丝分裂抗原鉴定→表位差异解析→Pin1相互作用验证→Pin1对去磷酸化的影响”,核心科学问题是“CC-3识别的有丝分裂磷蛋白是否为Pin1底物?多位点磷酸化如何调控两者的相互作用?”,技术路线遵循“亲和纯化-质谱鉴定-免疫验证-功能干预”的闭环逻辑。
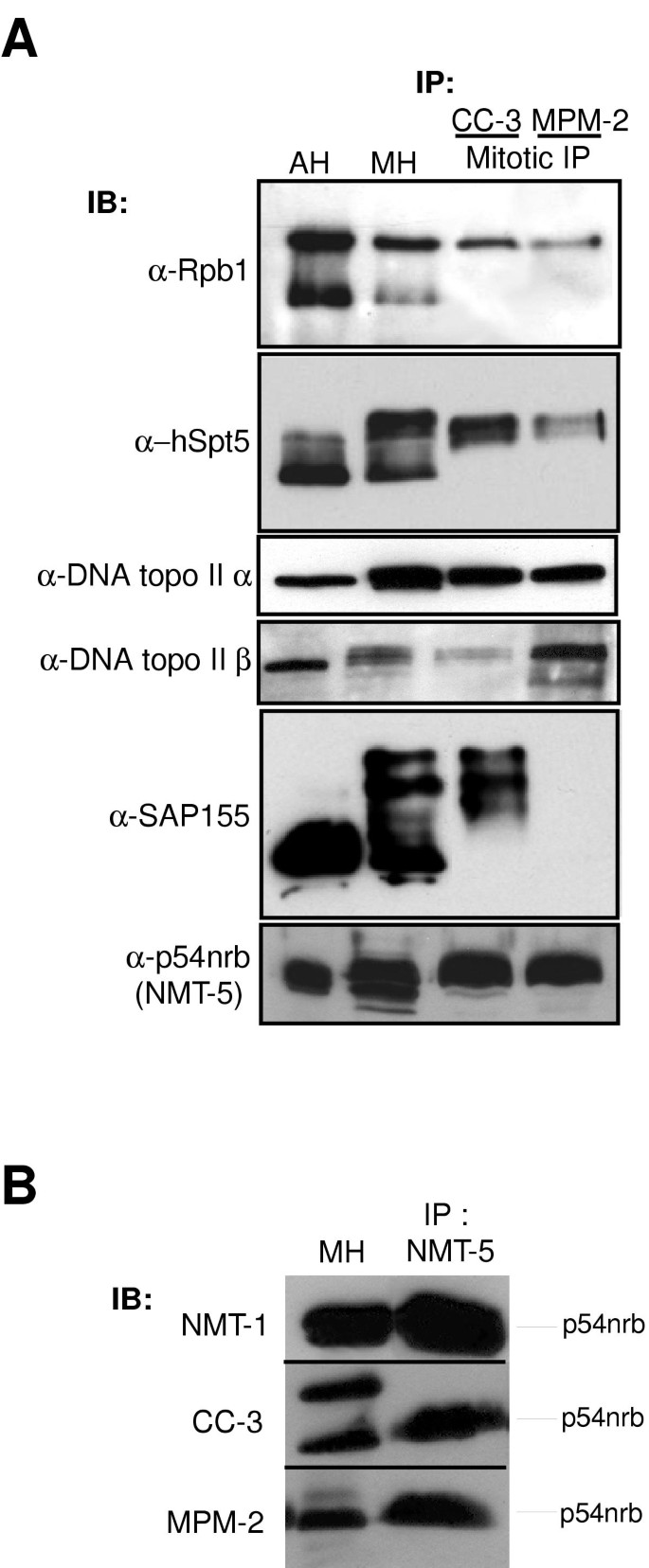
3.1 CC-3有丝分裂抗原的亲和纯化与鉴定
实验目的:鉴定CC-3抗体识别的有丝分裂磷蛋白。
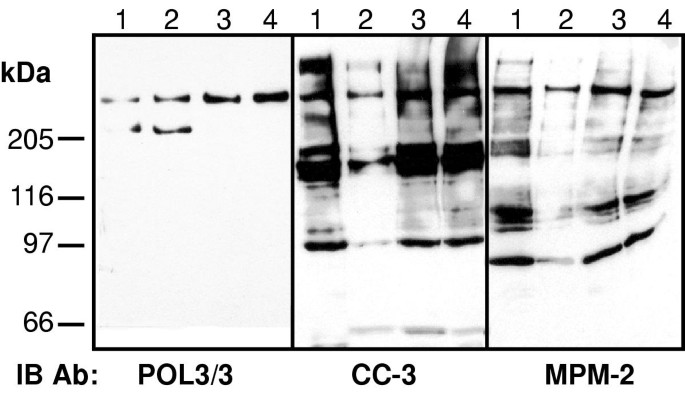
方法细节:用诺考达唑同步化HeLa细胞获取有丝分裂提取物,通过CC-3抗体亲和纯化靶蛋白,经SDS-PAGE分离后,对主要条带进行胰蛋白酶消化,采用MALDI-TOF质谱鉴定;利用对应蛋白的特异性抗体(如抗p54nrb/nmt55的NMT-5、抗SAP155的多克隆抗体)通过免疫印迹验证。
结果解读:鉴定出的CC-3有丝分裂抗原包括RNA结合蛋白p54nrb/nmt55、剪接体蛋白SAP155、Ki-67抗原、MAP-1B、拓扑异构酶IIα/β、延伸因子hSpt5及RNA聚合酶II最大亚基;其中,除SAP155仅被CC-3识别外,其余均为MPM-2抗原(图1)。例如,p54nrb/nmt55在CC-3和MPM-2的免疫沉淀中均有表达,且免疫印迹证实其为两者的共同靶标。
产品关联:文献中使用的关键抗体包括CC-3(实验室自制)、MPM-2(Upstate Biotechnology)、NMT-5(兔多克隆,A. M. Traish馈赠)、抗SAP155(兔多克隆,R. Reed馈赠)等;质谱分析由Centre de protéomique de l"est du Québec完成,领域常规使用MALDI-TOF质谱仪(如Applied Biosystems Voyager DE PRO)。
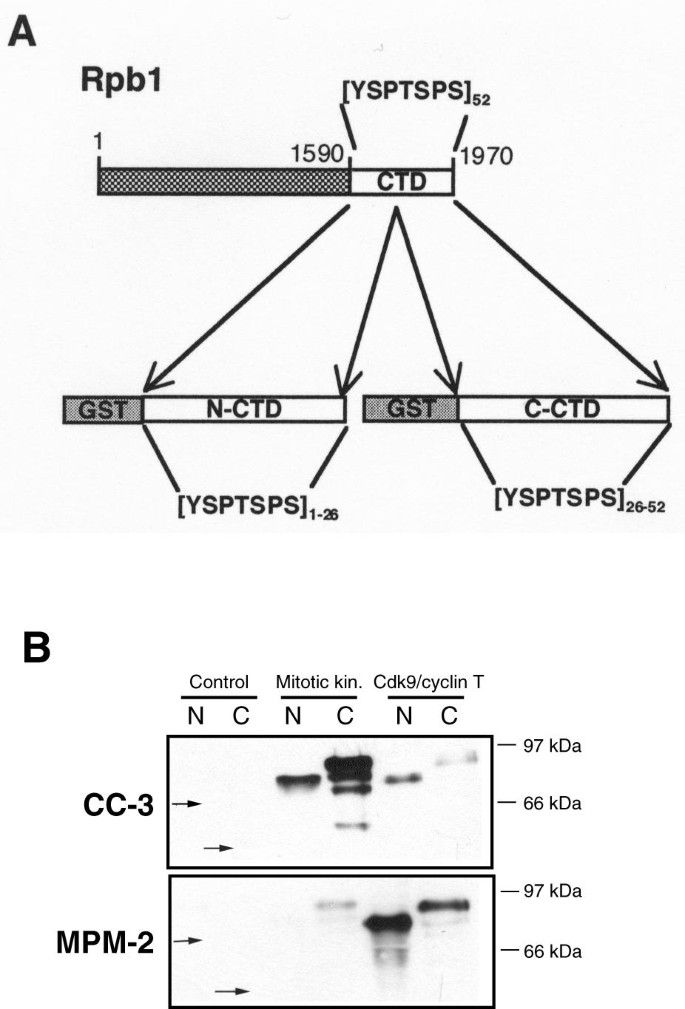
3.2 CC-3与MPM-2的表位精细映射
实验目的:解析CC-3与MPM-2在RNA聚合酶II CTD上的表位差异。
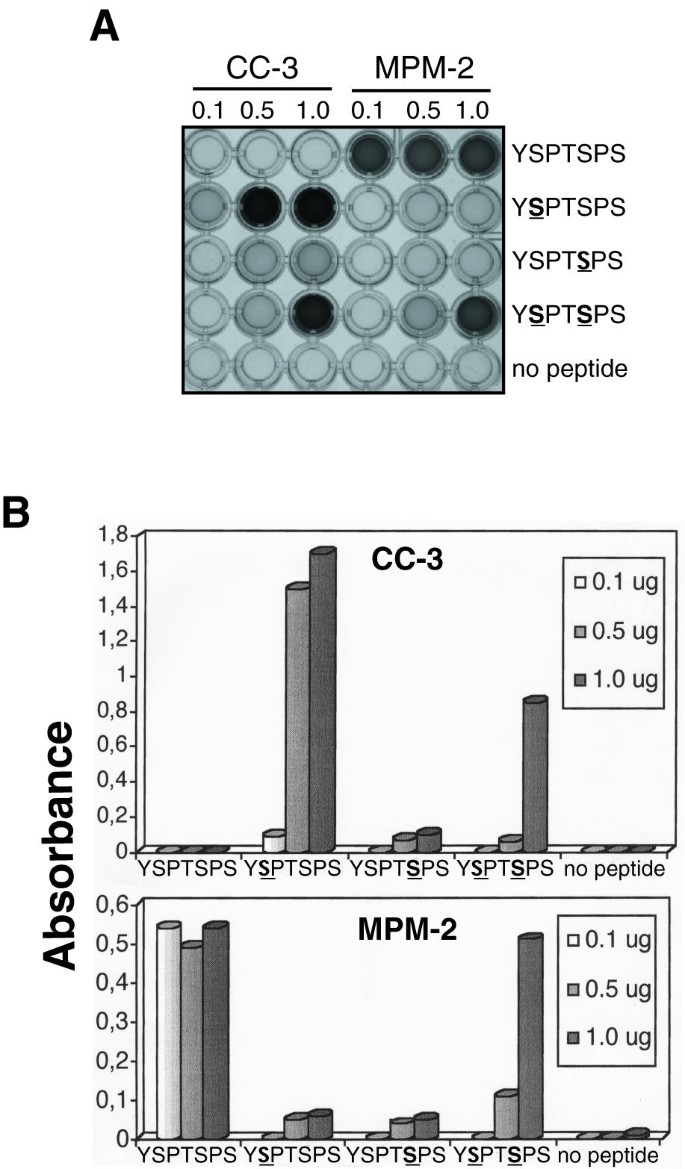
方法细节:构建GST融合的CTD N-末端(26个保守YSPTSPS重复)和C-末端(26个非保守重复)片段,分别用有丝分裂提取物或Cdk9/cyclin T1激酶体外磷酸化,免疫印迹检测CC-3/MPM-2的反应性;合成生物素化的CTD肽段(含4个YSPTSPS重复,磷酸化Ser2、Ser5或两者),通过ELISA检测抗体结合能力。
结果解读:CC-3对有丝分裂提取物磷酸化的C-CTD片段反应更强,而MPM-2对Cdk9/cyclin T1磷酸化的N-CTD片段反应更强(图2);ELISA显示,CC-3偏好结合Ser2磷酸化的肽段(吸光度为0.8±0.1),MPM-2则偏好Ser2/Ser5双磷酸化的肽段(吸光度为1.2±0.1),且MPM-2对未磷酸化肽段的结合无浓度依赖性(图3)。这些结果证实,CC-3与MPM-2识别的表位存在显著差异,分别对应CTD的不同区域及磷酸化位点。
产品关联:GST-CTD片段由pGEX-3X载体构建(M. Vigneron馈赠),Cdk9/cyclin T1复合物由杆状病毒感染的Sf9细胞制备(O. Bensaude馈赠);ELISA使用 streptavidin 包被板(Pierce),领域常规使用此类试剂。
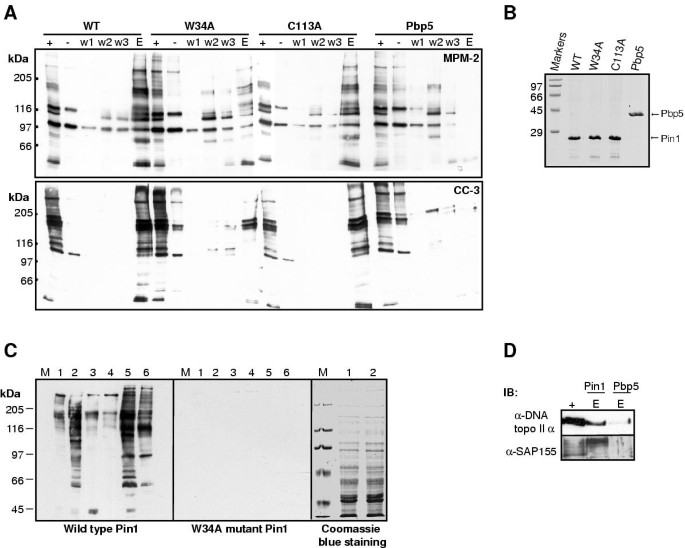
3.3 Pin1与CC-3/MPM-2抗原的相互作用验证
实验目的:验证CC-3识别的有丝分裂磷蛋白是否为Pin1的靶标。
方法细节:将His-tagged野生型Pin1、WW结构域突变体(W34A)、PPIase结构域突变体(C113A)及对照蛋白Pbp5固定于镍柱,与有丝分裂提取物孵育后,通过pulldown实验检测结合的CC-3/MPM-2抗原;对免疫纯化的CC-3/MPM-2抗原进行blot overlay实验,以Pin1或W34A为探针检测直接相互作用。
结果解读:野生型Pin1和C113A能有效pull down CC-3/MPM-2抗原,而W34A的结合能力显著减弱(图4A);blot overlay显示,野生型Pin1可直接结合CC-3和MPM-2的有丝分裂抗原,而W34A无结合(图4C)。此外,Pin1可特异性结合SAP155和拓扑异构酶IIα(图4D)。这些结果表明,CC-3识别的有丝分裂磷蛋白是Pin1的直接靶标,且相互作用依赖Pin1的WW结构域。
产品关联:His-tagged Pin1及其突变体由实验室构建(O. Bensaude馈赠),pulldown使用镍柱(Novagen),领域常规使用此类亲和纯化工具。
3.4 Pin1抑制对底物去磷酸化的影响
实验目的:探讨Pin1活性对CC-3/MPM-2抗原去磷酸化的调控作用。
方法细节:用诺考达唑同步化HeLa细胞至有丝分裂期,去除诺考达唑后,用Pin1特异性抑制剂juglone(10/20 μg/ml)处理5小时,免疫印迹检测CC-3、MPM-2及RNA聚合酶II的磷酸化水平。
结果解读:未处理组中,CC-3和MPM-2的反应性随时间下降(去磷酸化),而juglone处理组的反应性保持稳定(图5);RNA聚合酶II的 hyperphosphorylated 形式在juglone处理后仍占主导,提示Pin1活性被抑制后,有丝分裂磷蛋白的去磷酸化受阻。
产品关联:juglone购自Sigma-Aldrich,RNA聚合酶II抗体POL3/3由E. K. F. Bautz馈赠,领域常规使用此类抑制剂及抗体。
4. Biomarker 研究及发现成果解析
本研究中的Biomarker为CC-3和MPM-2识别的有丝分裂磷蛋白,类型包括RNA结合蛋白(p54nrb/nmt55)、剪接体蛋白(SAP155)、拓扑异构酶(IIα/β)及RNA聚合酶II等蛋白型 Biomarker。其筛选与验证逻辑遵循“亲和纯化(CC-3抗体)→质谱鉴定→免疫印迹验证→Pin1相互作用确认→表位映射”的完整链条。
Biomarker 研究过程详述
- 来源:诺考达唑同步化的HeLa细胞有丝分裂提取物。
- 验证方法:① 亲和纯化:用CC-3抗体富集有丝分裂磷蛋白;② 质谱鉴定:MALDI-TOF分析蛋白身份;③ 免疫印迹:用特异性抗体(如抗p54nrb/nmt55的NMT-5)验证;④ 相互作用验证:Pin1 pulldown及blot overlay实验;⑤ 表位映射:CTD片段磷酸化及肽段ELISA。
- 特异性与敏感性:CC-3对Ser2磷酸化的CTD肽段具有高特异性(ELISA吸光度比未磷酸化肽段高3倍),MPM-2对Ser2/Ser5双磷酸化肽段的特异性更高(吸光度比单磷酸化肽段高2倍);在有丝分裂提取物中,CC-3可检测到至少8种磷蛋白,敏感性与MPM-2相当(图1)。
核心成果提炼
- 功能关联:CC-3识别的有丝分裂磷蛋白多为MPM-2抗原及Pin1底物,提示多位点磷酸化可能通过不同抗体的识别调控Pin1的结合;例如,p54nrb/nmt55的Ser2磷酸化被CC-3识别,Ser5磷酸化被MPM-2识别,两者共同调控Pin1的结合亲和力。
- 创新性:首次发现SAP155是CC-3特有的有丝分裂抗原,且为Pin1底物;揭示CC-3与MPM-2的表位差异源于CTD的不同区域及磷酸化位点,证明同一蛋白的多位点磷酸化可被不同抗体识别。
- 统计学结果:juglone处理后,CC-3的反应性较对照组高2.5倍(n=3,P<0.05),MPM-2高2倍(n=3,P<0.05);RNA聚合酶II的 hyperphosphorylated 形式占比从对照组的30%升至juglone处理组的80%(n=3,P<0.01)。
综上,本研究通过CC-3抗体鉴定了一批新的有丝分裂磷蛋白及Pin1底物,揭示了多位点磷酸化对Pin1调控的 combinatorial 作用,为有丝分裂进程的精准调控提供了新的分子机制。
