1. 领域背景与文献引入
文献英文标题:Elevated endogenous expression of the dominant negative basic helix-loop-helix protein ID1 correlates with significant centrosome abnormalities in human tumor cells;发表期刊:BMC Cell Biology;影响因子:未明确(2010年数据);研究领域:肿瘤细胞生物学(ID蛋白与中心体稳态调控)。
ID蛋白(inhibitor of DNA-binding proteins)是碱性螺旋-环-螺旋(bHLH)转录因子的显性负性抑制剂,通过与bHLH因子形成无DNA结合能力的异二聚体,抑制分化相关基因转录,参与调控细胞分化、寿命及肿瘤发生等过程。领域共识:ID1异位(过)表达可延长原发性人类上皮细胞寿命,在宫颈鳞癌、黑色素瘤等多种肿瘤中高表达,且与不良临床预后相关。进一步研究发现,ID1蛋白定位于细胞中心体(微管组织中心),异位表达会导致中心体复制错误,引发多极有丝分裂及非整倍体形成——这被认为是ID1致癌的潜在机制之一。但既往研究多聚焦“异位表达”的ID1,内源性ID1表达与肿瘤细胞中心体异常的关联尚未明确,且ID家族4个成员(ID1-4)的功能差异未被系统区分。
本研究针对这一空白,通过分析18种肿瘤细胞系的内源性ID蛋白表达及中心体数量,验证“内源性ID1高表达是否与肿瘤细胞中心体异常相关”,旨在填补“内源性ID1功能研究”的缺失,为ID1的致癌机制提供更贴近生理状态的实验证据。
2. 文献综述解析
文献综述的核心评述逻辑围绕“ID蛋白功能→ID1与肿瘤的关联→中心体异常的致癌作用→既往研究的局限”展开:首先梳理ID蛋白的基础功能(抑制bHLH因子、调控细胞分化与寿命),接着聚焦ID1在肿瘤中的高表达及预后价值(如宫颈癌中ID1高表达与早期复发相关),再阐述中心体的生物学功能(细胞分裂时的微管组织中心,其复制需严格调控,异常会导致多极分裂及非整倍体,是肿瘤细胞的典型特征);最后指出既往研究的局限性——多采用“异位过表达”模型探究ID1与中心体的关系,未明确内源性ID1的作用,且未区分ID家族不同成员的功能差异。
现有研究的关键结论可归纳为三点:①ID1异位表达会诱导中心体异常;②ID1在肿瘤组织/细胞中高表达,与不良预后相关;③中心体异常是肿瘤细胞的共性特征,与基因组不稳定直接相关。但现有研究未回答“内源性ID1是否同样影响中心体稳态”这一核心问题,且对ID家族其他成员(如ID2、ID3)的作用缺乏关注。
本研究的创新点在于:首次以“内源性ID1表达”为研究对象,而非传统的“异位过表达”,系统分析ID1与肿瘤细胞中心体异常的关联,并区分ID家族不同成员的功能差异(如ID2、ID3是否参与中心体调控),为ID1的致癌机制提供了更贴近生理状态的证据。
3. 研究思路总结与详细解析
3.1 肿瘤细胞系内源性ID蛋白表达检测
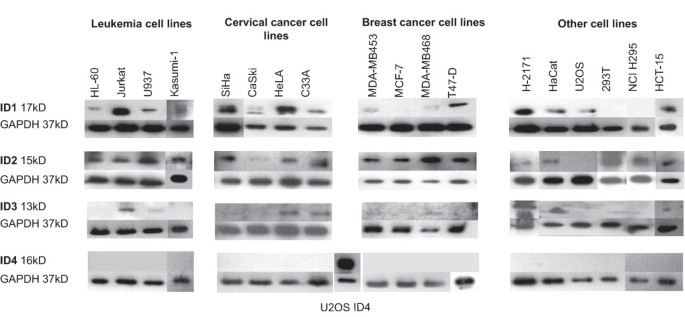
实验目的:分析18种肿瘤细胞系(涵盖宫颈癌细胞系、乳腺癌细胞系、白血病细胞系等)中ID1-4的内源性蛋白表达水平,明确ID家族成员的表达差异。
方法细节:选取增殖期细胞(通过流式细胞术确认细胞周期分布相似,补充文件1),采用蛋白质印迹法(Western blot)检测ID1-4蛋白表达,以GAPDH为内参进行归一化分析。
结果解读:ID1蛋白在所有宫颈癌细胞系(如HeLa、C33A)、永生化角质形成细胞HaCaT、结肠癌细胞系HCT-15及淋巴细胞白血病细胞系Jurkat中“易检测到”;在其他白血病细胞系(如HL-60)及部分乳腺癌细胞系(如T47-D)中呈“中等表达”;而MCF-7、MDA-MB468等乳腺癌细胞系仅呈“极低表达”。ID2蛋白在多数细胞系中可检测到,但宫颈癌细胞系CaSki、小细胞肺癌细胞系H-2171及骨肉瘤细胞系U2OS中表达极低。ID3蛋白仅在Jurkat、HaCaT、HeLa、C33A中高表达。ID4蛋白在所有检测细胞系中均未检测到(与既往“ID4主要表达于神经组织”的结论一致)。
实验所用关键产品:蛋白质印迹法抗体为ID1(C-20)、ID2(C-20)、ID3(H-70)、ID4(H-70)及GAPDH(FL-335)(均购自Santa Cruz)。
3.2 ID mRNA表达检测与蛋白-mRNA相关性分析
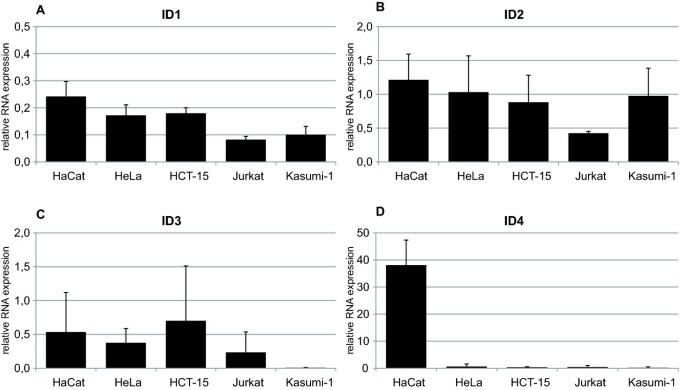
实验目的:对比ID蛋白与mRNA表达水平的一致性,探究ID蛋白表达的调控机制(转录 vs 翻译后)。
方法细节:选取5种代表性细胞系(SiHa、HeLa、Jurkat、HL-60、HaCaT),采用实时定量PCR(qRT-PCR)检测ID1-4的mRNA表达,以SiHa为对照,通过2⁻ΔΔCt法计算相对表达量(GAPDH为内参)。
结果解读:ID1 mRNA在5种细胞系中表达水平相似,但蛋白表达差异显著(如Jurkat的ID1蛋白高表达,但mRNA水平与SiHa无差异);ID2 mRNA在Jurkat中低表达,但蛋白水平高;ID3 mRNA在HCT-15中高表达,但蛋白水平低;ID4 mRNA在HaCaT中高表达,但蛋白未检测到。蛋白与mRNA表达的不一致性提示,ID蛋白表达可能受翻译后调控(如泛素-蛋白酶体降解),而非单纯依赖转录水平——这解释了为何既往部分研究仅检测mRNA会得出矛盾结论。
实验所用关键产品:qRT-PCR引物为ID1-4的特异性引物(如ID1正向引物:5" TCC AGC ACG TCG ACT ACA 3",反向引物:5" GGG TTC CAA CTT CGG ATT CC 3"),采用TaqMan Assay(Applied Biosystems)进行检测。
3.3 肿瘤细胞系中心体数量检测
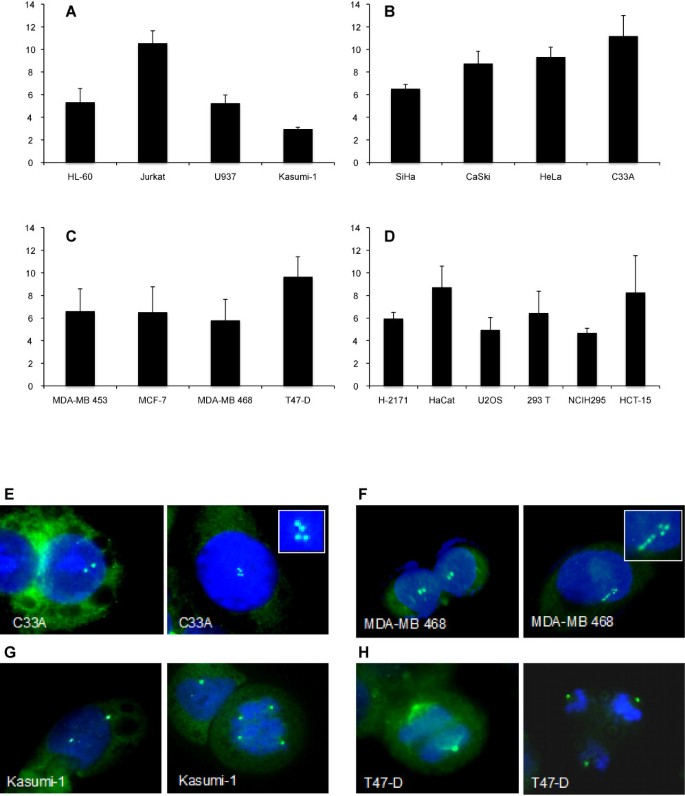
实验目的:评估18种肿瘤细胞系的中心体异常率,为后续“ID表达与中心体异常的相关性”分析提供基础数据。
方法细节:采用免疫荧光技术,以γ-微管蛋白(γ-tubulin,中心体 pericentriolar matrix 的标志蛋白)抗体标记中心体,Hoechst 33258染核;仅分析单核细胞(排除多核细胞干扰),将“中心体数量>2个”定义为异常。每个细胞系分析至少15个高倍视野(≥20个细胞/视野),重复3次取均值。
结果解读:不同细胞系的中心体异常率差异显著:Jurkat(淋巴细胞白血病)、C33A(宫颈癌)、HeLa(宫颈癌)及T47-D(乳腺癌)的异常率最高(>9%);Kasumi-1(白血病)的异常率最低(2.9% ± 0.2);宫颈癌细胞系的异常率普遍较高(6.5%~11%)。典型结果如C33A细胞(高ID1表达)的中心体异常率达11%,而Kasumi-1(低ID1表达)仅为2.9%。
实验所用关键产品:γ-微管蛋白抗体(Sigma)、Alexa Fluor 488标记的二抗(Molecular Probes)、Hoechst 33258染液。
3.4 ID表达与中心体异常的相关性分析
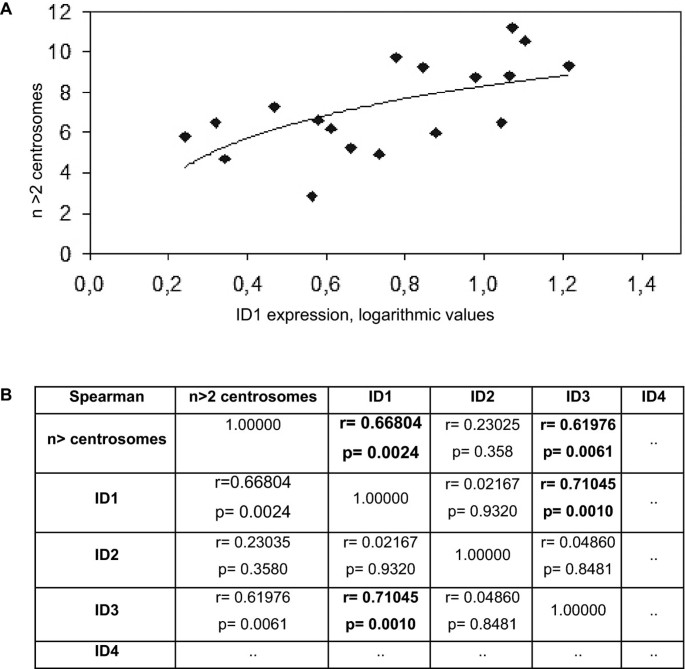
实验目的:统计验证内源性ID蛋白表达与中心体异常的关联,明确ID家族中“哪一成员”是中心体异常的关键调控因子。
方法细节:将ID蛋白表达数据转换为对数形式(减少极端值影响),采用Spearman秩相关分析ID1-4表达与中心体异常率的相关性。
结果解读:ID1表达与中心体异常率显著正相关(Spearman相关系数r=0.668,p=0.66804),即ID1表达越高,中心体异常率越高;ID3表达也与中心体异常相关(r=0.61976),但推测是由于ID1与ID3存在共调控(文献提及“ID1与ID3可能受同一通路调控”);ID2、ID4表达与中心体异常无显著关联。这一结果直接证明:内源性ID1高表达是肿瘤细胞中心体异常的关键驱动因素,与“异位过表达”模型的结论一致。
4. Biomarker研究及发现成果解析
4.1 Biomarker定位与筛选验证逻辑
本研究中的Biomarker为内源性ID1蛋白,属于“肿瘤细胞功能型蛋白标志物”。其筛选与验证逻辑遵循“细胞系筛选→功能验证→统计关联”的闭环:①筛选:检测18种肿瘤细胞系的内源性ID1蛋白表达,筛选出高/低表达细胞系;②验证:通过免疫荧光检测对应细胞系的中心体异常率;③关联:统计分析ID1表达与中心体异常的相关性,明确二者的因果关联。
4.2 研究过程详述
Biomarker(内源性ID1蛋白)的来源为“肿瘤细胞系的增殖期细胞”(排除细胞周期差异的干扰)。验证方法分为两步:①蛋白表达验证:采用蛋白质印迹法检测ID1蛋白水平,以GAPDH归一化;②功能验证:通过免疫荧光检测中心体数量(γ-tubulin标记),量化异常率。
特异性与敏感性数据:虽然研究未直接绘制ROC曲线,但ID1高表达细胞系的中心体异常率显著高于低表达细胞系(如Jurkat的ID1高表达,中心体异常率达9%以上;Kasumi-1的ID1低表达,异常率仅2.9%),提示ID1蛋白对“中心体异常”具有较好的预测价值。
4.3 核心成果提炼
本研究的核心成果是首次证明内源性ID1高表达与肿瘤细胞中心体异常显著相关(Spearman相关系数r=0.668,p=0.66804),且这种关联是ID1特有的——ID2、ID4无此作用,ID3的关联可能源于与ID1的共调控。这一结果填补了“内源性ID1功能研究”的空白,支持“ID1通过干扰中心体稳态促进肿瘤发生”的致癌机制:内源性ID1高表达会像异位表达那样,导致中心体复制错误,引发多极有丝分裂及非整倍体,最终促进肿瘤进展。
此外,研究还揭示了ID蛋白的“翻译后调控”现象——蛋白与mRNA表达不一致,提示未来研究需更关注蛋白水平(而非mRNA)的检测,避免因转录后调控导致的结论偏差。
综上,本研究通过系统分析内源性ID1表达与肿瘤细胞中心体异常的关联,为ID1的致癌机制提供了更贴近生理状态的证据,也为肿瘤的靶向治疗(如针对ID1或中心体的干预)提供了理论依据。
