1. 领域背景与文献引入
文献英文标题:The CXC chemokine cCAF stimulates precocious deposition of ECM molecules by wound fibroblasts, accelerating development of granulation tissue;发表期刊:BMC Cell Biol;影响因子:未公开;研究领域:创面修复与细胞外基质(ECM)调控。
创面修复是一个涉及炎症反应、细胞迁移、ECM沉积及组织重塑的复杂过程,成纤维细胞是ECM的主要产生细胞,其分泌的肌腱蛋白(TN)、纤连蛋白(FN)、I/III型胶原蛋白(Coll I/III)是肉芽组织形成的核心支架。趋化因子作为小分子细胞因子,在创面早期通过招募炎症细胞、激活整合素发挥作用,但既往研究多聚焦于其对免疫细胞或内皮细胞的调控,缺乏CXC趋化因子直接调控成纤维细胞ECM产生的证据。鸡CXC趋化因子cCAF是人类IL-8的同源物,前期研究发现其高表达于创面肉芽组织的成纤维细胞中,且能诱导成纤维细胞向肌成纤维细胞分化,但未明确其对ECM分子的直接影响。因此,本研究旨在探讨cCAF对创面成纤维细胞ECM分子的调控作用及机制,明确其对肉芽组织形成的影响,为创面修复的靶向干预提供理论依据。
2. 文献综述解析
作者围绕“趋化因子的结构与功能”“趋化因子在创面修复中的已知作用”“cCAF的前期研究”三个维度梳理现有研究:
- 趋化因子的结构与功能:趋化因子具有保守的三维结构(N端可变区、三个β折叠、C端α螺旋),不同结构域负责不同功能(如N端参与细胞趋化);
- 趋化因子在创面修复中的作用:已知趋化因子参与早期炎症细胞招募、再上皮化及血管生成,但对成纤维细胞ECM产生的调控尚未明确;
- cCAF的前期研究:cCAF在创面肉芽组织的成纤维细胞及内皮细胞中高表达,能诱导成纤维细胞分化为肌成纤维细胞(ECM的主要产生细胞),但缺乏其对ECM分子产生的直接证据。
现有研究的局限在于:未明确cCAF是否直接调控成纤维细胞的ECM产生,及不同ECM分子的调控机制差异。本研究的创新点在于:首次证明cCAF通过不同机制调控成纤维细胞产生TN、FN及Coll I(不影响Coll III),且N端15aa肽段足以诱导TN产生,而FN和Coll I的调控需要完整cCAF分子;同时首次明确cCAF通过加速ECM沉积促进肉芽组织形成,为创面修复的趋化因子靶向治疗提供了新靶点。
3. 研究思路总结与详细解析
3.1 整体框架概括
研究目标:明确cCAF对创面成纤维细胞ECM产生的影响及机制;
核心科学问题:cCAF如何调控不同ECM分子的产生;
技术路线:原代细胞实验(模拟创面环境)→体内创面模型验证→机制探究(基因表达、蛋白酶活性、抗体阻断)。
3.2 原代鸡胚成纤维细胞模型构建
实验目的:建立模拟创面环境的成纤维细胞模型。
方法细节:取10日龄鸡胚的原代成纤维细胞,低血清(2% donor calf serum)培养(模拟创面中血清因子丰富但低于正常组织的环境);使用原代细胞避免传代细胞的表型改变。
结果解读:原代细胞保留了创面成纤维细胞的特性(快速增殖、产生ECM、分化为肌成纤维细胞),适合研究cCAF的作用。
实验所用关键产品:细胞培养试剂(Gibco-BRL)、donor calf serum(未提及具体品牌)。
3.3 cCAF及肽段对肌腱蛋白(TN)的调控
实验目的:探究cCAF对成纤维细胞TN产生的影响及结构域依赖性。
方法细节:用750 ng/ml cCAF、N端15aa肽段或C端28aa肽段处理细胞4天,通过免疫染色(细胞定位)、免疫印迹(蛋白水平)、RT-PCR(mRNA水平)分析TN的表达;体内实验用鸡翼切除创面(一侧用cCAF,另一侧用对照),3天和7天取材检测TN。
结果解读:细胞实验显示,cCAF和N端肽段处理后,TN的免疫染色强度及阳性细胞数显著增加(图1A-D);免疫印迹显示蛋白水平增加1.5倍(n=3,P<0.05,图1E);RT-PCR显示mRNA水平增加2倍以上(图1F)。体内实验中,cCAF处理的创面3天时TN水平相当于对照组7天的水平(图2C),说明cCAF加速TN沉积。
实验所用关键产品:免疫染色抗体(Hybridoma Bank,抗TN)、RT-PCR试剂(Promega)、免疫印迹试剂(Bio-Rad,DC蛋白 assay)。
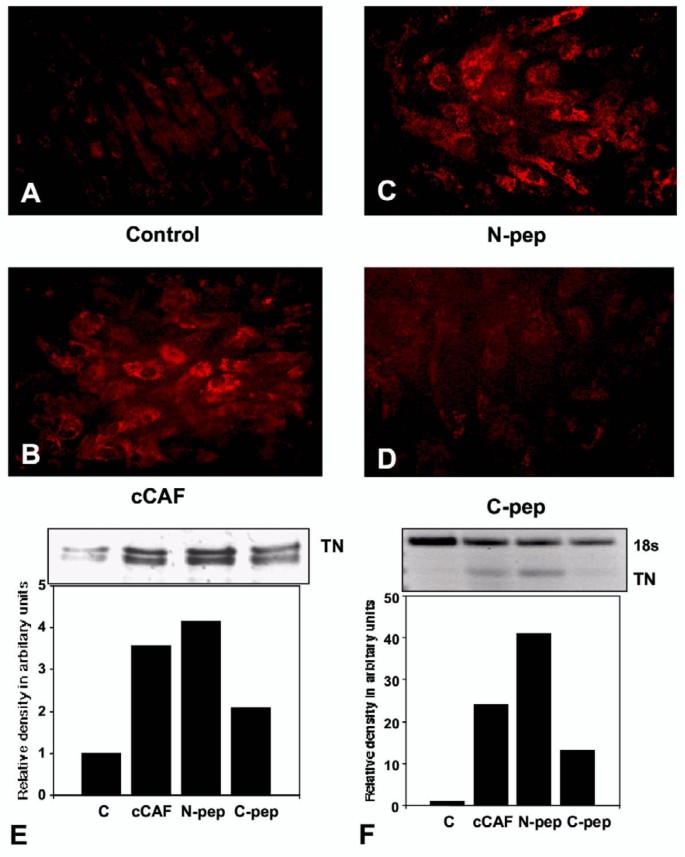
(图1:cCAF对细胞TN表达的影响)
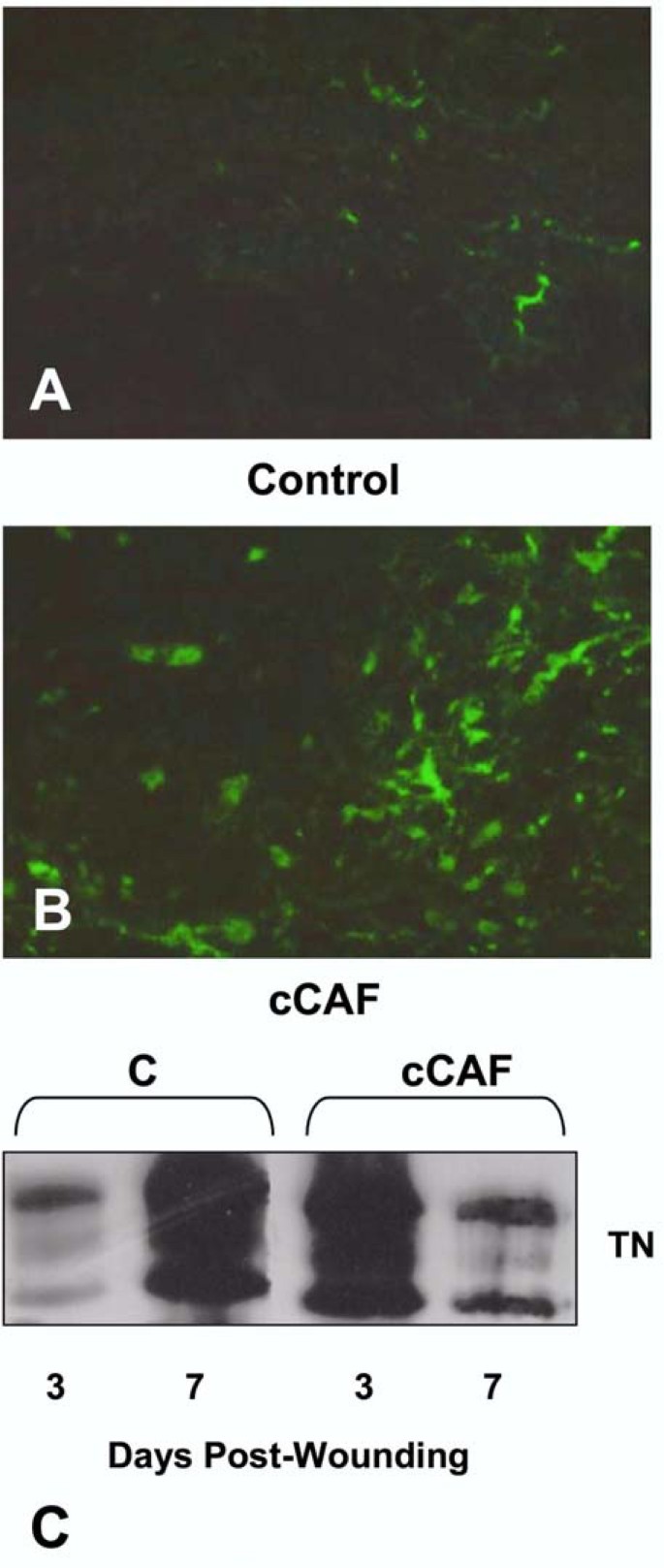
(图2:cCAF对体内创面TN沉积的影响)
3.4 cCAF对纤连蛋白(FN)的调控及机制
实验目的:明确cCAF对FN产生的影响及机制。
方法细节:免疫染色、免疫印迹分析FN的蛋白水平;RT-PCR检测mRNA水平;检测纤溶酶原激活物(PA)及基质金属蛋白酶(MMP)活性;用TN antisense寡核苷酸阻断TN表达,观察FN变化;体内实验验证FN沉积。
结果解读:细胞实验显示,cCAF处理后FN的免疫染色纤维更密集(图3B),蛋白水平增加1.8倍(n=3,P<0.05,图3E),但mRNA无变化(图3F);PA及MMP活性检测显示cCAF不影响PA活性,且MMP-3/7/10无活性(图5A-B);TN antisense寡核苷酸阻断TN后,cCAF诱导的FN增加被抑制(图5C),说明FN积累依赖TN。体内实验中,cCAF处理的创面3天时FN水平高于对照组,7天时恢复(图4C)。
实验所用关键产品:免疫染色抗体(Hybridoma Bank,抗FN)、寡核苷酸(Sigma Genosys)、蛋白酶活性检测试剂(Calbiochem)。
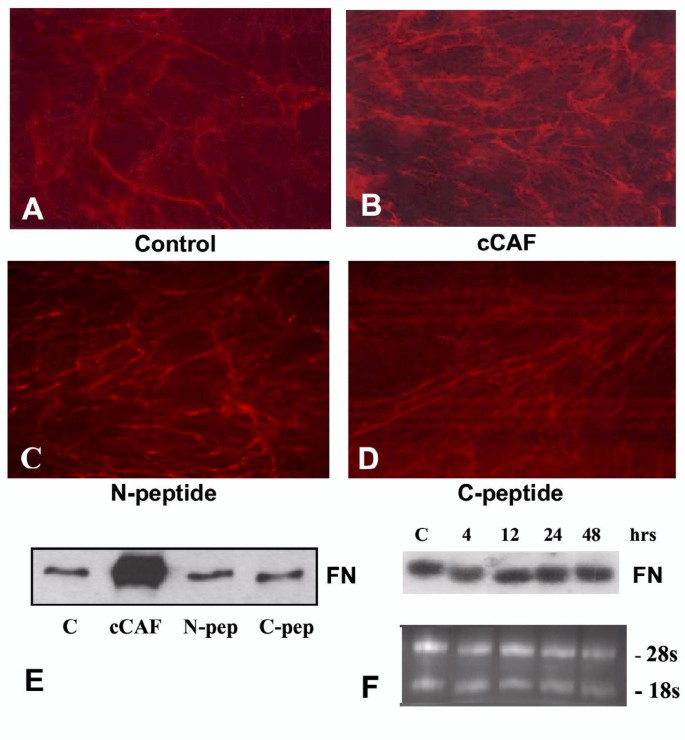
(图3:cCAF对细胞FN表达的影响)
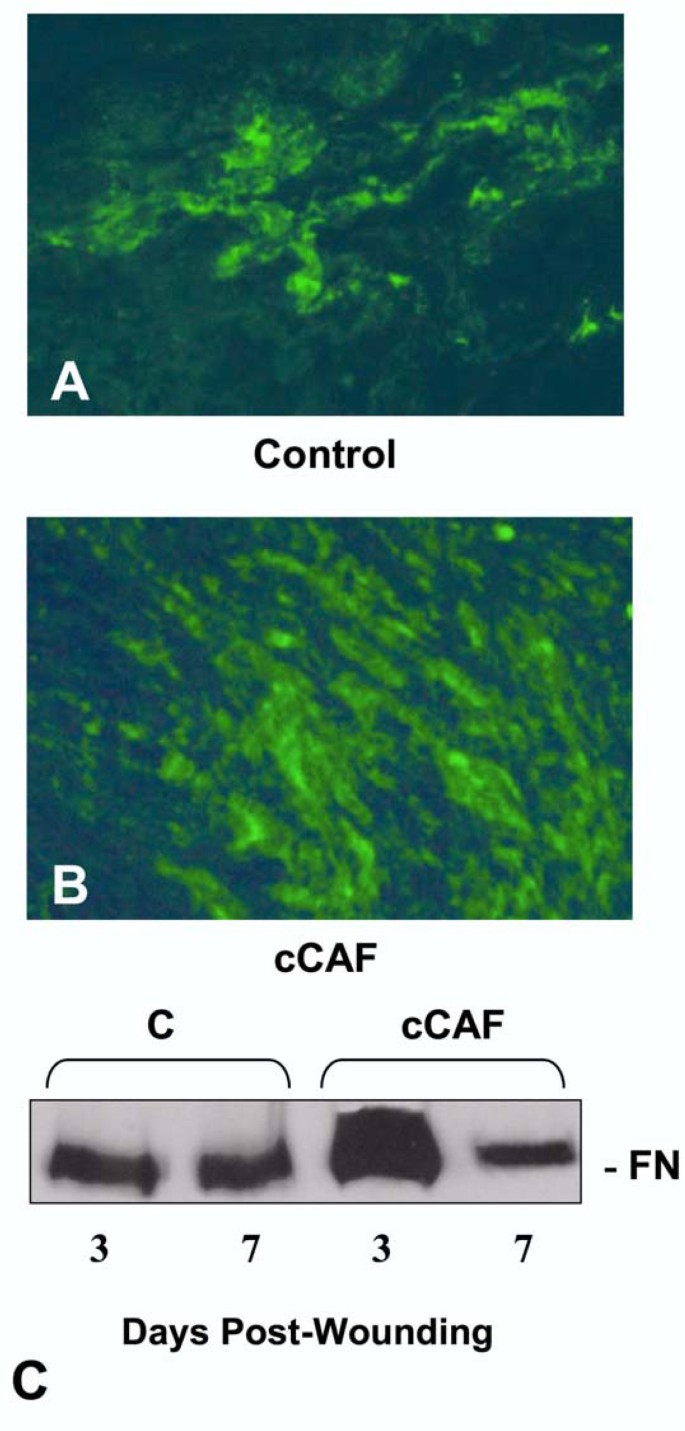
(图4:cCAF对体内创面FN沉积的影响)
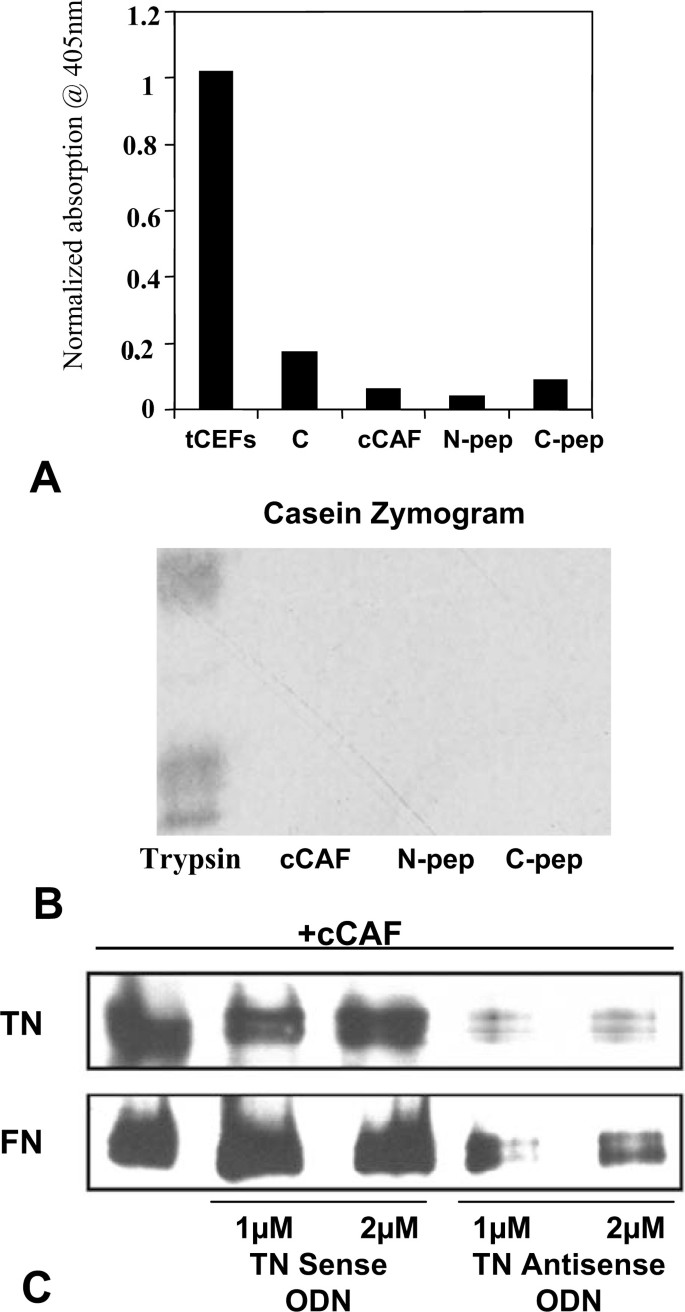
(图5:FN积累的机制实验)
3.5 cCAF对I/III型胶原蛋白(Coll I/III)的调控及机制
实验目的:探究cCAF对Coll I/III的影响及机制。
方法细节:免疫印迹分析Coll I/III的蛋白水平;明胶酶谱检测MMP-2/9活性;免疫印迹检测MMP-1及TIMP-1/2的水平。
结果解读:免疫印迹显示,cCAF处理后Coll I蛋白水平增加1.2倍(n=3,P<0.05,图6A),但不影响Coll III(图6B);明胶酶谱显示MMP-2活性无变化,MMP-9无表达(图7A);免疫印迹显示MMP-1水平减少40%(n=3,P<0.05),而TIMP-1/2无变化(图7B),说明Coll I的增加与MMP-1降解减少有关。体内实验中,cCAF处理的创面3天时Coll I水平略高于对照组,7天时恢复(图6C)。
实验所用关键产品:免疫染色抗体(Hybridoma Bank,抗Coll I/III)、MMP抗体(Tai-Lan Tuan博士馈赠)。
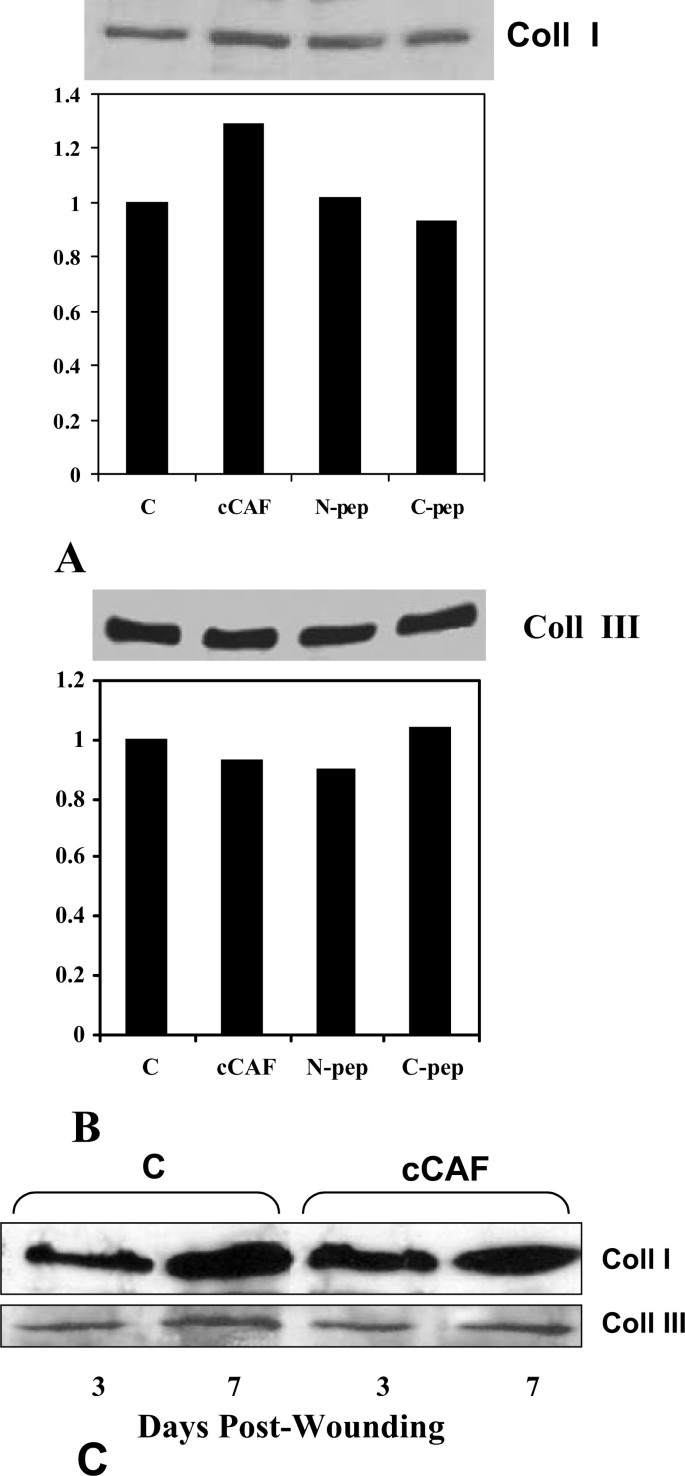
(图6:cCAF对Coll I/III表达的影响)
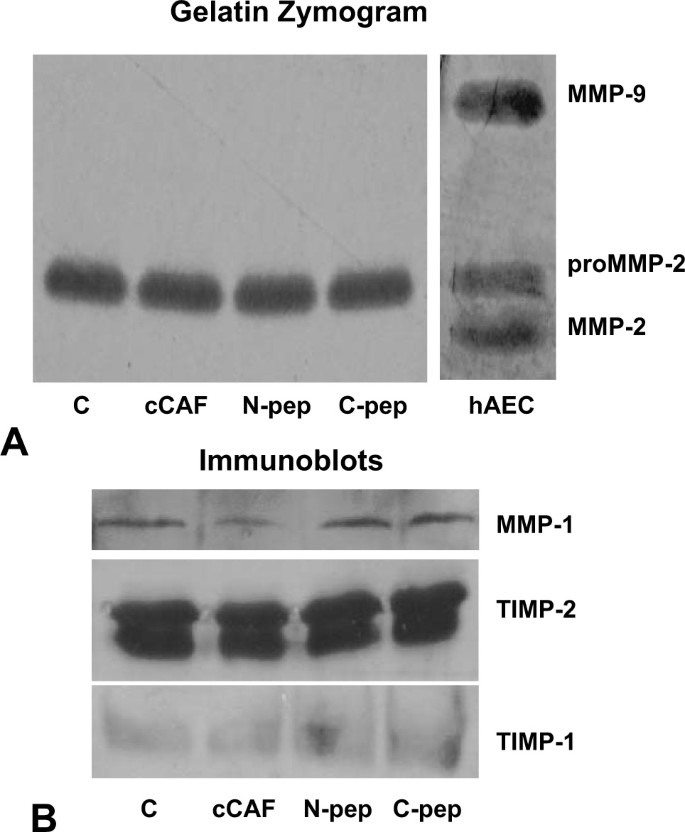
(图7:MMP的活性检测)
3.6 cCAF对成纤维细胞迁移的影响
实验目的:明确cCAF对成纤维细胞迁移的作用。
方法细节:Transwell实验(趋化迁移)、克隆环实验(迁移距离)、原位杂交(迁移细胞的cCAF表达)。
结果解读:Transwell实验显示,cCAF以剂量依赖方式促进迁移(1000 ng/ml时迁移数是对照组的2.5倍,n=4,P<0.05,图8A);克隆环实验显示迁移距离增加30%(n=4,P<0.05,图8C);原位杂交显示迁移的成纤维细胞中cCAF表达上调(图8D)。
实验所用关键产品:Transwell小室(Fisher)、原位杂交试剂(Amersham)。
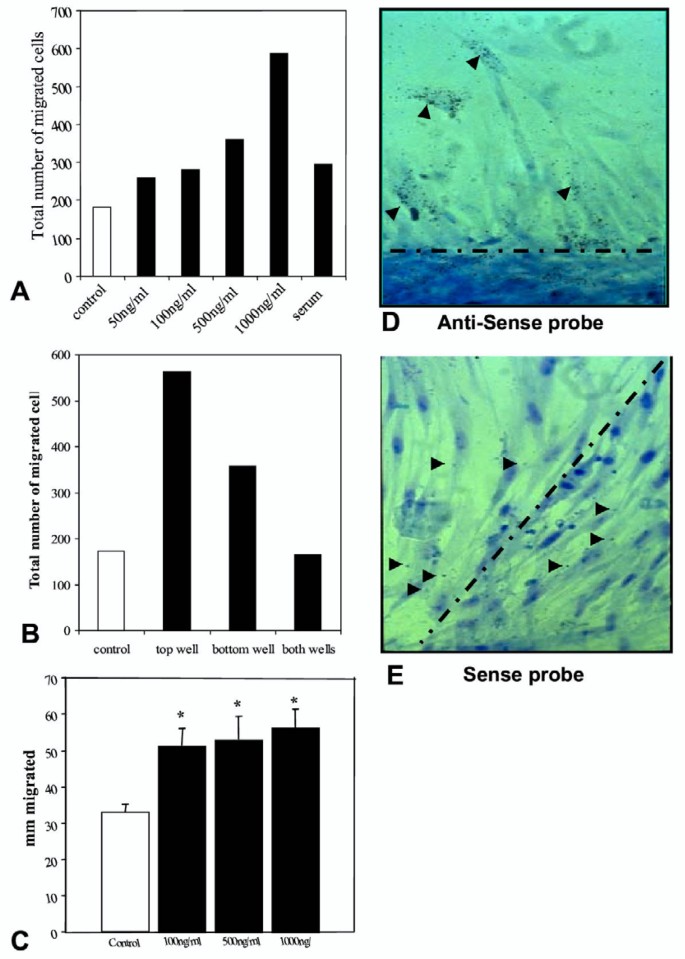
(图8:cCAF对成纤维细胞迁移的影响)
4. Biomarker研究及发现成果解析
4.1 Biomarker定位与筛选逻辑
本研究涉及的Biomarker为肌腱蛋白(TN)、纤连蛋白(FN)、I型胶原蛋白(Coll I),均为创面肉芽组织形成的关键ECM分子。
筛选/验证逻辑:原代细胞实验筛选cCAF调控的ECM分子→体内创面模型验证沉积变化→机制实验明确调控方式。
4.2 研究过程详述
- 来源:原代成纤维细胞的细胞 lysate及创面组织的蛋白提取物;
- 验证方法:免疫染色(细胞定位)、免疫印迹(蛋白水平)、RT-PCR(基因表达);
- 特异性与敏感性:
- TN:cCAF处理后mRNA增加2倍以上,蛋白增加1.5倍(n=3,P<0.05);体内创面3天时TN水平相当于对照组7天的水平;
- FN:蛋白增加1.8倍(n=3,P<0.05),但mRNA无变化;
- Coll I:蛋白增加1.2倍(n=3,P<0.05),MMP-1减少40%(n=3,P<0.05)。
4.3 核心成果提炼
- 功能关联:TN、FN、Coll I是创面肉芽组织形成的Biomarker,cCAF通过不同机制调控其产生:
- TN:N端15aa肽段上调基因表达;
- FN:TN依赖的蛋白稳定;
- Coll I:减少MMP-1降解。
- 创新性:首次发现cCAF的N端15aa肽段足以诱导TN产生,为开发小分子肽段促进创面修复提供了可能;首次明确FN的积累依赖TN,为ECM分子间的相互调控提供了新证据。
- 临床意义:这些ECM分子的提前沉积加速了肉芽组织形成,进而促进创面修复,为cCAF或其肽段作为创面修复的治疗靶点提供了理论依据。
本研究通过系统的细胞及体内实验,明确了cCAF对创面成纤维细胞ECM产生的调控作用及机制,为创面修复的趋化因子靶向治疗提供了新的思路和靶点。
