1. 领域背景与文献引入
文献英文标题:Differential growth factor regulation of aspartyl-(asparaginyl)-β-hydroxylase family genes in SH-Sy5y human neuroblastoma cells;发表期刊:BMC Cell Biology;影响因子:3.108;研究领域:神经母细胞瘤细胞中生长因子调控的Aspartyl-(asparaginyl)-β-羟化酶(AAH)家族基因表达机制。
Aspartyl-(asparaginyl)-β-羟化酶(AAH)是α-酮戊二酸依赖的双加氧酶家族核心成员,通过催化Notch、Jagged等蛋白EGF样结构域中的天冬氨酸(Asp)/天冬酰胺(Asn)残基羟化,调控细胞运动、分化等关键过程。AAH家族包含三个功能差异显著的成员:AAH(含完整催化结构域,具有羟化酶活性)、Humbug(缺失催化结构域,参与细胞内钙释放调控)、Junctin(主要表达于肌细胞,维持肌浆网钙稳态)。现有研究证实,AAH和Humbug在肝癌、胆管癌等肿瘤细胞中高表达,与肿瘤侵袭、转移直接相关——如AAH过表达可促进肝癌细胞迁移,反义寡核苷酸抑制AAH能显著降低胆管癌细胞的侵袭能力。然而,神经母细胞瘤中AAH家族的表达模式、生长因子调控机制及功能差异尚未明确:此前用反义寡核苷酸抑制AAH时会同时沉默Humbug(两者共享5"端序列),无法区分两者的独立功能;胰岛素、IGF-1等生长因子在神经母细胞瘤增殖中的作用已被报道,但对AAH家族的调控通路仍未知。
本研究针对上述空白,以SH-Sy5y神经母细胞瘤细胞为模型,系统解析AAH家族的表达谱、生长因子调控机制及功能差异,为理解神经母细胞瘤细胞运动的分子机制提供新线索。
2. 文献综述解析
文献综述的核心评述逻辑为“家族功能→肿瘤关联→生长因子通路→神经肿瘤空白”:作者首先总结AAH家族的结构与功能差异,强调AAH的羟化酶活性和Humbug的钙调控作用;接着梳理AAH/Humbug在肿瘤中的高表达与细胞运动的关联,指出其作为肿瘤侵袭标志物的潜力;随后介绍胰岛素/IGF-1通过IRS-1介导的Erk MAPK、PI3K-Akt通路调控细胞功能的研究现状;最后点明神经母细胞瘤中AAH家族的调控机制及功能差异是未解决的关键问题。
现有研究的关键结论:① AAH催化Notch羟化是细胞运动的重要驱动因素;② Humbug通过调控钙信号参与细胞内环境稳定;③ 胰岛素/IGF-1通路是肿瘤细胞生长、运动的核心调控轴。优势:明确了AAH在肿瘤侵袭中的核心地位,解析了生长因子信号通路的关键组分;局限性:未区分AAH与Humbug在神经肿瘤中的独立功能,缺乏生长因子对AAH家族调控机制的实证研究。
本研究的创新价值:① 首次在神经母细胞瘤细胞中系统分析AAH家族表达谱,发现Humbug是最丰富的成员;② 通过过表达实验明确AAH(而非Humbug)是促进细胞运动的关键因子;③ 揭示胰岛素/IGF-1通过Erk MAPK、PI3K-Akt、Cdk-5通路协同调控AAH家族表达,为神经母细胞瘤的靶向治疗提供新靶点。
3. 研究思路总结与详细解析
整体框架
研究目标:阐明SH-Sy5y神经母细胞瘤细胞中AAH家族的表达调控及功能;
核心科学问题:AAH家族在神经母细胞瘤中的表达模式?胰岛素/IGF-1如何调控其表达?AAH与Humbug在细胞运动中的作用差异?下游信号通路如何参与?
技术路线:以“表达谱分析→生长因子刺激→功能验证→通路筛选→机制解析”为闭环,逐步揭示AAH家族的调控网络。
3.1 AAH家族基因表达谱分析
实验目的:明确SH-Sy5y细胞、PNET(原始神经外胚层肿瘤)细胞及正常脑组织中AAH、Humbug、Junctin的mRNA水平。
方法细节:收集SH-Sy5y细胞、PNET1(分化差、增殖快)/PNET2(可分化)细胞、正常婴儿(n=2)及成人(n=6)额叶皮层组织,用TRIzol(Invitrogen)提取总RNA,通过实时定量反转录聚合酶链反应(real time quantitative RT-PCR)检测mRNA水平,以18S rRNA为内参(避免管家基因受生长因子干扰)。
结果解读:Humbug在SH-Sy5y细胞中表达最高,是AAH或Junctin的8-9倍(n=6,P<0.001);SH-Sy5y、PNET1/PNET2细胞的AAH、Humbug mRNA水平显著高于正常成人脑组织(P<0.001),婴儿脑组织的表达水平高于成人(P<0.05),提示AAH家族在神经发育中下调,在肿瘤细胞中重新激活。
产品关联:RNA提取用Invitrogen的TRIzol试剂,实时定量RT-PCR用Qiagen的QuantiTect SYBR Green PCR Mix。
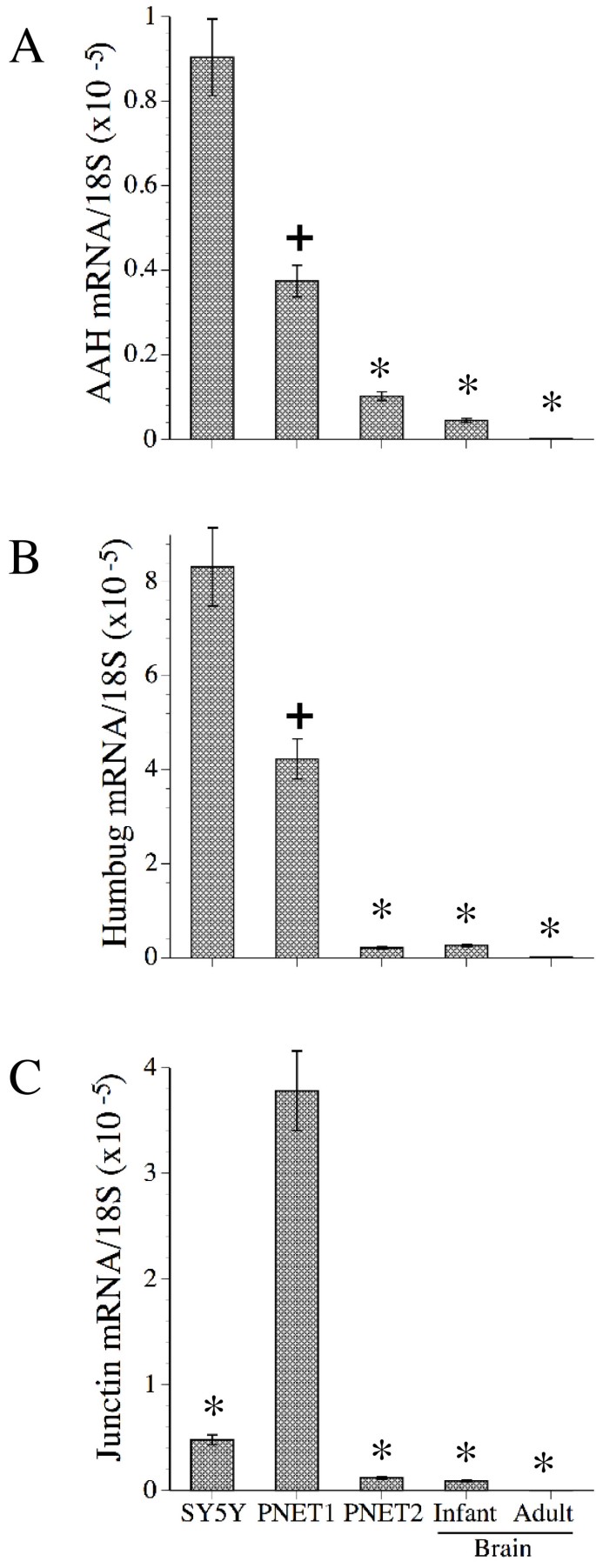
图1显示不同样本中AAH(A)、Humbug(B)、Junctin(C)的mRNA水平,肿瘤细胞中的表达显著高于正常脑组织。
3.2 生长因子对AAH表达及细胞运动的影响
实验目的:研究胰岛素、IGF-1、NGF对AAH家族表达及细胞定向运动的作用。
方法细节:SH-Sy5y细胞血清饥饿12小时后,用胰岛素(50 nM)、IGF-1(25 nM)、NGF(2.5 ng/ml)或溶剂对照刺激24小时;通过Western blot(HB-OH单抗,识别AAH C端表位)检测蛋白水平,MICE(微滴免疫细胞化学ELISA)定量细胞内AAH immunoreactivity(校正细胞密度),ALMI(ATP发光法)检测定向运动(细胞通过8μm孔径膜的比例),实时定量RT-PCR检测mRNA。
结果解读:胰岛素/IGF-1显著增加AAH蛋白(~86 kD)和mRNA水平(n=6,P<0.001),细胞运动指数较对照高约2倍(P<0.001);NGF对AAH无显著影响,但增加Humbug mRNA(P<0.001);Junctin mRNA不受生长因子调控。
产品关联:Western blot用作者自制的HB-OH单抗,ALMI用Packard的ATPLite试剂盒。
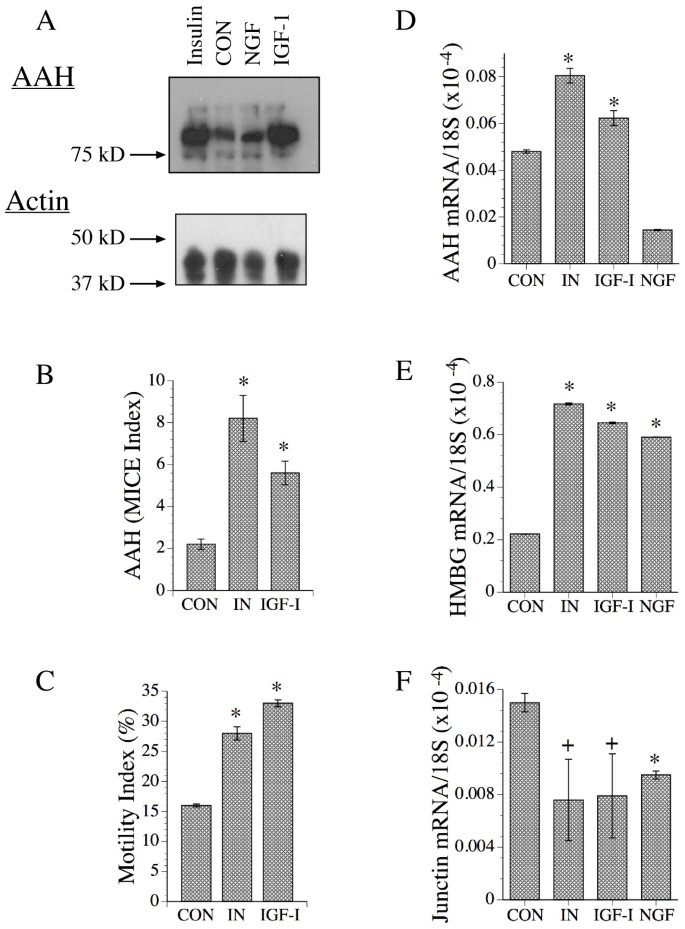
图2显示生长因子刺激后AAH蛋白(A)、MICE定量(B)、细胞运动(C)及mRNA水平(D-F)的变化,胰岛素/IGF-1显著促进AAH表达和运动。
3.3 AAH和Humbug对细胞运动的功能验证
实验目的:区分AAH与Humbug在细胞定向运动中的独立作用。
方法细节:将SH-Sy5y细胞分为三组,分别转染pAAH(AAH过表达质粒)、pHMBG(Humbug过表达质粒)、pLuc(荧光素酶对照),用Lipofectamine 2000(Invitrogen)转染(效率50%-60%,GFP报告基因验证);48小时后通过实时定量RT-PCR确认mRNA过表达,ALMI检测细胞运动。
结果解读:pAAH转染组的AAH mRNA水平较对照高约5倍(n=6,P<0.001),细胞运动指数增加约40%(P<0.001);pHMBG组的Humbug mRNA高约4倍,但运动无显著变化,提示AAH是促进细胞运动的关键因子。
产品关联:转染试剂为Invitrogen的Lipofectamine 2000,质粒由作者构建。
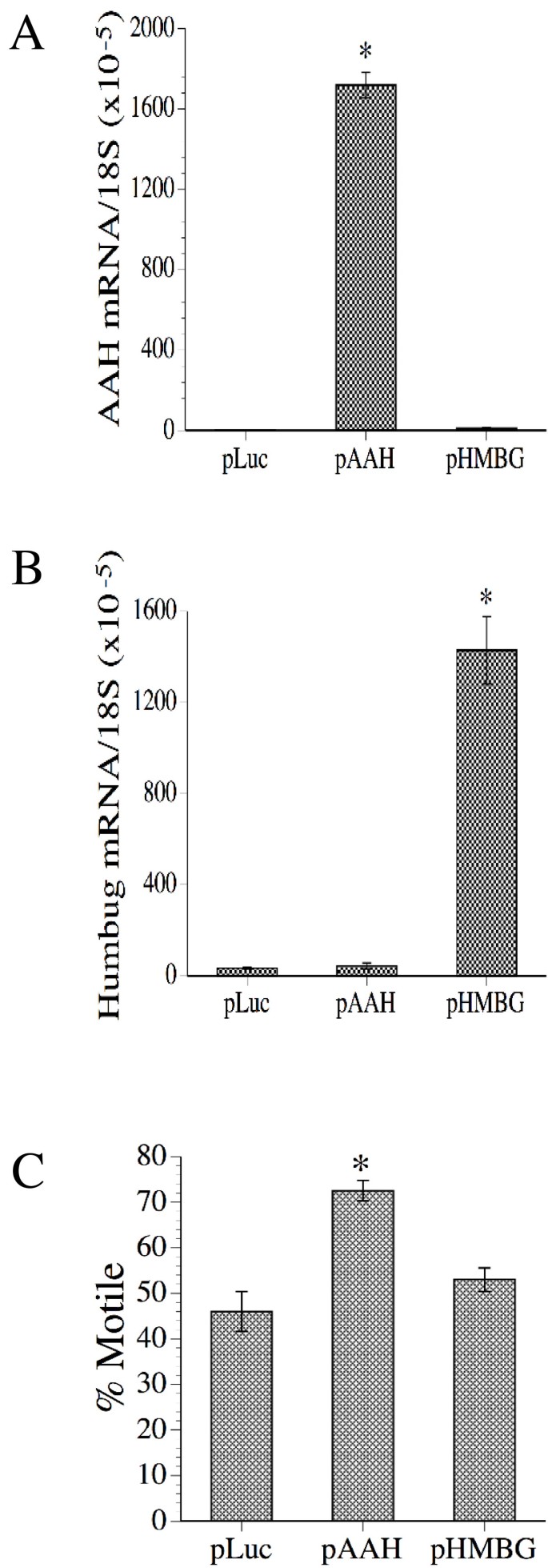
图3显示转染后AAH(A)、Humbug(B)的mRNA水平及细胞运动(C),pAAH组运动显著增加。
3.4 生长因子调控AAH的信号通路筛选
实验目的:鉴定胰岛素/IGF-1调控AAH的下游信号通路。
方法细节:SH-Sy5y细胞血清饥饿过夜,预处理化学抑制剂(Akt、Erk、Cdk-5、p38、PKA、GSK-3β抑制剂)1小时,再用IGF-1(25 nM)刺激24小时;通过实时定量RT-PCR检测mRNA,Western blot/MICE检测蛋白,ALMI检测运动。
结果解读:Akt、Erk、Cdk-5抑制剂显著降低AAH mRNA(P<0.001)和蛋白水平(P<0.001),抑制细胞运动(运动指数降低30%-40%,P<0.001);p38抑制剂对AAH无影响;LiCl(GSK-3β抑制剂)增加AAH蛋白及运动(P<0.001)。
产品关联:抑制剂购自CalBiochem,Western blot用Sigma的β-actin抗体为内参。
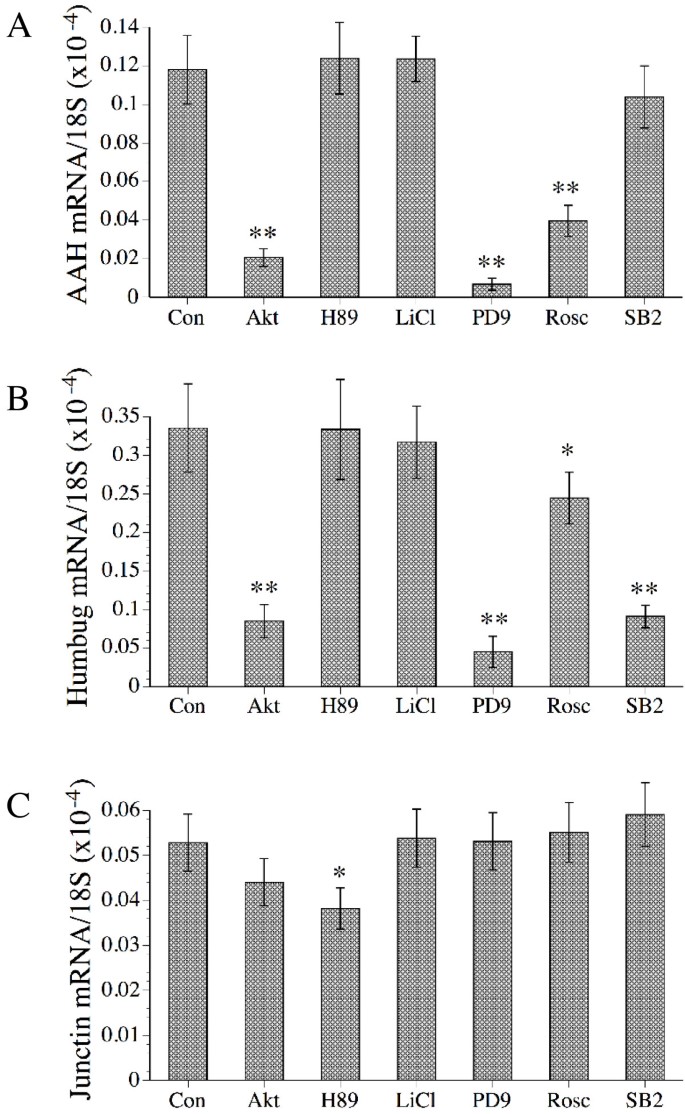
图4显示抑制剂对AAH(A)、Humbug(B)、Junctin(C)mRNA的影响,Akt/Erk/Cdk-5抑制剂显著抑制AAH。
3.5 Cdk-5对AAH家族的调控作用
实验目的:研究Cdk-5(细胞周期蛋白依赖激酶5)及其调控亚基p35/p25对AAH的影响(Cdk-5需与p35/p25结合才具活性,p25为p35截断体,半衰期更长)。
方法细节:转染Cdk-5、p35、p25、Cdk-5+p35、Cdk-5+p25质粒(CMV启动子),用空载体调整DNA量;48小时后检测Cdk-5活性(免疫沉淀+ H1组蛋白激酶 assay)、AAH mRNA(实时定量RT-PCR)、AAH蛋白(Western blot)及细胞运动(ALMI)。
结果解读:Cdk-5+p25转染组的Cdk-5活性最高(是对照的5倍,n=6,P<0.001),AAH mRNA/蛋白水平显著增加(P<0.001),细胞运动指数高约50%(P<0.001);Cdk-5+p35组效果次之,单独转染无显著影响。
产品关联:Cdk-5/p35/p25质粒由Harvard Medical School的Li-Hue Tsai博士提供,激酶 assay用Sigma的H1组蛋白。
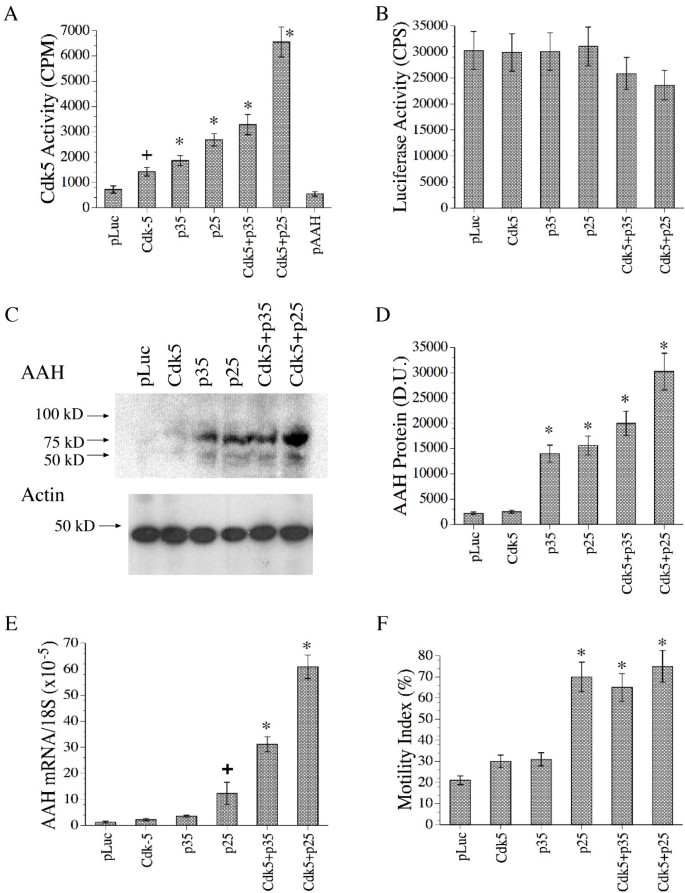
图6显示转染后Cdk-5活性(A)、AAH蛋白(C)、mRNA(E)及细胞运动(F)的变化,Cdk-5+p25组效果最显著。
3.6 Cdk-5下游通路验证
实验目的:确认Cdk-5调控AAH的下游通路。
方法细节:转染Cdk-5+p25质粒36小时后,预处理Erk抑制剂(PD98059)或PI3K抑制剂(LY294002)1小时,48小时后通过实时定量RT-PCR检测AAH、Humbug mRNA。
结果解读:两种抑制剂显著抑制Cdk-5+p25诱导的AAH/Humbug mRNA增加(P<0.001),提示Cdk-5通过Erk和PI3K通路发挥作用。
产品关联:抑制剂购自CalBiochem。
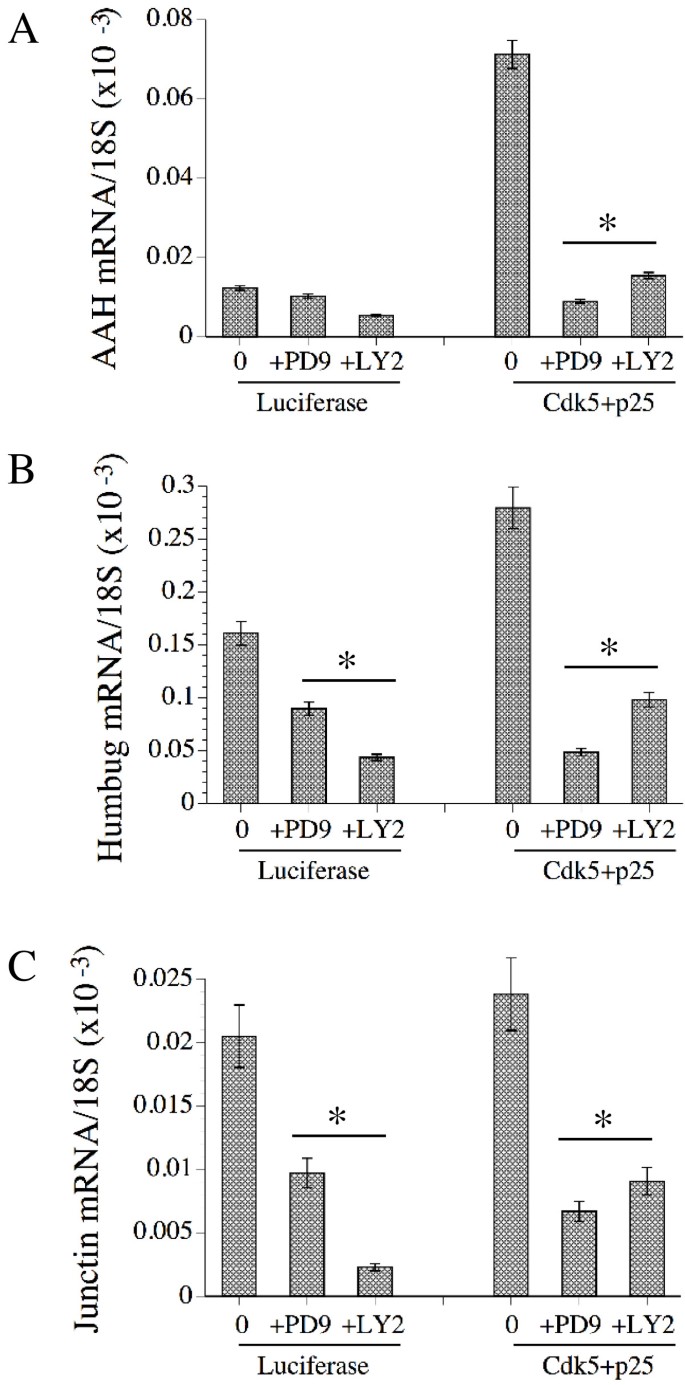
图8显示抑制剂对Cdk-5+p25诱导的AAH(A)、Humbug(B)mRNA的抑制作用。
4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
本研究中AAH(mRNA/蛋白)和Humbug(mRNA)是神经母细胞瘤的潜在Biomarker,筛选/验证逻辑为:
1. 筛选:通过实时定量RT-PCR比较肿瘤细胞与正常脑组织的表达,发现AAH/Humbug在肿瘤中高表达;
2. 验证:通过生长因子刺激、信号通路实验,确认其受胰岛素/IGF-1和Cdk-5通路调控;
3. 功能验证:通过过表达实验,明确AAH与细胞运动的直接关联。
研究过程与核心成果
Biomarker来源:SH-Sy5y、PNET细胞及正常脑组织的RNA/蛋白;
验证方法:实时定量RT-PCR(mRNA)、Western blot/MICE(蛋白)、细胞运动 assay(功能);
特异性与敏感性:SH-Sy5y细胞中AAH mRNA水平是正常成人脑的10倍(n=6,P<0.001),Humbug是正常脑的8倍(P<0.001);AAH蛋白在胰岛素/IGF-1刺激后增加2倍(MICE指数,P<0.001)。
核心成果:
- 功能关联:AAH高表达与神经母细胞瘤细胞运动能力增强直接相关,可作为预测肿瘤侵袭性的Biomarker;
- 创新性:首次揭示AAH受胰岛素/IGF-1和Cdk-5通路协同调控,为靶向AAH或其调控通路(如抑制Cdk-5、Erk)治疗神经母细胞瘤提供新策略;
- 数据支持:AAH过表达使细胞运动增加40%(n=6,P<0.001),Cdk-5+p25转染使AAH表达增加3倍(P<0.001)、运动增加50%(P<0.001)。
本研究系统解析了神经母细胞瘤中AAH家族的调控网络,为神经肿瘤的分子诊断和靶向治疗提供了重要依据。
