1. 领域背景与文献引入
文献英文标题:Angiogenic ability of human endothelial cells was decreased following senescence induction with hydrogen peroxide: possible role of vegfr-2/akt-1 signaling pathway;发表期刊:BMC Molecular and Cell Biology;影响因子:未公开;研究领域:血管生物学(衰老相关血管功能障碍)
血管生成是从现有血管网络形成新血管的动态过程,参与胚胎发育、伤口愈合等生理过程,同时也是心血管疾病、癌症等病理进程的关键驱动因素。内皮细胞(ECs)作为血管内膜的单层细胞,其功能完整性直接决定血管生成能力——内皮细胞迁移、细胞外基质(ECM)重塑及一氧化氮(NO)生成等表型均是血管生成的核心环节。然而,衰老可诱导内皮细胞功能障碍,导致血管生成能力下降,进而引发心血管疾病等年龄相关疾病。目前研究已证实,氧化应激(如过氧化氢,H₂O₂)是衰老的重要驱动因素,可通过诱导细胞衰老影响内皮功能,但H₂O₂如何通过具体信号通路调控内皮细胞血管生成能力仍不明确,尤其是VEGFR-2/Akt-1这一血管生成核心通路的作用尚未系统验证。
本研究针对上述空白,以人脐静脉内皮细胞(HUVECs)为模型,探究H₂O₂诱导衰老后内皮细胞血管生成能力的变化及VEGFR-2/Akt-1通路的调控作用,为衰老相关血管疾病的机制研究提供了新的实验依据。
2. 文献综述解析
作者对现有研究的评述逻辑围绕“血管生成调控-氧化应激与衰老-现有研究局限性”展开:
现有研究表明,血管生成受多因子协同调控——VEGFR-2是血管内皮生长因子(VEGF)的核心受体,其下游Akt-1通路可调控内皮细胞迁移、NO生成等过程;Ang-1/Ang-2比值平衡维持血管稳定性;miR-126通过抑制VEGFR-2负调控因子(如SPRED1)促进血管生成。同时,H₂O₂作为氧化应激诱导剂,可通过增加活性氧(ROS)水平诱导细胞衰老,但现有研究多关注动物模型或肿瘤细胞,缺乏内皮细胞体外模型的深入研究,且未系统关联H₂O₂与VEGFR-2/Akt-1通路的关系。
本研究的创新点在于:① 以HUVECs为体外模型,模拟人类内皮细胞衰老过程;② 通过“表型-分子-通路”多层面检测(如伤口愈合、miRNA表达、蛋白磷酸化),首次系统验证H₂O₂诱导衰老后内皮细胞血管生成能力下降与VEGFR-2/Akt-1通路抑制的关联;③ 揭示miR-126、LOX等新因子的参与,填补了氧化应激诱导血管生成障碍的机制空白。
3. 研究思路总结与详细解析
本研究遵循“模型构建-表型检测-分子验证-通路分析”的闭环思路,核心目标是明确H₂O₂诱导衰老对内皮细胞血管生成的影响及VEGFR-2/Akt-1通路的作用。具体步骤如下:
3.1 细胞模型构建与衰老诱导
实验目的是建立H₂O₂诱导的内皮细胞衰老模型。方法:选取3-6代HUVECs(避免细胞自发衰老),接种后用100μM H₂O₂处理24小时(诱导氧化应激性衰老),对照组用不含H₂O₂的培养基处理,所有实验重复3次。结果:通过作者既往研究(未在本文提供数据)验证,该处理可显著增加SA-β-gal染色阳性细胞比例(衰老标志物),成功构建衰老模型。
实验所用关键试剂:H₂O₂(分析纯)、HUVECs培养基(高糖DMEM+10%FBS+1%青霉素/链霉素);领域常规使用Pasture(伊朗)来源的HUVECs。
3.2 血管生成表型检测
实验目的是评估H₂O₂对内皮细胞血管生成相关表型的影响,包括细胞迁移(伤口愈合)、ECM重塑(LOX活性)及内皮功能(NO生成)。
方法与结果:
1. 伤口愈合实验:将HUVECs培养至融合单层,用100μl枪头划痕,0、24、48小时拍摄图像。结果显示,H₂O₂处理组24小时伤口愈合率显著低于对照组(P<0.05),48小时下降更明显(P<0.01),表明细胞迁移能力降低。
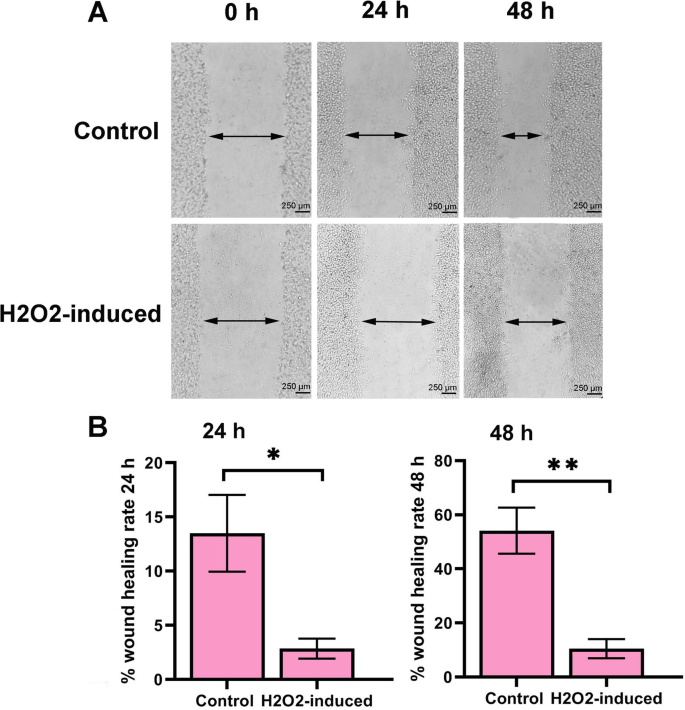
图1 伤口愈合实验结果(n=3,P<0.05,P<0.01)。
2. LOX活性检测:用比色法试剂盒(KIAZIST,伊朗)检测细胞裂解液中LOX酶活性。结果显示,处理组LOX活性较对照组下降23.5%(0.765±0.106倍,P<0.05),提示ECM重塑能力受损。
3. NO浓度检测*:用Griess试剂法检测细胞裂解液中NO代谢产物(硝酸盐/亚硝酸盐)。结果显示,处理组NO浓度显著下降(P<0.05),反映内皮功能障碍。
< img src="https://media.springernature.com/lw685/springer-static/image/art%3A10.1186%2Fs12860-022-00435-4/MediaObjects/12860_2022_435_Fig2_HTML.png">图2 LOX活性(A)和NO浓度(B)结果(n=3,*P<0.05)。
3.3 血管生成相关分子表达分析
实验目的是检测H₂O₂对血管生成相关miRNA(miR-126、miR-373)和基因(VEGFR-2、Ang-1、Ang-2、HSP-70)的影响。
方法与结果:
1. RNA提取与qPCR:用TRIzol(Invitrogen)提取总RNA,反转录合成cDNA后,用SYBR-green master mix进行qPCR(以GAPDH为内参)。结果显示:
- miRNA:miR-126(促血管生成miRNA)表达下调29.5%(1.087±0.09 vs 0.746±0.14,P<0.05),miR-373(调控细胞增殖)表达上调11.7%(1.023±0.069 vs 1.143±0.053,P<0.05);
- 基因:VEGFR-2(血管生成核心受体)mRNA下调37%(1.066±0.1 vs 0.6727±0.1,P<0.05),Ang-1(稳定血管)、Ang-2( destabilize血管)、HSP-70(应激蛋白)分别上调34.4%、25.6%、46.7%(均P<0.01);Ang-2/Ang-1比值下降21.2%(P<0.05),提示血管稳定性降低。
< img src="https://media.springernature.com/lw685/springer-static/image/art%3A10.1186%2Fs12860-022-00435-4/MediaObjects/12860_2022_435_Fig3_HTML.png">图3 基因表达结果(n=3,P<0.05,*P<0.01)。
3.4 VEGFR-2/Akt-1通路蛋白检测
实验目的是验证H₂O₂对VEGFR-2下游通路及相关蛋白(VCAM-1、MMP-9、IL-6)的影响。
方法与结果:
1. 免疫印迹:用RIPA裂解液提取总蛋白,经SDS-PAGE分离后转移至PVDF膜,用一抗(VCAM-1、MMP-9、IL-6、Akt-1、β-actin)孵育,HRP二抗显影。结果显示:
- p-Akt-1(Akt-1磷酸化形式,通路激活标志)下调19%(1.15±0.049 vs 0.93±0.05,P<0.05);
- VCAM-1(细胞黏附分子)、MMP-9(ECM降解酶)、IL-6(促炎因子)分别下调50.4%、47.6%、37.4%(均P<0.05)。
< img src="https://media.springernature.com/lw685/springer-static/image/art%3A10.1186%2Fs12860-022-00435-4/MediaObjects/12860_2022_435_Fig4_HTML.png">图4 蛋白表达结果(n=3,*P<0.05)。
实验所用关键抗体:VCAM-1(sc-393859)、MMP-9(sc-28343)、IL-6(sc-47778)、Akt-1(sc-293125)、β-actin(ab134047)(文献未明确品牌,领域常规使用Santa Cruz、Abcam等)。
4. Biomarker研究及发现成果解析
本研究涉及的Biomarker均为血管生成与衰老的关键分子,包括:miR-126(内皮特异性促血管生成miRNA)、VEGFR-2(血管生成核心受体)、p-Akt-1(VEGFR-2下游信号分子)、LOX(ECM重塑酶)、NO(内皮功能指标)。这些Biomarker的筛选基于“文献调研-功能关联”逻辑——先选取已知与血管生成密切相关的分子,再验证其与H₂O₂诱导表型的关联。
研究过程详述
- 来源:Biomarker均来自HUVECs细胞裂解液(如miR-126、VEGFR-2、p-Akt-1)或培养上清(如NO);
- 验证方法:qPCR(miR-126、VEGFR-2)、比色法(LOX、NO)、Western blot(p-Akt-1);
- 特异性与敏感性:miR-126下调29.5%(P<0.05,n=3),VEGFR-2 mRNA下调37%(P<0.05,n=3),p-Akt-1蛋白下调19%(P<0.05,n=3),LOX活性下降23.5%(P<0.05,n=3),NO浓度下降(统计显著,P<0.05)。
核心成果提炼
- 功能关联:这些Biomarker的变化直接导致血管生成能力下降——miR-126下调抑制VEGFR-2表达,进而抑制Akt-1磷酸化,导致下游VCAM-1(细胞黏附)、MMP-9(ECM降解)、IL-6(促炎)等蛋白下调;LOX活性下降影响ECM重塑,NO浓度下降反映内皮功能障碍,共同导致细胞迁移能力降低(伤口愈合率下降)。
- 创新性:首次证实miR-126、LOX与VEGFR-2/Akt-1通路共同参与H₂O₂诱导的血管生成障碍,为衰老相关血管疾病提供了新的Biomarker组合(如miR-126+VEGFR-2+p-Akt-1)。
- 统计学意义:所有Biomarker的变化均有显著统计学差异(P<0.05或P<0.01),样本量n=3,结果可靠。
综上,本研究通过体外模型系统揭示了H₂O₂诱导衰老后内皮细胞血管生成能力下降的机制——VEGFR-2/Akt-1通路抑制是核心,miR-126、LOX、NO等因子共同参与,为衰老相关血管疾病的治疗提供了潜在靶点(如恢复miR-126表达或激活Akt-1通路)。
