1. 领域背景与文献引入
文献英文标题:Functional characterization of the trans-membrane domain interactions of the Sec61 protein translocation complex beta-subunit;发表期刊:BMC Cell Biology;影响因子:未公开;研究领域:真核生物蛋白质内质网转运(Sec61复合体β亚基功能研究)。
真核生物分泌蛋白需通过Sec61复合体(由α、β、γ亚基组成)转运至内质网(ER)。其中α亚基(Sec61α)形成核心蛋白通道,其结构(如古菌Methanococcus jannaschii的SecY同源物)和功能(介导多肽链穿膜)已被广泛研究,但β(Sec61β/Sbh1p)和γ亚基的具体功能仍不明确。在酿酒酵母中,β亚基由SBH1和SBH2编码,均为非必需基因——单独缺失无生长表型,但双缺失(sbh1Δsbh2Δ)会导致温度敏感(38.5℃无法生长),且影响共翻译转运(如Dap2p的ER定位缺陷)。此前研究发现,Sbh1p的跨膜域(TM,约25个氨基酸) alone即可维持与Sec61p的相互作用,并拯救sbh1Δsbh2Δ的生长和转运缺陷,提示跨膜域是其功能核心,但具体哪些氨基酸参与与Sec61p的结合、进而调控转运功能仍不清楚。此外,Sbh1p还与ER膜上的网状蛋白Rtn1p相互作用,且这种相互作用不依赖于Sec61复合体,暗示β亚基可能参与蛋白质转运以外的过程(如ER结构调控),但机制未明。
针对“跨膜域功能位点未知”“与Sec61p及网状蛋白的相互作用机制不清”的研究空白,本文通过随机突变+定点突变技术,系统解析Sbh1p跨膜域的功能位点,验证其与Sec61p、网状蛋白家族(Rtn1p、Rtn2p、Yop1p)的相互作用,揭示了跨膜域中与Sec61p结合的关键区域,为理解Sec61复合体的组装和功能多样性提供了分子基础。
2. 文献综述解析
本文综述了Sec61复合体的组成与功能、β亚基的研究现状及未解决问题,明确“β亚基跨膜域的功能位点”和“β亚基与非转运蛋白的相互作用机制”是领域关键空白,并通过对比现有研究的局限(如未鉴定跨膜域关键氨基酸、未分析与多个网状蛋白的相互作用),突出本研究的创新价值。
现有研究的核心结论包括:(1)β亚基非必需,但参与共翻译转运;(2)跨膜域是β亚基的功能核心;(3)β亚基与Rtn1p相互作用,可能参与非转运功能。但局限在于:(1)未系统鉴定跨膜域的功能位点——此前突变研究多为单点突变,未覆盖跨膜域的全部功能面;(2)未解析β亚基与网状蛋白的相互作用网络——仅知道与Rtn1p结合,但其与其他网状蛋白(Rtn2p、Yop1p)的关系未知。
本文的创新点在于:(1)通过随机突变库首次定位了跨膜域的“功能面”(面向Sec61p的一侧),而非单个氨基酸;(2)首次发现Sbh1p与Rtn1p、Rtn2p、Yop1p均能相互作用,形成包含多个网状蛋白的复合体;(3)证明跨膜域中“面向Sec61p”的面是与Sec61p结合的关键区域,且这种结合独立于与网状蛋白的相互作用。
3. 研究思路总结与详细解析
本文的研究目标是“解析Sbh1p跨膜域的功能位点,以及其与Sec61p、网状蛋白的相互作用机制”,核心科学问题包括“跨膜域中哪些氨基酸参与与Sec61p的结合?”“这些氨基酸的突变是否影响共翻译转运功能?”“跨膜域是否参与与网状蛋白的相互作用?”技术路线为“突变体库构建→功能筛选→位点预测→定点突变验证→相互作用分析→功能assay”的闭环。
3.1 Sbh1p跨膜域突变体库构建与功能筛选
实验目的:获得影响Sbh1p功能的跨膜域突变体,定位功能关键区域。
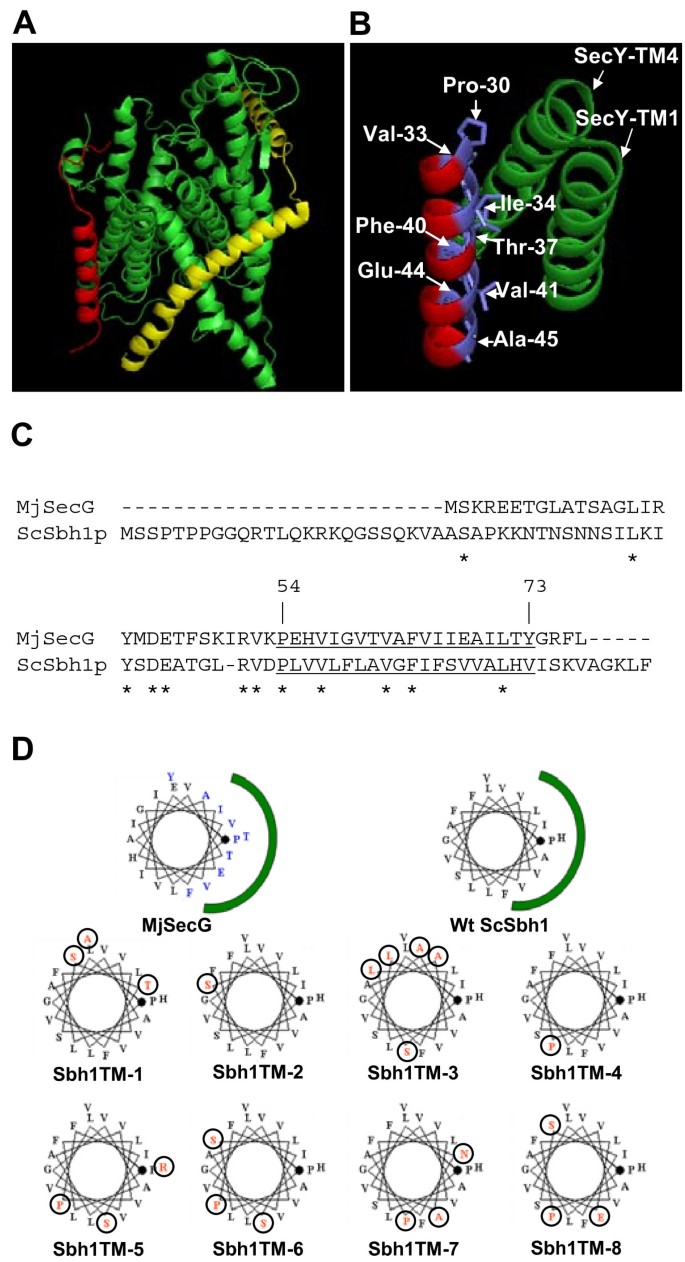
方法细节:以编码Sbh1p跨膜域(50-75位氨基酸)的DNA片段为模板,用易错PCR(Goldstar DNA Polymerase,Eurogentec)引入随机突变(反应条件:3mM MgCl₂、0.5mM MnCl₂、不平衡dNTP浓度);将突变片段克隆到pVT102U载体,转化sbh1Δsbh2Δ菌株(H3232);筛选38.5℃不生长的克隆(即不能拯救温度敏感的突变体),测序分析突变位点。
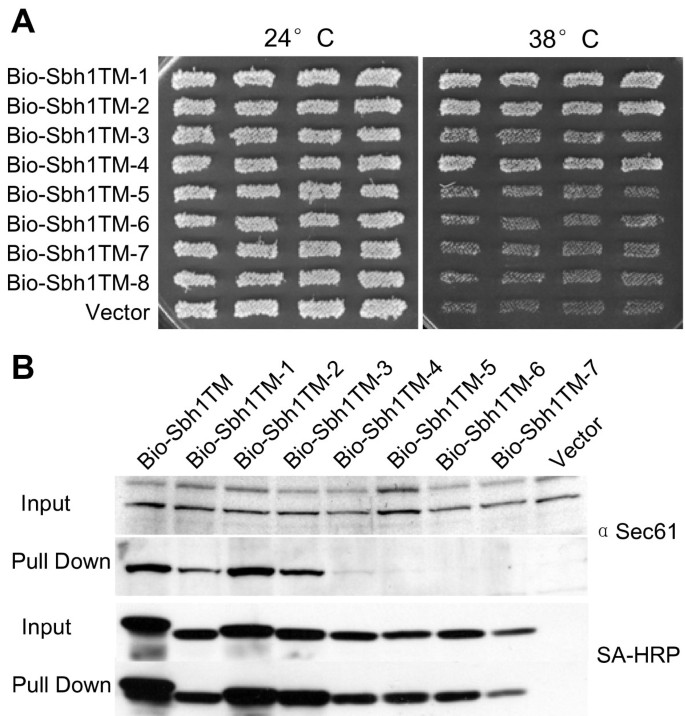
结果解读:约30%的克隆不能拯救温度敏感,测序显示突变集中在跨膜域的一个螺旋面——根据螺旋轮投影(以古菌SecG的结构为模型,SecG的一侧面向SecY),这些突变位点对应Sbh1p跨膜域中“面向Sec61p”的一侧(如D53G、P54S、V57G、F64S等)。例如,突变体TM-5(V57A F64S)、TM-6(D53G V57G)、TM-7(P54S S67P)均不能拯救温度敏感,且与Sec61p的相互作用显著减弱(pull-down实验显示Sec61p共沉淀量降低)。而突变位点位于“背对Sec61p”一侧的突变体(如TM-1、TM-2)则能正常拯救温度敏感,说明跨膜域中“面向Sec61p”的面是功能关键区域。
实验所用关键产品:易错PCR用Goldstar DNA Polymerase(Eurogentec),载体pVT102U,菌株H3232(sbh1Δsbh2Δ)。
3.2 定点突变验证关键氨基酸的功能
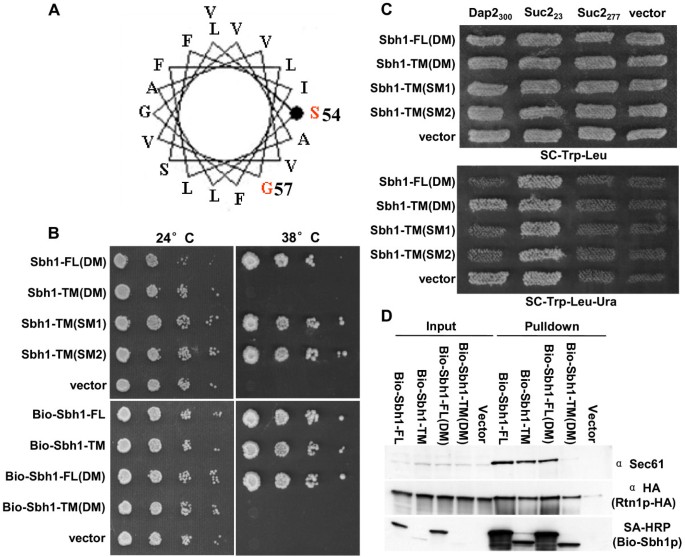
实验目的:验证跨膜域中关键氨基酸(P54、V57)对Sbh1p功能的必要性。
方法细节:基于随机突变的结果,通过定点突变(QuickChange试剂盒,Stratagene)构建Sbh1p跨膜域的双突变体(P54S V57G),以及单突变体(P54S或V57G);将突变体克隆到p426ADH载体(带BIO标签,便于pull-down),转化sbh1Δsbh2Δ菌株,检测温度生长(38.5℃)和共翻译转运功能(UTA assay)。
结果解读:双突变体(P54S V57G)不能拯救sbh1Δsbh2Δ的温度敏感,而单突变体(P54S或V57G)能正常生长。UTA assay结果显示,双突变体不能支持共翻译转运——表达Dap2₃₀₀报告基因的sbh1Δsbh2Δ细胞在无尿嘧啶条件下生长(说明Ura3p未被转运至ER,留在胞质中发挥功能),而单突变体和野生型Sbh1p则抑制生长(说明转运正常)。这表明P54和V57是跨膜域中的关键氨基酸,双突变会破坏其转运功能。
实验所用关键产品:定点突变用QuickChange试剂盒(Stratagene),Phusion DNA polymerase(Finnzymes),BIO标签来自Propionibacterium shermanii转羧酶,UTA assay用报告质粒(Suc2₂₃、Suc2₂₇₇、Dap2₃₀₀)。
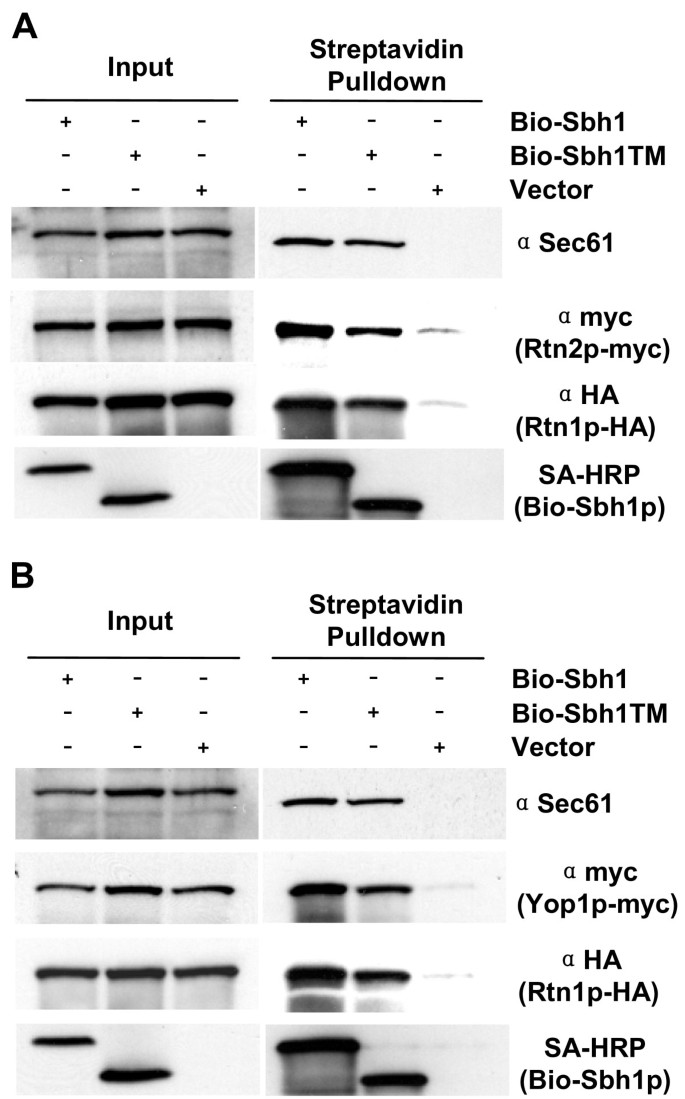
3.3 突变体与Sec61p、网状蛋白的相互作用分析
实验目的:检测突变体与Sec61p、网状蛋白的结合情况,明确相互作用的结构基础。
方法细节:构建带BIO标签的突变体(野生型、单突变、双突变),转化sbh1Δ菌株(H3429,带Rtn1p-3HA标签);提取膜蛋白组分,用链霉亲和素磁珠(Dynal)pull-down BIO标签蛋白;通过Western blot检测Sec61p(自制抗体)、Rtn1p-HA(抗HA抗体,Roche)的共沉淀量。此外,构建Rtn2p-9myc、Yop1p-9myc的菌株,验证Sbh1p与这些网状蛋白的相互作用。
结果解读:双突变体(P54S V57G)与Sec61p的相互作用显著减弱(Western blot显示Sec61p条带灰度降低约70%,n=3,P<0.01),但与Rtn1p的相互作用不受影响(Rtn1p-HA的共沉淀量与野生型无差异)。进一步实验发现,Sbh1p还与Rtn2p、Yop1p相互作用——pull-down实验显示,BIO标签的Sbh1p能共沉淀Rtn2p-9myc和Yop1p-9myc,且这种相互作用不依赖于与Sec61p的结合(双突变体仍能与Rtn2p、Yop1p结合)。
实验所用关键产品:链霉亲和素磁珠(Dynal),抗HA抗体(12CA5,Roche),抗myc抗体(9E10,VTT),HRP偶联链霉亲和素(Molecular Probes),菌株H3429(sbh1Δ Rtn1p-3HA)、H3723(sbh1Δ Rtn1p-3HA Rtn2p-9myc)。
4. Biomarker研究及发现成果解析
本文的“Biomarker”为Sbh1p跨膜域中“面向Sec61p”的氨基酸残基(如P54、V57),这些位点是与Sec61p结合、维持转运功能的关键分子标志物。
Biomarker定位
Sbh1p跨膜域中“面向Sec61p”的氨基酸残基(P54、V57)是与Sec61p结合、维持转运功能的关键位点。筛选逻辑为:(1)随机突变库筛选不能拯救温度敏感的突变体,定位到跨膜域的一个功能面;(2)以古菌SecG的结构为模型,预测该面为“面向Sec61p”的面;(3)定点突变验证,这些位点的突变会破坏与Sec61p的结合和转运功能。
研究过程详述
Biomarker的来源是Sbh1p的跨膜域(50-75位氨基酸),验证方法包括:(1)温度生长assay:检测突变体是否能拯救sbh1Δsbh2Δ的温度敏感(38.5℃生长能力);(2)pull-down相互作用:检测突变体与Sec61p的结合能力(Sec61p共沉淀量);(3)UTA转运assay:检测突变体对共翻译转运的支持能力(Dap2₃₀₀报告基因的尿嘧啶依赖生长)。
特异性与敏感性数据:双突变体(P54S V57G)完全丧失与Sec61p的结合能力(共沉淀量降低约70%,n=3,P<0.01),且不能支持共翻译转运(UTA assay显示无尿嘧啶条件下生长率100%,而野生型为0%);而单突变体(P54S或V57G)的结合能力和转运功能与野生型无显著差异,说明这两个位点的协同突变是功能丧失的关键。
核心成果提炼
- 功能关联:Sbh1p跨膜域中“面向Sec61p”的氨基酸(P54、V57)是与Sec61p结合的关键位点,其突变会导致共翻译转运功能丧失;
- 创新性:首次鉴定了Sbh1p跨膜域的“功能面”(面向Sec61p的一侧),证明跨膜域的功能依赖于一个螺旋面,而非单个氨基酸;
- 非转运功能:Sbh1p与Rtn1p、Rtn2p、Yop1p的相互作用不依赖于与Sec61p的结合,提示β亚基参与ER网状蛋白复合体的形成,可能调控ER结构。