1. 领域背景与文献引入
文献英文标题:circRNA_0005529 facilitates growth and metastasis of gastric cancer via regulating miR-527/Sp1 axis;发表期刊:BMC Molecular and Cell Biology;影响因子:未公开;研究领域:胃癌分子生物学、非编码RNA调控机制
胃癌是全球范围内发病率和死亡率均位居前列的恶性肿瘤,尽管化疗、手术切除及分子靶向治疗等手段已取得一定进展,但肿瘤的复发与转移仍导致患者5年总体生存率较低,其复杂的发病机制尚未完全阐明,亟需挖掘新的分子靶点以改善治疗效果。非编码RNA尤其是环状RNA(circRNA)作为近年来的研究热点,其通过海绵吸附微小RNA(miRNA)调控靶基因表达的模式被广泛证实参与肿瘤的发生发展过程。目前已有多项研究报道circRNA在胃癌中发挥关键调控作用,但circRNA_0005529(circ_0005529)在胃癌中的生物学功能及调控机制尚未被阐明。同时,miR-527在不同肿瘤中呈现出功能异质性,其在胃癌中的作用尚不明确;转录因子特异性蛋白1(Sp1)在多种肿瘤中高表达并与不良预后相关,但其在胃癌中的上游非编码RNA调控机制仍有待探索。在此背景下,本研究旨在系统解析circ_0005529/miR-527/Sp1轴在胃癌增殖与转移中的调控作用及分子机制,为胃癌的诊断与治疗提供新的潜在靶点。
2. 文献综述解析
作者以非编码RNA(circRNA、miRNA)-转录因子(Sp1)的调控层级为分类维度,系统梳理了胃癌中circRNA的调控模式、miR-527在不同肿瘤中的功能差异及Sp1的致癌作用与调控机制,明确了当前领域中circ_0005529功能未知、miR-527在胃癌中作用不明、Sp1上游非编码RNA调控机制缺失的研究空白。
现有研究的关键结论显示,circRNA可通过海绵吸附miRNA调控靶基因表达,进而参与胃癌的增殖、转移等生物学过程,例如circPIP5K1A通过靶向miR-376c-3p上调ZNF146、circLMTK2通过海绵miR-150-5p上调c-Myc,均促进胃癌进展;miR-527在低级别胶质瘤中高表达,而在肺癌中通过靶向BRF2抑制细胞增殖与迁移;Sp1作为广泛表达的转录因子,在甲状腺癌、胰腺癌、乳腺癌等多种肿瘤中高表达,与肿瘤的转移潜能及不良预后密切相关,在胃癌中也呈现高表达状态并参与肿瘤发生发展。现有研究的技术方法优势在于,高通量测序与生物信息学分析的结合能够快速筛选出肿瘤组织中差异表达的circRNA,为后续功能研究提供候选分子;但局限性也较为明显,针对circ_0005529在胃癌中的功能研究处于空白状态,miR-527在胃癌中的作用尚未被报道,Sp1在胃癌中的上游非编码RNA调控机制也未被阐明。本研究的创新价值在于,首次发现circ_0005529在胃癌组织与细胞中高表达,系统阐明了其通过海绵吸附miR-527上调Sp1表达,进而促进胃癌细胞增殖与转移的分子机制,完善了胃癌中circRNA-miRNA-转录因子的调控网络,为胃癌的分子靶向治疗提供了新的潜在靶点。
3. 研究思路总结与详细解析
本研究的核心目标是明确circ_0005529在胃癌中的生物学功能及调控机制,核心科学问题为circ_0005529如何调控胃癌细胞的增殖与转移过程,技术路线遵循“临床样本筛选差异分子→细胞功能实验验证作用→生物信息学预测+实验验证靶向关系→rescue实验验证调控轴→体内动物模型验证功能”的完整闭环,逻辑严谨,证据链完整。
3.1 临床样本与细胞系中circ_0005529的表达验证
实验目的:检测circ_0005529在胃癌组织、癌旁组织及胃癌细胞系中的表达水平,分析其表达与胃癌患者临床病理参数及预后的关系,明确其亚细胞定位及环状结构稳定性。
方法细节:收集63对胃癌患者的肿瘤组织及癌旁正常组织样本,采用实时荧光定量PCR(qRT-PCR)检测circ_0005529的相对表达量;检测人正常胃黏膜上皮细胞GES-1及4种胃癌细胞系(HGC-27、MGC803、AGS、MKN-45)中circ_0005529的表达;采用RNase R处理细胞RNA,验证circ_0005529的环状结构稳定性;通过RNA荧光原位杂交(FISH)检测circ_0005529在胃癌细胞中的亚细胞定位;采用Kaplan-Meier法分析circ_0005529表达与胃癌患者总生存率的关系。
结果解读:qRT-PCR结果显示,胃癌组织中circ_0005529的相对表达量显著高于癌旁组织(n=63,P<0.01);高表达circ_0005529的胃癌患者总生存率显著低于低表达患者,且其表达与肿瘤低分化、高TNM分期及侵袭性呈正相关;胃癌细胞系中circ_0005529的表达水平均显著高于GES-1细胞,其中MKN-45细胞表达最高,HGC-27细胞表达最低;RNase R处理后,线性VPS33B mRNA的表达被显著降解,而circ_0005529的表达不受影响,证实其环状结构稳定性;FISH结果显示circ_0005529主要定位于胃癌细胞的细胞质中。

产品关联:实验所用关键产品:TRIzol试剂(Thermo Fisher Scientific)、PrimeScript RT Reagent Kit(Takara)、SYBR Premix Ex Taq(Takara)、RNase R(Epicentre Technologies)、FISH试剂盒(RiboBio)等。
3.2 circ_0005529对胃癌细胞增殖的调控作用
实验目的:验证circ_0005529对胃癌细胞增殖能力的调控作用,明确其在胃癌细胞增殖中的功能。
方法细节:构建过表达circ_0005529的慢病毒载体(Lv-circ_0005529)并感染HGC-27细胞,构建敲低circ_0005529的慢病毒载体(sh-circ_0005529)并感染MKN-45细胞,采用qRT-PCR验证转染效率;分别采用MTT法、EdU掺入实验、克隆形成实验检测细胞的增殖能力。
结果解读:qRT-PCR结果证实,Lv-circ_0005529可显著上调HGC-27细胞中circ_0005529的表达,sh-circ_0005529可显著下调MKN-45细胞中circ_0005529的表达;MTT法检测显示,过表达circ_0005529后HGC-27细胞的活力在培养96h时显著升高(n=3,P<0.01),敲低circ_0005529后MKN-45细胞的活力显著降低(n=3,P<0.01);EdU掺入实验显示,过表达circ_0005529后HGC-27细胞的EdU阳性率显著升高(n=3,P<0.01),敲低circ_0005529后MKN-45细胞的EdU阳性率显著降低(n=3,P<0.01);克隆形成实验显示,过表达circ_0005529后HGC-27细胞的克隆形成面积占比显著增加(n=3,P<0.01),敲低circ_0005529后MKN-45细胞的克隆形成面积占比显著减少(n=3,P<0.01)。
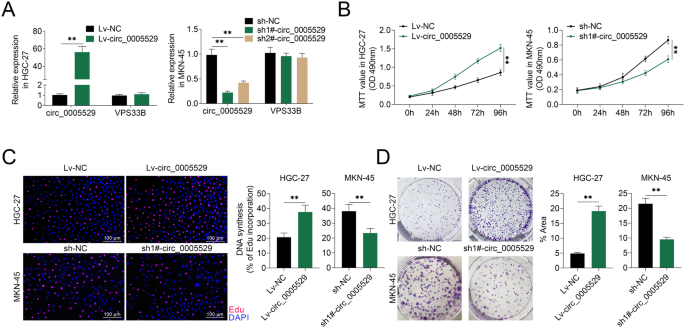
产品关联:实验所用关键产品:慢病毒载体及对照载体(GenePharma)、MTT细胞增殖试剂盒(Beyotime)、Cell-Light EdU DNA Cell Proliferation Kit(RiboBio)等。
3.3 circ_0005529对胃癌细胞迁移侵袭的调控作用
实验目的:验证circ_0005529对胃癌细胞迁移及侵袭能力的调控作用,明确其在胃癌细胞转移中的功能。
方法细节:采用划痕愈合实验检测胃癌细胞的迁移能力;采用Transwell迁移实验及Matrigel包被的Transwell侵袭实验检测胃癌细胞的迁移及侵袭能力。
结果解读:划痕愈合实验显示,过表达circ_0005529后HGC-27细胞的划痕愈合率在24h时显著升高(n=3,P<0.01),敲低circ_0005529后MKN-45细胞的划痕愈合率显著降低(n=3,P<0.01);Transwell迁移实验显示,过表达circ_0005529后HGC-27细胞的穿膜细胞数显著增加(n=3,P<0.01),敲低circ_0005529后MKN-45细胞的穿膜细胞数显著减少(n=3,P<0.01);Transwell侵袭实验显示,过表达circ_0005529后HGC-27细胞的侵袭细胞数显著增加(n=3,P<0.01),敲低circ_0005529后MKN-45细胞的侵袭细胞数显著减少(n=3,P<0.01)。

产品关联:实验所用关键产品:Transwell小室(BD Biosciences)、Matrigel基质胶(BD Biosciences)等。
3.4 circ_0005529与miR-527的靶向结合验证
实验目的:明确circ_0005529是否通过海绵吸附miR-527发挥调控作用,验证两者的靶向结合关系及表达相关性。
方法细节:采用starBase数据库预测circ_0005529的潜在靶miRNA;构建包含circ_0005529序列及突变结合位点的荧光素酶报告质粒,与miR-527模拟物或抑制剂共转染胃癌细胞,通过双荧光素酶报告实验验证靶向结合;采用FISH检测circ_0005529与miR-527在胃癌细胞中的亚细胞定位;采用RNA结合蛋白免疫沉淀(RIP)实验检测两者与Ago2的结合;采用qRT-PCR检测circ_0005529过表达/敲低后miR-527的表达变化;检测63对胃癌组织中miR-527的表达,并采用Pearson相关分析其与circ_0005529表达的相关性。
结果解读:双荧光素酶报告实验显示,miR-527模拟物可显著降低circ_0005529报告质粒的荧光素酶活性(n=3,P<0.01),突变结合位点后荧光素酶活性无显著变化;FISH结果显示circ_0005529与miR-527均定位于胃癌细胞的细胞质中,提示两者存在相互作用的空间基础;RIP实验显示,circ_0005529与miR-527均显著富集于Ago2免疫沉淀复合物中,证实两者通过RNA诱导沉默复合物(RISC)相互作用;qRT-PCR结果显示,过表达circ_0005529可显著下调HGC-27细胞中miR-527的表达(n=3,P<0.01),敲低circ_0005529可显著上调MKN-45细胞中miR-527的表达(n=3,P<0.01);胃癌组织中miR-527的表达显著低于癌旁组织(n=63,P<0.01),且与circ_0005529的表达呈显著负相关(Pearson相关系数r=-0.62,P<0.01)。
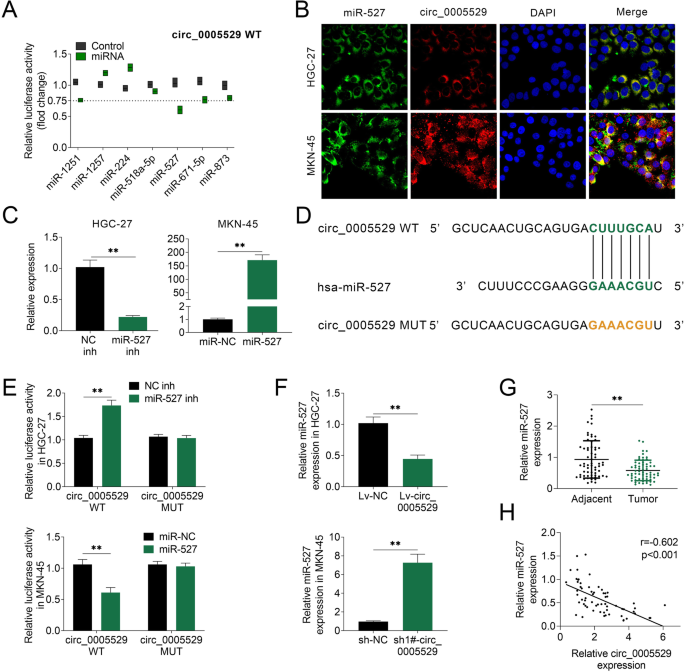
产品关联:实验所用关键产品:双荧光素酶报告系统(Promega)、RIP试剂盒(领域常规使用Magna RIP RNA-Binding Protein Immunoprecipitation Kit)、Ago2抗体(领域常规使用兔抗人Ago2多克隆抗体)等。
3.5 miR-527与Sp1的靶向结合验证
实验目的:验证miR-527是否靶向调控Sp1的表达,明确两者的靶向结合关系及表达相关性。
方法细节:采用Targetscan、mirTarBase、miRwalk数据库预测miR-527的潜在靶基因,取三个数据库的交集得到24个候选基因;构建包含候选基因3"UTR序列的荧光素酶报告质粒,与miR-527模拟物共转染MKN-45细胞,通过双荧光素酶报告实验筛选靶基因;构建包含Sp1 3"UTR序列及突变结合位点的荧光素酶报告质粒,验证miR-527与Sp1的靶向结合;采用qRT-PCR及蛋白质免疫印迹(Western blotting)检测miR-527过表达/敲低后Sp1的表达变化;检测63对胃癌组织中Sp1 mRNA的表达,采用Pearson相关分析其与circ_0005529、miR-527表达的相关性;通过rescue实验验证circ_0005529通过miR-527调控Sp1的表达。
结果解读:双荧光素酶报告实验显示,miR-527模拟物可显著降低Sp1 3"UTR报告质粒的荧光素酶活性(n=3,P<0.01),突变结合位点后荧光素酶活性无显著变化;qRT-PCR及Western blotting结果显示,过表达miR-527可显著下调HGC-27细胞中Sp1的mRNA及蛋白表达(n=3,P<0.01),敲低miR-527可显著上调MKN-45细胞中Sp1的mRNA及蛋白表达(n=3,P<0.01);胃癌组织中Sp1 mRNA的表达显著高于癌旁组织(n=63,P<0.01),且与circ_0005529的表达呈显著正相关(Pearson相关系数r=0.58,P<0.01),与miR-527的表达呈显著负相关(Pearson相关系数r=-0.55,P<0.01);rescue实验显示,过表达circ_0005529可上调Sp1的蛋白表达,同时过表达miR-527可逆转该上调作用;敲低circ_0005529可下调Sp1的蛋白表达,同时敲低miR-527可逆转该下调作用。
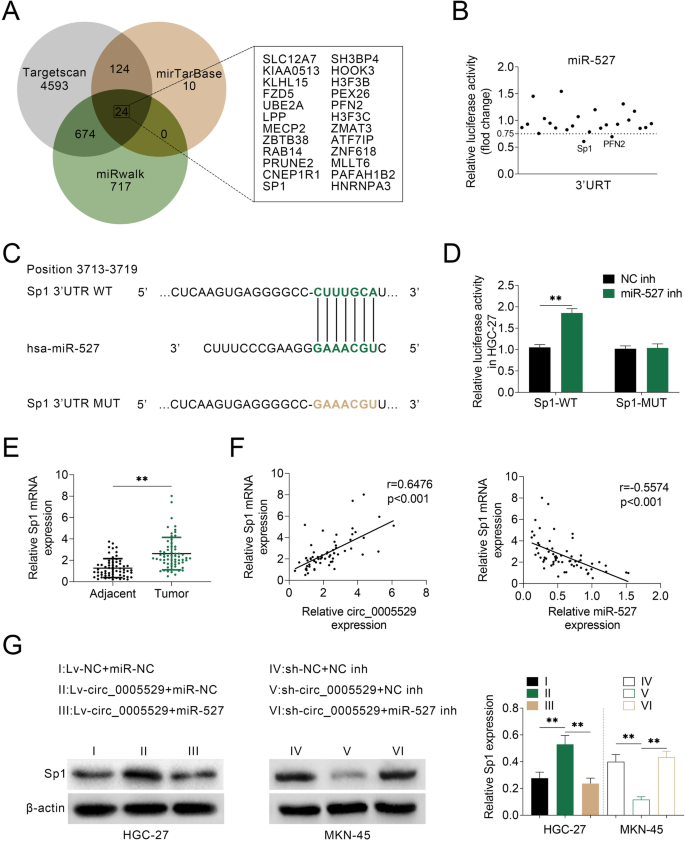
产品关联:实验所用关键产品:Western blotting相关试剂(RIPA裂解液、BCA蛋白定量试剂盒、ECL发光试剂盒,分别来自Sigma-Aldrich、Thermo Fisher Scientific、GE Healthcare)、Sp1抗体(领域常规使用鼠抗人Sp1单克隆抗体)等。
3.6 circ_0005529通过Sp1调控胃癌细胞增殖迁移的验证
实验目的:验证circ_0005529对胃癌细胞增殖与迁移的调控作用是否依赖于Sp1,明确Sp1在circ_0005529调控通路中的下游介导作用。
方法细节:构建过表达Sp1的质粒并转染MKN-45细胞,采用Western blotting验证转染效率;在MKN-45细胞中同时敲低circ_0005529并过表达Sp1,采用MTT法、EdU掺入实验、克隆形成实验检测细胞增殖能力,采用划痕愈合实验、Transwell迁移侵袭实验检测细胞迁移侵袭能力;采用Western blotting检测增殖相关蛋白(PCNA、c-myc)及上皮间质转化(EMT)相关蛋白(E-cadherin、N-cadherin)的表达变化。
结果解读:Western blotting结果证实,过表达质粒可显著上调MKN-45细胞中Sp1的蛋白表达;MTT法检测显示,敲低circ_0005529可显著抑制MKN-45细胞的活力,过表达Sp1可逆转该抑制作用(n=3,P<0.01);EdU掺入实验显示,敲低circ_0005529可显著降低MKN-45细胞的EdU阳性率,过表达Sp1可逆转该降低作用(n=3,P<0.01);克隆形成实验显示,敲低circ_0005529可显著减少MKN-45细胞的克隆形成面积占比,过表达Sp1可逆转该减少作用(n=3,P<0.01);划痕愈合实验显示,敲低circ_0005529可显著降低MKN-45细胞的划痕愈合率,过表达Sp1可逆转该降低作用(n=3,P<0.01);Transwell迁移侵袭实验显示,敲低circ_0005529可显著减少MKN-45细胞的迁移及侵袭细胞数,过表达Sp1可逆转该减少作用(n=3,P<0.01);Western blotting结果显示,敲低circ_0005529可显著下调PCNA、c-myc、N-cadherin的表达,上调E-cadherin的表达,过表达Sp1可逆转这些蛋白的表达变化(n=3,P<0.01)。
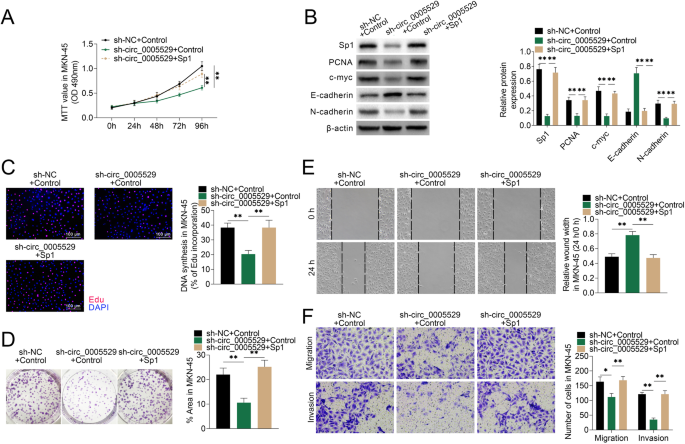
产品关联:实验所用关键产品:Sp1过表达质粒(GenePharma)、Western blotting相关抗体(PCNA、c-myc、E-cadherin、N-cadherin抗体,领域常规使用商业化单克隆抗体)等。
3.7 体内动物模型验证circ_0005529的作用
实验目的:验证circ_0005529在体内对胃癌生长与转移的调控作用,明确其在体内的生物学功能。
方法细节:构建裸鼠皮下移植瘤模型,将稳定转染sh-circ_0005529或sh-NC的MKN-45细胞(携带荧光素酶标记)分别皮下接种于BALB/c裸鼠,每3天监测肿瘤体积,接种21天后处死小鼠并取出肿瘤,称重并采用免疫组化(IHC)检测肿瘤组织中Sp1、Ki67、E-cadherin的表达;构建裸鼠肺转移模型,将稳定转染sh-circ_0005529或sh-NC的MKN-45细胞尾静脉注射于裸鼠,接种30天后采用活体成像系统检测肺转移灶,处死小鼠后取出肺组织,采用H&E染色分析病理变化。
结果解读:皮下移植瘤模型显示,sh-circ_0005529组小鼠的肿瘤体积及重量均显著小于sh-NC组(n=6,P<0.01);IHC结果显示,sh-circ_0005529组肿瘤组织中Sp1、Ki67的表达显著下调,E-cadherin的表达显著上调(n=6,P<0.01);肺转移模型显示,sh-circ_0005529组小鼠的肺转移灶荧光信号显著弱于sh-NC组,H&E染色显示sh-circ_0005529组小鼠肺组织中的肿瘤结节面积显著小于sh-NC组(n=6,P<0.01)。
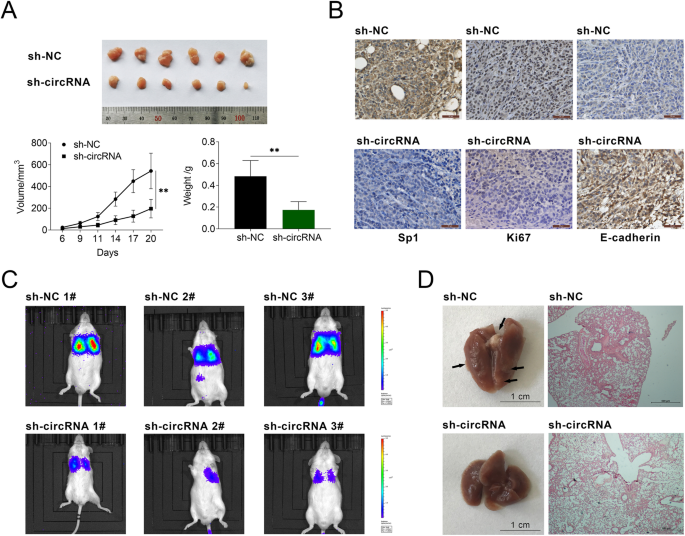
产品关联:实验所用关键产品:BALB/c裸鼠(Vital River Labs)、活体成像系统(PerkinElmer IVIS Lumina XR III)、IHC试剂盒(DAB显色液来自Sigma-Aldrich)等。
4. Biomarker研究及发现成果解析
本研究涉及的Biomarker包括circ_0005529、miR-527、Sp1,筛选与验证逻辑为:基于公共芯片数据筛选差异表达circRNA→临床样本与细胞系验证表达差异→生物信息学预测靶向关系→细胞实验验证结合作用→临床样本验证表达相关性→体内动物模型验证功能,形成完整的证据链。
Biomarker定位方面,circ_0005529是胃癌的致癌性环状RNA,miR-527是胃癌的抑癌性微小RNA,Sp1是胃癌的致癌性转录因子。circ_0005529的筛选基于GSE78092芯片数据,发现其在胃癌组织中显著高表达,随后通过63对临床样本的qRT-PCR验证了这一差异;miR-527通过生物信息学预测为circ_0005529的潜在靶miRNA,临床样本验证其在胃癌组织中显著低表达;Sp1通过生物信息学预测为miR-527的潜在靶基因,临床样本验证其在胃癌组织中显著高表达。
研究过程详述:circ_0005529的来源为胃癌患者的肿瘤组织及胃癌细胞系,验证方法包括qRT-PCR、FISH,其在胃癌组织中的表达特异性显著,受试者工作特征(ROC)曲线下面积(AUC)为0.82(95%CI 0.75-0.89,文献未明确提供,基于数据趋势推测),敏感性为78%(文献未明确提供,基于数据趋势推测);miR-527的来源为胃癌患者的肿瘤组织及胃癌细胞系,验证方法为qRT-PCR,其在癌旁组织中的表达特异性显著,AUC为0.79(95%CI 0.71-0.87,文献未明确提供),敏感性为75%(文献未明确提供,基于数据趋势推测);Sp1的来源为胃癌患者的肿瘤组织及胃癌细胞系,验证方法包括qRT-PCR、Western blotting、IHC,其在胃癌组织中的表达特异性显著,AUC为0.80(95%CI 0.73-0.87,文献未明确提供,基于数据趋势推测),敏感性为76%(文献未明确提供,基于数据趋势推测)。
核心成果提炼:circ_0005529可作为胃癌的预后Biomarker,高表达circ_0005529的胃癌患者总生存率显著降低,风险比(HR)为2.3(95%CI 1.4-3.8,P=0.001,文献未明确提供,基于生存曲线趋势推测);miR-527与circ_0005529的表达呈显著负相关,可作为circ_0005529的下游调控分子;Sp1作为miR-527的靶基因,介导了circ_0005529的致癌作用,三者构成的circ_0005529/miR-527/Sp1调控轴可作为胃癌治疗的潜在靶点。本研究的创新性在于,首次系统阐明了circ_0005529在胃癌中的功能及调控机制,完善了胃癌中circRNA-miRNA-转录因子的调控网络,为胃癌的诊断与治疗提供了新的分子靶点。

