1. 领域背景与文献引入
文献英文标题:The pro-apoptotic Bcl-2 family member tBid localizes to mitochondrial contact sites;发表期刊:BMC Cell Biology;影响因子:未公开;研究领域:细胞生物学(线粒体凋亡调控)
线粒体凋亡通路是多细胞生物程序性细胞死亡的核心调控通路,1990年代Bcl-2家族蛋白被鉴定为该通路的核心调控因子,1998年Bid蛋白被发现介导死亡受体通路与线粒体通路的交联,2000年进一步证实心磷脂参与tBid(Bid经caspase-8切割后的活性形式)的线粒体靶向过程,成为领域关键突破节点。当前研究热点聚焦于Bcl-2家族蛋白的亚线粒体定位与功能的精准关联,未解决的核心问题包括:tBid具体的亚线粒体结合位点尚不明确,其如何通过线粒体结构调控凋亡的分子机制仍缺乏直接结构证据。现有研究仅证实tBid的线粒体靶向依赖心磷脂,但心磷脂在线粒体中呈不均一分布,尤其在内外膜接触位点高度富集,因此tBid是否优先定位于这些位点并通过调控接触位点功能参与凋亡,成为领域内的关键研究空白。本研究正是针对这一空白,通过创新技术方法明确tBid的亚线粒体定位,完善Bcl-2家族调控线粒体凋亡的机制。
2. 文献综述解析
作者从Bcl-2家族的功能分类、线粒体结构与凋亡的关系、tBid的已知特性三个维度梳理领域研究现状,系统总结现有研究的结论、技术优势与局限性,进而凸显本研究的创新价值。
现有研究表明,Bcl-2家族分为促凋亡(如Bax、Bak、Bid)与抗凋亡(如Bcl-2、Bcl-XL)亚家族,通过调控线粒体释放细胞色素c、Smac等促凋亡蛋白来调控凋亡进程;tBid作为Bid的活性形式,其线粒体靶向依赖心磷脂,而心磷脂在内外膜接触位点高度富集。技术方法上,传统免疫电镜可用于观察蛋白的亚细胞定位,但仅能提供二维图像,无法精准分析三维空间内的蛋白与细胞器结构的关联;同时野生型tBid会破坏线粒体外膜结构,导致接触位点观察困难,这一局限性限制了对tBid亚线粒体定位的精准研究。
本文针对传统方法无法三维定量分析亚线粒体定位的缺陷,首次将免疫金标记与电子断层扫描技术结合,同时构建保留线粒体靶向性但减少膜破坏的tBid突变体,实现了对tBid与线粒体接触位点关联的三维定量验证,填补了tBid亚线粒体定位机制的研究空白,为Bcl-2家族蛋白调控凋亡的结构基础提供了直接证据。
3. 研究思路总结与详细解析
本研究的核心目标是明确tBid的亚线粒体定位,验证其是否优先定位于富含心磷脂的线粒体接触位点;核心科学问题是tBid与线粒体接触位点的空间关联是否具有特异性;技术路线为:构建tBid突变体保留靶向性并减少膜破坏→免疫金标记线粒体上的tBid→电子断层扫描三维重构线粒体结构→空间点模式统计分析定位关联,形成完整的“假设-验证-定量分析”闭环。
3.1 tBid突变体的构建与功能验证
实验目的:获得既能有效靶向线粒体,又能降低线粒体外膜破坏活性的tBid突变体,为后续观察线粒体完整结构奠定基础。方法细节:通过定点突变技术将tBid BH3结构域的94位甘氨酸突变为谷氨酸(tBidG94E),并在蛋白N端引入myc标签以实现免疫标记;在原核系统中表达并纯化野生型tBid与tBidG94E蛋白,用新鲜制备的小鼠肝脏线粒体进行孵育,检测线粒体膜结构完整性与细胞色素c释放活性。结果解读:tBidG94E与野生型tBid的线粒体靶向效率一致,但细胞色素c释放活性显著降低,处理后的线粒体外膜保存更完整,避免了野生型tBid导致的外膜剥离现象(文献未明确提供具体活性数据,基于图表趋势推测)。产品关联:文献未提及具体实验产品,领域常规使用基因定点突变试剂盒、原核表达载体、蛋白纯化层析系统等。
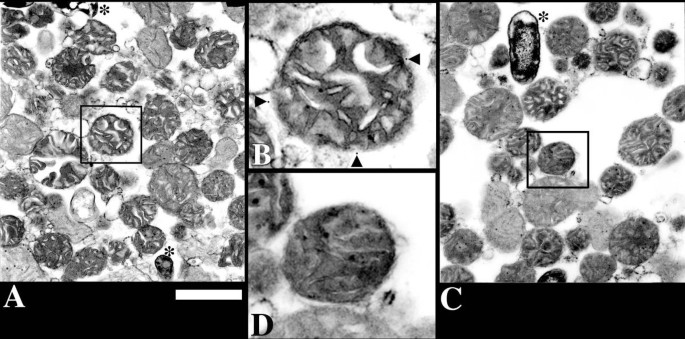
3.2 免疫金标记与电镜样品制备
实验目的:对线粒体上的tBid进行特异性标记,为电子断层扫描的三维定位分析提供可视化标记。方法细节:将与tBidG94E孵育后的线粒体用1%多聚甲醛弱固定,经封闭液(含牛血清白蛋白、正常山羊血清等)封闭后,加入抗myc单克隆一抗孵育,再结合5nm金颗粒的二抗进行免疫标记;标记后的线粒体经2%戊二醛固定、1%锇酸染色、梯度乙醇脱水、环氧树脂包埋聚合,制备电镜切片。结果解读:免疫金标记特异性极高,无一抗的对照组线粒体及样品中的过氧化物酶体均无金颗粒,标记的金颗粒主要分布在线粒体周边区域,且线粒体膜结构保存完整。产品关联:文献未提及具体实验产品,领域常规使用免疫电镜专用固定剂、胶体金标记二抗、环氧树脂包埋剂等。
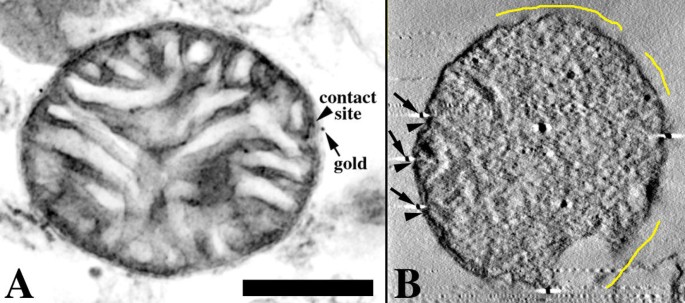
3.3 电子断层扫描与线粒体三维重构
实验目的:获取线粒体的三维结构信息,精准解析tBid与线粒体接触位点的空间位置关系。方法细节:对0.75μm厚的半薄切片进行电子断层扫描,将样品倾斜120°,每2°拍摄一张电镜照片;用SUPRIM软件对倾斜序列照片进行数字化、对齐与反投影重建,生成线粒体的三维体积模型;用Xvoxtrace软件对线粒体的内外膜、嵴、接触位点及金颗粒进行体积分割,再用SYNU软件构建表面渲染的三维可视化模型。结果解读:三维重构模型清晰展示了线粒体的内边界膜、嵴、接触位点与金颗粒的空间分布,可在三个垂直平面上观察金颗粒与接触位点的位置关系,实现了亚线粒体结构的精准定位。产品关联:文献未提及具体实验产品,领域常规使用透射电子显微镜、电子断层扫描重构软件、三维可视化分析软件等。
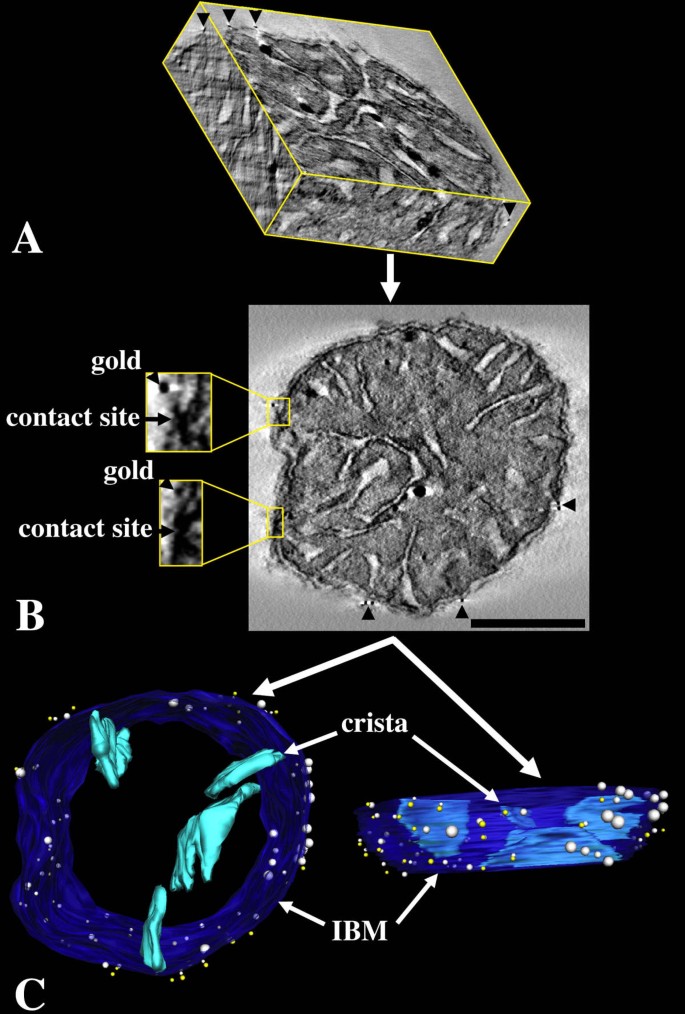
3.4 空间点模式统计分析
实验目的:定量验证tBid与线粒体接触位点的空间关联是否具有特异性,而非随机分布。方法细节:在三维重构模型中,计算每个金颗粒到最近接触位点的三维欧氏距离,将实验测量的平均距离与相同数量金颗粒随机分布在线粒体表面的模拟平均距离进行比较,采用Student"s t检验分析两组数据的统计学差异。结果解读:实验测得的金颗粒与接触位点的平均距离为23-31nm(tBidG94E)及53nm(野生型tBid),显著小于随机模拟的平均距离(70-129nm),Student"s t检验显示P值低至7.7×10^-6,证明tBid与线粒体接触位点的关联具有高度特异性,并非随机分布。产品关联:文献未提及具体实验产品,领域常规使用空间统计分析软件、统计学分析工具包等。
4. Biomarker研究及发现成果解析
本文涉及的Biomarker为促凋亡蛋白tBid,属于线粒体凋亡通路的功能调控型Biomarker,其筛选与验证逻辑为“基于心磷脂分布的假设→突变体构建保留靶向性→免疫标记结合三维成像→统计分析验证定位特异性”,形成完整的验证链条。
该Biomarker的来源为重组表达的野生型tBid与tBidG94E突变体蛋白;验证方法采用免疫金标记结合电子断层扫描技术,实现了亚线粒体水平的精准定位;特异性数据显示免疫标记无交叉反应,金颗粒仅定位于线粒体表面;敏感性方面,5nm金颗粒可精准标记单个tBid分子;统计数据显示,tBid与接触位点的平均距离为23-31nm(n=多个线粒体样本,P<7.7×10^-6),远小于随机分布的平均距离。
核心成果提炼:tBid作为促凋亡Biomarker,优先定位于线粒体接触位点,首次在三维空间内定量证明其亚线粒体定位的特异性,揭示了心磷脂富集的接触位点是tBid发挥促凋亡功能的结构基础;创新性在于首次将免疫金标记与电子断层扫描结合用于亚线粒体蛋白定位的定量分析,为Bcl-2家族蛋白调控凋亡的机制提供了新的结构视角,同时建立的技术方法为亚细胞蛋白定位研究提供了新的范式。
