1. 领域背景与文献引入
文献英文标题:Exogenous supply of Hsp47 triggers fibrillar collagen deposition in skin cell cultures in vitro;发表期刊:BMC Molecular and Cell Biology;影响因子:未公开;研究领域:皮肤胶原相关疾病的生物治疗。
皮肤中的胶原纤维占其干重的60-80%,是维持皮肤机械稳定性和结构完整性的核心组分。在胶原相关皮肤疾病中,如大疱性表皮松解症(EB)、Ehlers-Danlos综合征(EDS)及坏血病等,胶原或其伴侣蛋白的突变会导致胶原折叠异常、组装障碍,进而引发皮肤脆弱、水疱形成及慢性伤口等病理表现。领域共识:现有治疗手段主要依赖非特异性的胶原合成诱导剂,包括小分子化合物如4-苯基丁酸(4-PBA)、抗坏血酸,以及生长因子如转化生长因子-β(TGF-β),但这些分子的作用缺乏胶原特异性,会干扰其他细胞通路,引发异常血管生成、炎症反应或瘢痕形成等副作用。Hsp47是一种内质网定位的胶原特异性伴侣蛋白,其表达水平与胶原沉积量直接相关,此前研究已初步证实外源性Hsp47可促进成纤维细胞的胶原沉积,但不同皮肤细胞类型对Hsp47的响应差异、以及Hsp47对不同胶原亚型的调控特异性尚未明确,这一研究空白限制了Hsp47作为治疗蛋白的临床转化应用。因此,本研究旨在系统解析外源性Hsp47对不同皮肤细胞胶原沉积的调控作用,明确其细胞类型特异性与胶原亚型选择性,为Hsp47用于胶原相关皮肤疾病的治疗提供实验依据。
2. 文献综述解析
作者围绕胶原相关皮肤疾病的治疗现状与Hsp47的研究进展展开综述,以“现有治疗手段的局限性-Hsp47的功能特性-研究空白”为逻辑主线,明确本研究的创新定位。
现有研究方面,作者将现有胶原诱导剂分为两类:一类是小分子辅助因子,如抗坏血酸,其通过作为脯氨酸羟化酶的辅因子促进胶原前体的羟化修饰,但该过程同时会影响弹性蛋白、纤连蛋白等其他基质蛋白的合成,缺乏特异性;另一类是生长因子,如TGF-β,其通过激活Smad2/3信号通路上调胶原表达,但会诱导真皮成纤维细胞向肌成纤维细胞分化,进而导致伤口愈合过程中的瘢痕过度形成,且存在非特异性的细胞增殖、血管生成调控作用,引发多种副作用。针对Hsp47的研究,作者梳理了其作为胶原特异性伴侣蛋白的核心功能:Hsp47定位于内质网,可稳定胶原前体的三重螺旋结构、防止其在细胞内降解、参与胶原的质量控制与转运过程,其基因敲除会导致胚胎致死,证实了其在胶原合成中的核心作用;此前研究显示外源性Hsp47可通过细胞膜上的KDEL受体被摄取并转运至内质网,促进成纤维细胞的胶原沉积,但不同皮肤细胞类型(成纤维细胞、角质形成细胞、内皮细胞)对Hsp47的摄取效率差异、以及Hsp47对不同胶原亚型的调控特异性尚未得到系统验证,这一空白导致Hsp47的治疗应用潜力无法被精准评估。本研究的创新价值在于首次在多种皮肤细胞类型中系统分析外源性Hsp47的作用效果,量化不同胶原亚型的沉积变化,并在Hsp47敲除细胞中验证其功能特异性,填补了Hsp47细胞与亚型特异性调控的研究空白,为其作为靶向治疗蛋白提供了关键实验数据。
3. 研究思路总结与详细解析
本研究的核心目标是明确外源性Hsp47对不同皮肤细胞胶原沉积的调控特性,包括细胞类型特异性、胶原亚型选择性及给药时间效应;核心科学问题是外源性Hsp47的细胞摄取机制与胶原沉积调控的特异性关联;技术路线遵循“摄取验证-沉积定量-亚型分析-功能验证”的闭环逻辑,通过细胞实验、分子生物学检测及基因敲除模型验证,系统解析Hsp47的作用机制。
3.1 外源性Hsp47的细胞摄取与定位验证
实验目的:验证不同皮肤细胞类型对外源性Hsp47的摄取效率、细胞内定位,明确摄取过程与KDEL受体的关联。方法细节:采用EGFP标记的重组Hsp47(H47)处理人真皮成纤维细胞(NHDF)、表皮角质形成细胞(HaCaT)、真皮内皮细胞(HDMEC)及小鼠成纤维细胞(L929、MEF),设置0.1μM至1.0μM的浓度梯度,孵育3h后,使用内质网追踪染料(ER tracker)进行细胞染色,通过共聚焦显微镜观察H47的细胞内定位;同时提取细胞膜蛋白组分,采用免疫印迹(Western blot)检测KDEL受体的表达水平,以胞浆GAPDH作为细胞内参。结果解读:H47的摄取具有浓度依赖性与细胞类型依赖性,NHDF、L929及MEF在0.5μM浓度下的摄取率超过80%,HDMEC在0.5μM时摄取率达80%,而HaCaT需在0.8μM以上浓度才能达到约80%的摄取率;共聚焦成像显示H47与内质网信号共定位,证实其被转运至内质网发挥功能;Western blot结果显示,细胞膜上KDEL受体的表达水平与H47的摄取率呈正相关(n=3,P<0.001),验证了Hsp47通过KDEL受体介导的内吞作用进入细胞的机制。
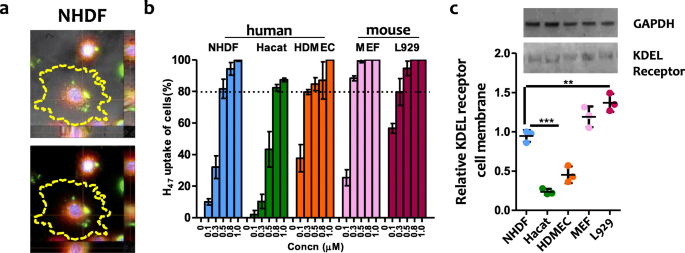
产品关联:文献提及的关键产品:内质网染色试剂盒(ER Staining Kit - Red Fluorescence - Cytopainter, ab139482)、抗小鼠KDEL受体单克隆抗体(KR-10, Enzo life sciences, ADI-VAA-PT048-D)、抗兔GAPDH单克隆抗体(14C10, Cell signaling, 2118S)。
3.2 胶原沉积的定量与时间效应分析
实验目的:对比外源性Hsp47与现有胶原诱导剂的促沉积效果,明确时间依赖性与重复给药的影响。方法细节:将不同皮肤细胞接种于培养板24h后,分别用0.5μM H47、TGF-β1或抗坏血酸处理3h,换液后继续培养24h或1-14天;重复给药组在培养第1、3、6、9、12天添加0.5μM H47;采用天狼星红(Sirius Red)染色法定量胶原沉积,以未处理的NHDF细胞为对照进行归一化分析。结果解读:H47处理后,NHDF的胶原沉积量增加70%,HaCaT增加20%,HDMEC增加50%,小鼠成纤维细胞(L929、MEF)增加70-100%,其促沉积效果比TGF-β1与抗坏血酸高20-50%(n=6,P<0.001);时间效应分析显示,未处理细胞的胶原沉积在培养前6天逐渐增加,细胞汇合后进入平台期;重复给药H47可使成纤维细胞的胶原沉积在培养第5天达到2-3倍的提升,而细胞汇合后给药则无明显促沉积效果,证实细胞增殖状态是Hsp47发挥作用的关键前提。
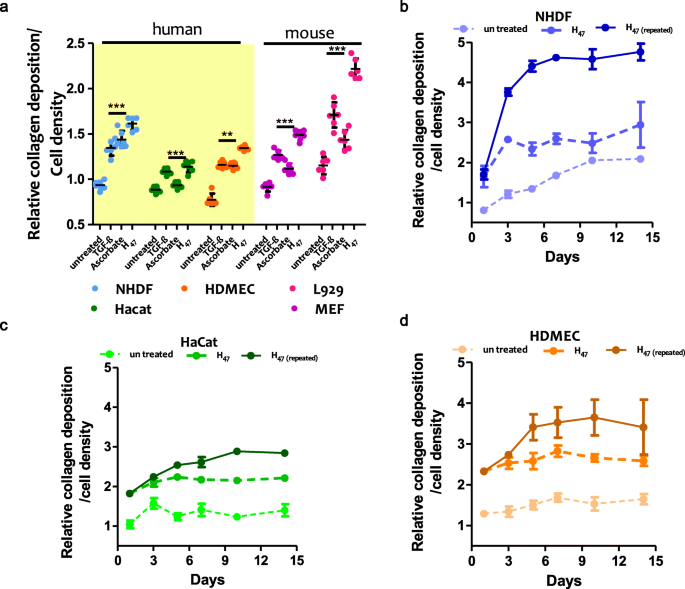
产品关联:文献提及的关键产品:天狼星红染色液(ab150681)、重组人TGF-beta 1蛋白(R & D systems, 240-B-010)、抗坏血酸磷酸酯(Sigma, A8960-5G)。
3.3 胶原亚型的特异性调控分析
实验目的:明确外源性Hsp47对不同胶原亚型(I、III、IV、V、XII)的调控特异性,验证其在Hsp47缺陷细胞中的功能。方法细节:细胞经H47处理后,采用去细胞化方法保留细胞外基质,使用胶原亚型特异性抗体进行免疫荧光染色,通过荧光定量分析不同亚型的沉积水平;同时在Hsp47基因敲除的MEF细胞(Hsp47-/-)中进行验证,采用Western blot检测胶原亚型的表达变化。结果解读:所有细胞类型中,纤维状胶原I、III、V的沉积均显著上调,其中成纤维细胞中的上调幅度显著高于HaCaT与HDMEC(n=3,P<0.001);HaCaT与HDMEC中网络状胶原IV的沉积明显增强,而纤维相关胶原XII的沉积无显著变化;在Hsp47-/-细胞中,H47处理可使胶原I、III、V的沉积恢复至野生型MEF细胞的水平,而IV与XII型胶原无明显变化,证实Hsp47特异性调控纤维状胶原的合成与沉积。
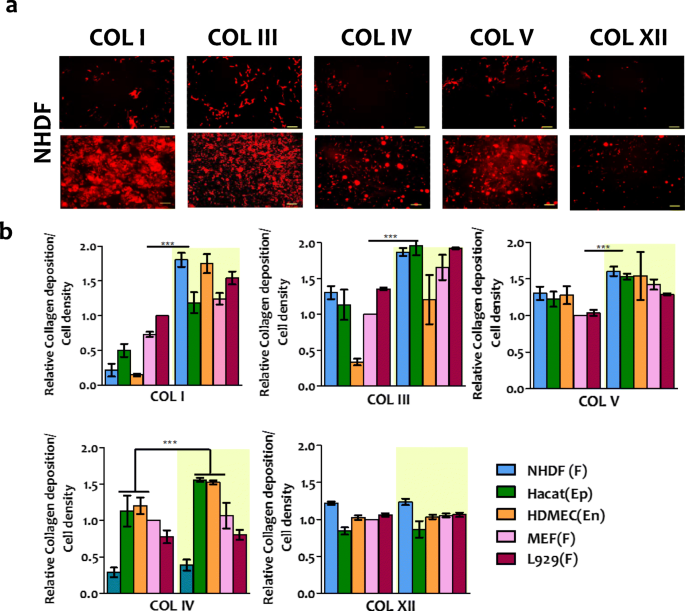
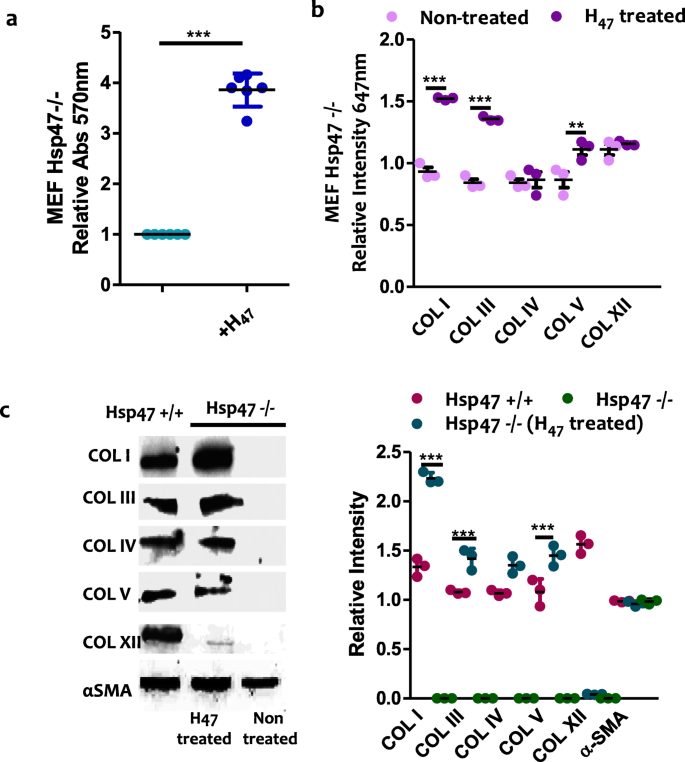
产品关联:文献提及的关键产品:抗I型胶原多克隆抗体(Rockland, 600–401–103-0.1)、抗III型胶原多克隆抗体(Thermo fisher, PA5–34787)、抗IV型胶原抗体(Sigma, HPA042064-100UL)、抗V型胶原抗体(ab7046)、抗XII型胶原抗体(Sigma, HPA070695)。
3.4 肌成纤维细胞分化的安全性验证
实验目的:验证外源性Hsp47是否会诱导成纤维细胞向肌成纤维细胞分化,评估其治疗安全性。方法细节:NHDF细胞经0.5μM H47或TGF-β1处理3h后,换液培养24h,采用α-平滑肌肌动蛋白(α-SMA)抗体进行免疫荧光染色,检测肌成纤维细胞的分化标记物表达。结果解读:TGF-β1处理的NHDF细胞中可观察到明显的α-SMA荧光信号,而H47处理的细胞中无α-SMA表达,证实外源性Hsp47不会诱导成纤维细胞向肌成纤维细胞分化,避免了TGF-β等诱导剂引发的瘢痕形成风险,具有更高的治疗安全性。
产品关联:文献提及的关键产品:抗α-平滑肌肌动蛋白抗体(Abcam, ab5694)。
4. Biomarker研究及发现成果解析
本研究围绕Hsp47调控胶原沉积的特异性,明确了两类关键Biomarker:一是Hsp47细胞摄取的功能性标志物KDEL受体,二是Hsp47作用的效应标志物纤维状胶原I、III、V,通过多维度验证明确了其调控逻辑与临床转化潜力。
Biomarker定位:KDEL受体作为Hsp47细胞摄取的特异性标志物,其细胞膜表达水平直接决定细胞对Hsp47的响应效率;纤维状胶原I、III、V作为Hsp47作用的效应标志物,其沉积水平可反映Hsp47的治疗效果。筛选与验证逻辑:首先通过细胞摄取实验与Western blot验证KDEL受体表达与Hsp47摄取率的相关性,随后通过免疫荧光、Western blot及基因敲除模型验证胶原亚型的特异性调控,形成“摄取-效应-功能”的完整验证链条。
研究过程详述:KDEL受体来源于不同皮肤细胞的细胞膜蛋白组分,采用Western blot检测其表达水平,结果显示成纤维细胞的KDEL受体表达水平显著高于HaCaT细胞,与Hsp47的摄取率正相关(n=3,P<0.001);纤维状胶原I、III、V来源于细胞培养的细胞外基质,采用免疫荧光定量与Western blot检测,成纤维细胞中H47处理后其沉积水平上调70-100%(n=6,P<0.001),HaCaT与HDMEC中也有不同程度上调,而IV型胶原仅在HaCaT与HDMEC中上调,XII型胶原无变化;在Hsp47-/-细胞中,H47处理可使I、III、V型胶原沉积恢复至野生型水平,进一步证实其特异性。
核心成果提炼:本研究首次明确KDEL受体是Hsp47细胞摄取的关键Biomarker,可用于预测不同细胞对Hsp47的响应效率;同时证实纤维状胶原I、III、V是Hsp47的特异性效应Biomarker,其沉积水平与Hsp47的作用效果直接相关。创新性在于首次系统解析了外源性Hsp47的细胞类型特异性与胶原亚型选择性调控,为Hsp47作为胶原相关皮肤疾病的治疗蛋白提供了精准的作用靶点与疗效评估指标;研究显示Hsp47的促胶原沉积效果显著优于现有诱导剂,且无肌成纤维细胞分化的副作用,具有良好的临床转化前景。
