1. 领域背景与文献引入
文献英文标题:Rapid de-localization of actin leading edge components with BDM treatment;发表期刊:BMC Cell Biology;影响因子:未公开;研究领域:细胞生物学-肌动蛋白细胞骨架动态调控
肌动蛋白细胞骨架是维持细胞形态、介导细胞运动、参与物质运输等生命活动的核心动态系统,小分子抑制剂是解析其功能调控机制的重要工具。2,3-丁二酮单肟(BDM)曾被广泛认为是一种非肌球蛋白II抑制剂,被用于探究非肌球蛋白II在肌动蛋白逆行流、细胞运动等过程中的作用,成为肌动蛋白细胞骨架研究领域的常用试剂。然而,近年的研究发现BDM并不抑制已测试的任何非肌球蛋白(包括非肌球蛋白II),这使得此前利用BDM得到的实验结果的机制解释陷入矛盾,领域内亟需明确BDM对肌动蛋白相关细胞过程的真实作用机制,以纠正过往研究的认知偏差,为后续肌动蛋白动态调控研究提供可靠的实验依据。本文正是针对这一核心问题展开研究,旨在揭示BDM影响肌动蛋白细胞骨架过程的分子机制。
2. 文献综述解析
本文综述部分围绕BDM的应用争议与研究空白展开,按“BDM的传统认知与应用-新研究带来的认知冲突-现有研究的矛盾点”的逻辑梳理领域现状。
首先,作者回顾了BDM的应用历史,指出其最初被作为非肌球蛋白II抑制剂引入细胞生物学领域,被广泛用于研究非肌球蛋白II在肌动蛋白逆行流、细胞铺展、生长锥运动等过程中的功能,相关实验设计常结合肌球蛋白S1显微注射、ML-7处理等方法,形成了“BDM通过抑制非肌球蛋白II影响肌动蛋白相关过程”的主流认知。随后,作者梳理了近年的突破性研究,明确BDM对已测试的非肌球蛋白(包括非肌球蛋白II、肌球蛋白Ic、肌球蛋白V等)的ATP酶活性均无抑制作用,仅抑制肌肉肌球蛋白II,这直接否定了BDM作为非肌球蛋白II抑制剂的核心假设,导致过往大量实验结果的机制解释存疑。同时,作者指出现有研究中存在矛盾点:部分研究显示抑制非肌球蛋白II的功能会产生与BDM处理类似的效果,但也有研究通过发色团辅助激光灭活非肌球蛋白II后,并未观察到肌动蛋白逆行流的变化,这进一步凸显了BDM作用机制的未知性。基于此,本文的创新价值在于首次发现BDM并非通过抑制非肌球蛋白II,而是通过使肌动蛋白前沿的关键调控组分脱定位来影响肌动蛋白聚合过程,填补了BDM作用机制研究的空白,为过往实验结果的重新解读提供了依据。
3. 研究思路总结与详细解析
本文的研究目标是明确BDM对肌动蛋白细胞骨架过程的真实作用机制,核心科学问题是在BDM不抑制非肌球蛋白II的前提下,如何影响肌动蛋白逆行流等依赖肌动蛋白的细胞过程,技术路线遵循“假设验证-机制探究-动态确认”的闭环逻辑:首先验证BDM对非肌球蛋白II的无抑制作用,随后通过细胞实验检测BDM对肌动蛋白前沿聚合的影响,再通过免疫荧光和活细胞成像明确其对肌动蛋白前沿调控组分的作用,最终形成结论。
3.1 非肌球蛋白II ATP酶活性验证实验
该环节的实验目的是确认BDM是否真的不抑制非肌球蛋白II的ATP酶活性,为后续机制探究奠定基础。实验采用EnzCheck磷酸释放实验,将血小板非肌球蛋白II S1片段稀释至0.050mg/ml,分别加入DMSO、20mM BDM或100μM blebbistatin处理,以100μM ATP启动反应,检测360nm处的吸光度变化以反映ATP水解情况。结果显示,BDM对血小板非肌球蛋白II S1的ATP酶活性无抑制作用,反而使其活性提升约2倍(文献未明确样本量及P值),而blebbistatin则抑制了超过90%的ATP酶活性,与此前的研究结论一致,证实BDM并非非肌球蛋白II的抑制剂。实验所用关键产品:EnzCheck磷酸释放试剂盒(Molecular Probes)、BDM(Calbiochem 203984)、blebbistatin。
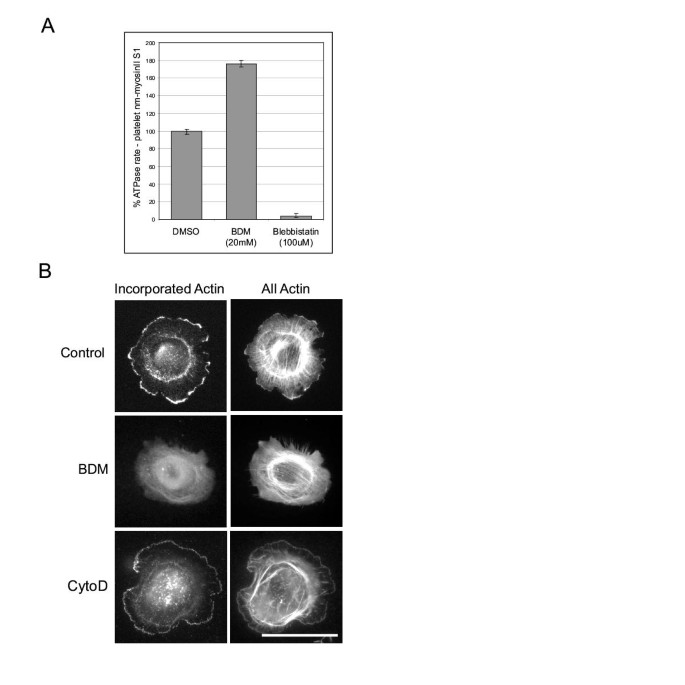
3.2 透化细胞中肌动蛋白掺入实验
该环节的实验目的是检测BDM对肌动蛋白前沿聚合过程的直接影响。实验将铺展的Swiss3T3细胞用15mM BDM处理1分钟后,用皂苷透化细胞并加入罗丹明标记的肌动蛋白,固定后通过荧光显微镜观察肌动蛋白的掺入情况,同时设置细胞松弛素D预处理作为对照。结果显示,对照组细胞的前沿区域有明显的荧光信号,表明肌动蛋白正常掺入;而BDM处理后,超过75%的细胞前沿荧光信号显著降低(n=3次独立实验,文献未明确P值),且细胞形态未发生明显改变;细胞松弛素D预处理的细胞仍能观察到较高的荧光掺入,说明BDM抑制的是新肌动蛋白丝的成核过程,而非现有丝的延伸。实验所用关键产品:罗丹明标记肌动蛋白、皂苷、细胞松弛素D(Sigma C8273)。

3.3 肌动蛋白前沿组分定位检测实验
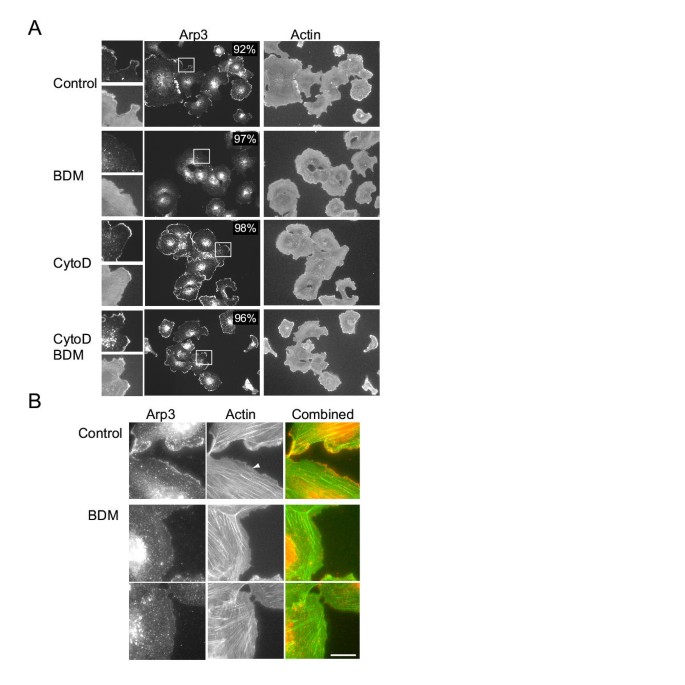
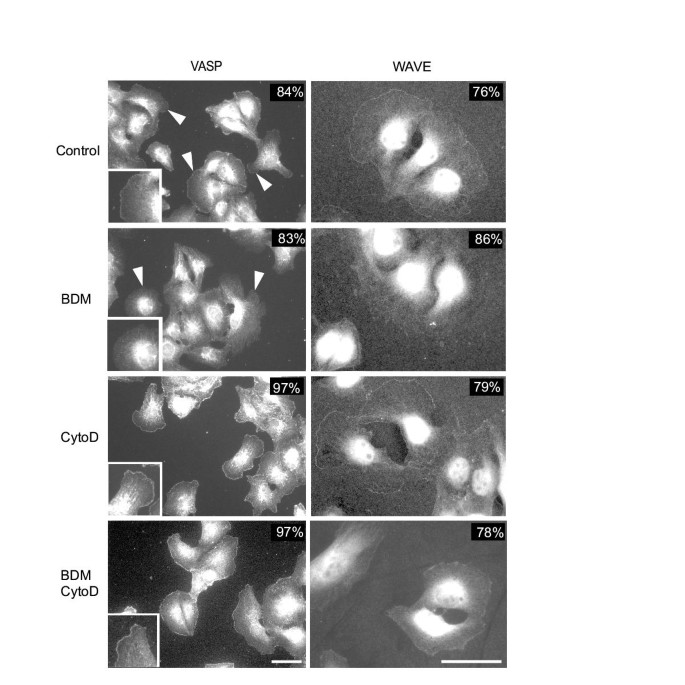
该环节的实验目的是探究BDM是否通过影响肌动蛋白前沿调控蛋白的定位来抑制肌动蛋白聚合。实验将BS-C-1细胞和Swiss3T3细胞用20mM BDM处理1分钟后,通过免疫荧光染色检测Arp3(Arp2/3复合物的亚基)、VASP、WAVE1的定位情况,同时设置细胞松弛素D处理、BDM与细胞松弛素D联合处理作为对照。结果显示,对照组中Arp3、VASP、WAVE1均定位于细胞前沿;BDM处理后,超过90%的细胞中这些蛋白均从前沿脱定位(n=100细胞,文献未明确P值),同时前沿的肌动蛋白网络也随之消失;而细胞松弛素D处理或联合处理均未影响这些蛋白的前沿定位,说明BDM特异性导致肌动蛋白前沿调控组分的脱定位,且该过程依赖肌动蛋白的动态变化。实验所用关键产品:Arp3抗体(C. Egile馈赠)、VASP抗体(F. Southwick馈赠)、WAVE1抗体(S. Eden馈赠)、Alexa标记二抗(Molecular Probes)。
3.4 李斯特菌感染验证实验
该环节的实验目的是确认BDM不直接影响肌动蛋白的聚合活性,而是特异性作用于细胞前沿的调控系统。实验用李斯特菌感染BS-C-1细胞,BDM处理后观察细菌的运动情况及Arp3在李斯特菌彗星尾中的定位。结果显示,BDM处理后李斯特菌仍能在细胞内正常运动,其彗星尾中的Arp3定位未受影响,但细胞前沿的Arp3定位被破坏,说明BDM不直接抑制肌动蛋白的聚合过程,而是特异性影响细胞前沿的肌动蛋白调控网络。
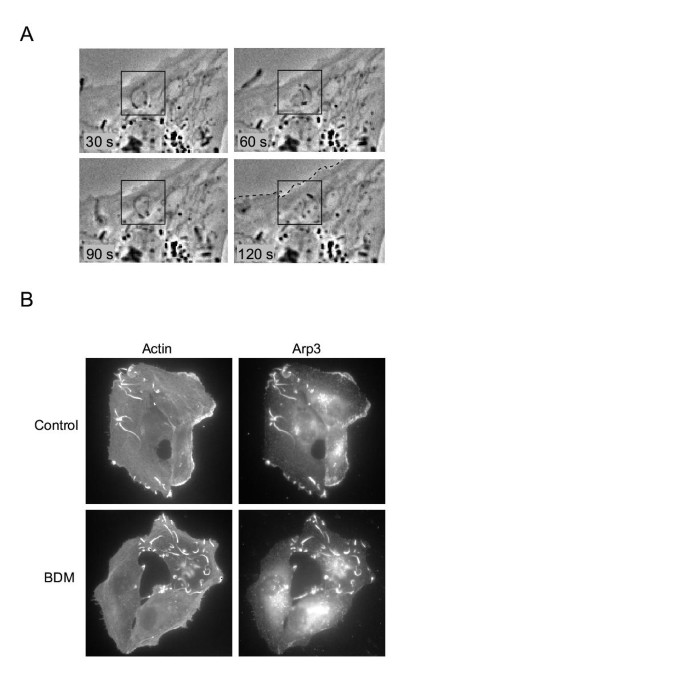
3.5 Arp3-GFP活细胞动态成像实验
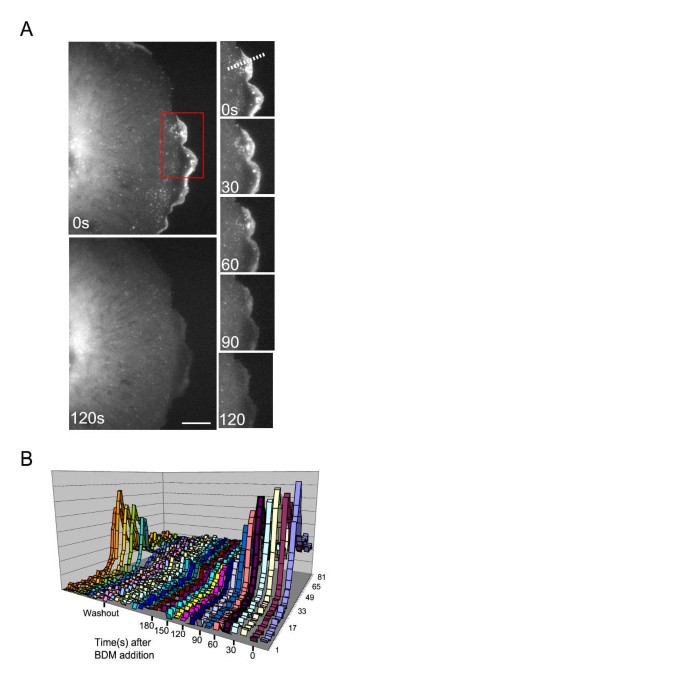
该环节的实验目的是实时观察BDM处理下Arp3脱定位的动态过程,明确其脱定位的机制。实验构建稳定表达Arp3-GFP的BS-C-1细胞系,通过活细胞成像记录BDM处理后Arp3-GFP的定位变化。结果显示,BDM处理后2分钟内,Arp3-GFP从细胞前沿均匀扩散消失,荧光信号逐渐降低至背景水平,且未观察到Arp3信号随肌动蛋白逆行流向细胞内移动;洗去BDM后,Arp3-GFP在1分钟内即可恢复前沿定位,说明脱定位过程是可逆的,且并非由肌动蛋白逆行流驱动,而是Arp3与肌动蛋白网络的解离导致的。实验所用关键产品:GFP-Arp3质粒(D. Schafer馈赠)、Fugene6转染试剂(Roche)、Geneticin。
4. Biomarker研究及发现成果
本文未涉及疾病相关生物标志物(Biomarker)的研究,而是聚焦于细胞生物学领域的功能分子靶点发现,明确了BDM作用的关键功能组分——Arp2/3复合物、WAVE、VASP,这些分子可作为研究肌动蛋白前沿动态调控的功能靶点。
研究过程中,这些功能分子的来源为哺乳动物细胞(BS-C-1细胞、Swiss3T3细胞)的肌动蛋白前沿区域,通过免疫荧光染色、活细胞成像等方法验证了BDM对其定位的影响,特异性表现为仅在BDM处理下发生脱定位,而细胞松弛素D等处理不影响其定位,敏感性表现为1分钟短时间处理即可导致超过90%的细胞出现脱定位现象(n=100细胞)。核心成果方面,这些分子的功能关联在于:Arp2/3复合物是肌动蛋白丝成核的核心复合物,WAVE是其激活因子,VASP则促进肌动蛋白丝的延伸,三者共同调控肌动蛋白前沿的聚合过程,它们的脱定位直接导致前沿肌动蛋白掺入受阻,解释了此前BDM对肌动蛋白逆行流、细胞运动等过程的抑制作用。本文的创新性在于首次发现BDM通过影响这些肌动蛋白前沿调控组分的定位发挥作用,纠正了领域内长期以来认为BDM抑制非肌球蛋白II的错误认知,为肌动蛋白细胞骨架研究的实验试剂选择提供了重要参考。
