1. 领域背景与文献引入
文献英文标题:Hook2 contributes to aggresome formation;发表期刊:BMC Cell Biology;影响因子:未公开;研究领域:细胞生物学-错误折叠蛋白聚集体形成机制
错误折叠蛋白的聚集是细胞蛋白质质量控制体系失衡的关键表现,当蛋白质折叠或降解通路功能障碍时,错误折叠蛋白会在细胞内积累形成聚集体,这些聚集体可干扰微管依赖的物质运输、阻断泛素-蛋白酶体系统功能,进而引发细胞病理改变,与神经退行性疾病(如阿尔茨海默病、帕金森病)的包涵体形成密切相关。领域共识:细胞针对错误折叠蛋白聚集体的防御机制之一是通过细胞质动力蛋白(dynein)介导的逆向微管运输,将聚集体转运至中心体周围形成聚集体(aggresome),该结构可招募蛋白酶体和分子伴侣,促进聚集体的降解或隔离。当前研究热点聚焦于聚集体形成的分子调控机制,但Hook蛋白家族成员Hook2作为中心体定位的连接蛋白,其是否参与聚集体形成的调控尚未明确,这一研究空白限制了对聚集体形成通路的完整理解。本文旨在探究Hook2在聚集体形成中的作用及分子机制,为错误折叠蛋白相关疾病的干预提供新的靶点线索。
2. 文献综述解析
本文综述部分围绕错误折叠蛋白聚集体的形成机制、Hook蛋白家族的功能研究现状展开,通过分类梳理现有研究的结论与局限,明确了Hook2参与聚集体形成的研究必要性。
现有研究首先分类阐述了错误折叠蛋白聚集体的来源,包括蛋白质质量控制通路识别缺陷、降解通路过载或功能障碍两类,同时总结了聚集体的病理危害,如干扰细胞内运输、抑制泛素-蛋白酶体系统活性。针对聚集体的清除机制,现有研究证实了动力蛋白介导的逆向运输至中心体形成聚集体的核心通路,且该结构与神经退行性疾病的包涵体具有相似的组成与形态。在Hook蛋白家族研究方面,现有研究已明确不同物种Hook蛋白的功能:果蝇Hook参与内吞运输,线虫ZYG-12介导中心体与细胞核的连接,哺乳动物Hook2定位于中心体并结合centriolin参与中心体功能,但尚未有研究揭示Hook2与聚集体形成的关联。现有研究的局限性在于,虽已明确聚集体形成的运输通路,但对该通路的调控分子尤其是中心体定位蛋白的作用了解不足,且未区分调控因子是通过改变蛋白生化性质还是运输机制影响聚集体形成。本文的创新价值在于,首次通过细胞与生化实验证实Hook2通过调控微管依赖的逆向运输促进聚集体形成,而非改变错误折叠蛋白的生化性质,填补了Hook2功能研究在聚集体领域的空白。
3. 研究思路总结与详细解析
本文的研究目标是明确Hook2在聚集体形成中的作用及分子机制,核心科学问题为Hook2是否通过调控错误折叠蛋白的运输通路参与聚集体形成,技术路线遵循“定位观察→功能验证→机制探究→模型提出”的闭环逻辑,通过免疫荧光共定位、过表达/显性负突变功能实验、生化性质分析等多维度实验验证假设。
3.1 Hook2与聚集体的中心体共定位验证
实验目的:明确Hook2是否与错误折叠蛋白聚集体在中心体区域共定位,为Hook2参与聚集体形成提供定位证据。
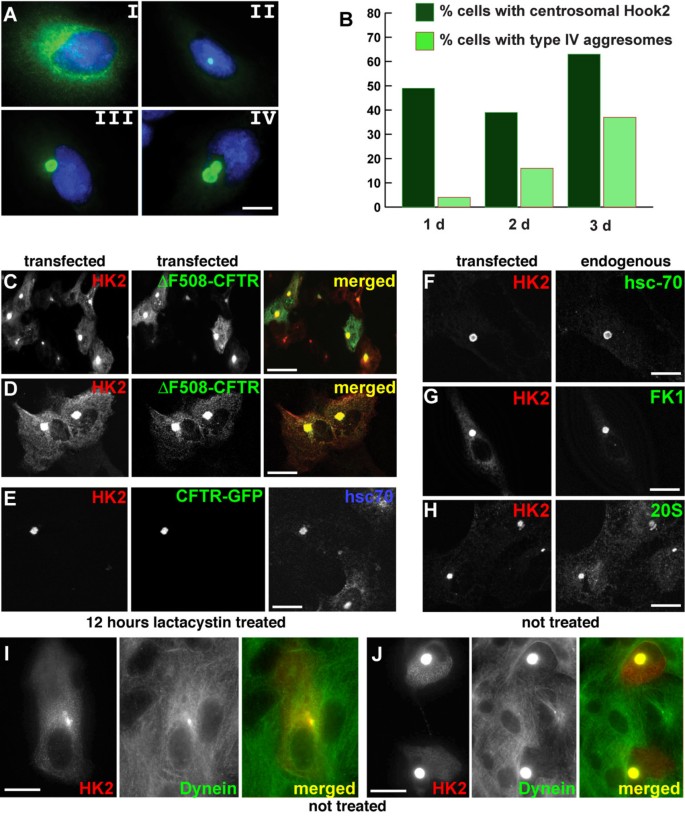
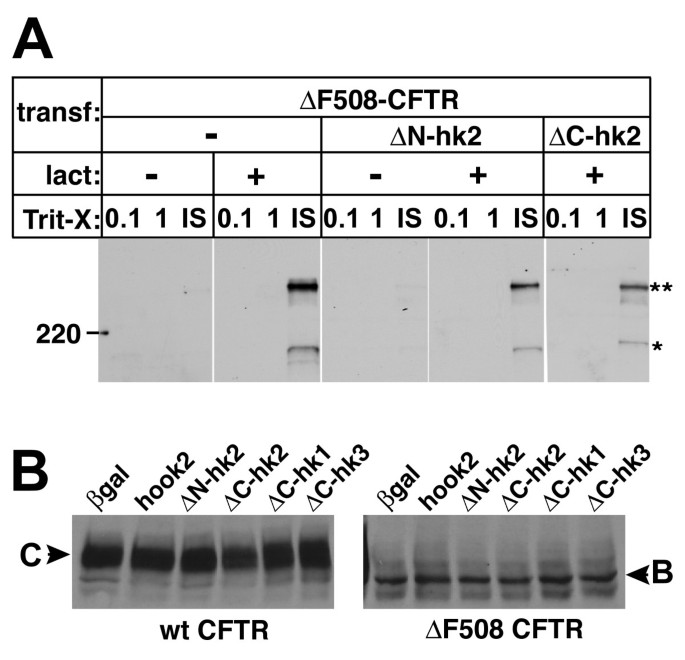
方法细节:在非洲绿猴肾细胞(Vero)中转染Hook2表达载体,分别在表达1、3天后采用免疫荧光染色技术,结合中心体标志物ninein、γ-微管蛋白检测Hook2的亚细胞定位;同时使用蛋白酶体抑制剂lactacystin(10μM)处理共转染Hook2与ΔF508-囊性纤维化跨膜传导调节因子(CFTR)的细胞16小时,通过双重免疫荧光染色观察Hook2与CFTR聚集体的共定位情况。
结果解读:免疫荧光结果显示,内源性与过表达的Hook2均定位于中心体区域,过表达3天后中心体Hook2的积累水平显著升高;且与lactacystin诱导的CFTR聚集体在中心体区域共定位;同时Hook2过表达未破坏细胞微管网络与高尔基体结构,排除了细胞结构损伤对实验结果的干扰。
产品关联:实验所用关键产品:Sigma的抗微管蛋白抗体、抗热休克蛋白70抗体,Research Diagnostics的抗CFTR单克隆抗体(mAb3A7/C-24-1),Roche的Fugene转染试剂。
3.2 Hook2过表达对聚集体形成的促进作用
实验目的:验证Hook2过表达是否能促进错误折叠蛋白聚集体的形成。
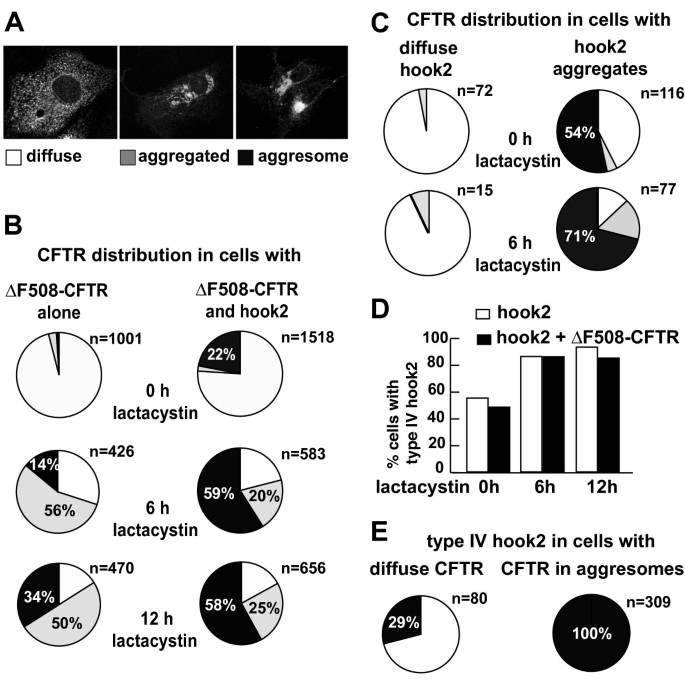
方法细节:在Vero细胞中分别单独转染ΔF508-CFTR、共转染ΔF508-CFTR与Hook2,在无lactacystin处理或处理6、12小时后,通过免疫荧光染色统计CFTR的亚细胞分布类型(弥散、聚集、聚集体),并进一步分析中心体定位Hook2细胞与弥散Hook2细胞中CFTR聚集体的比例差异。
结果解读:统计结果显示,无lactacystin处理时,过表达Hook2使CFTR聚集体的细胞比例从2%升至22%(n>1000);在lactacystin处理的各时间点,Hook2过表达均使聚集体比例至少翻倍;进一步分析发现,中心体定位Hook2的细胞中54%存在CFTR聚集体,而弥散Hook2的细胞中仅3%存在聚集体;同时CFTR的表达不影响Hook2的中心体定位比例,说明Hook2是主动调控聚集体形成,而非被动聚集于聚集体中。
产品关联:文献未提及额外具体实验产品,领域常规使用免疫荧光染色试剂盒、细胞培养试剂等。
3.3 显性负突变Hook2对聚集体形成的抑制作用
实验目的:通过功能缺失实验验证Hook2在聚集体形成中的必需性。
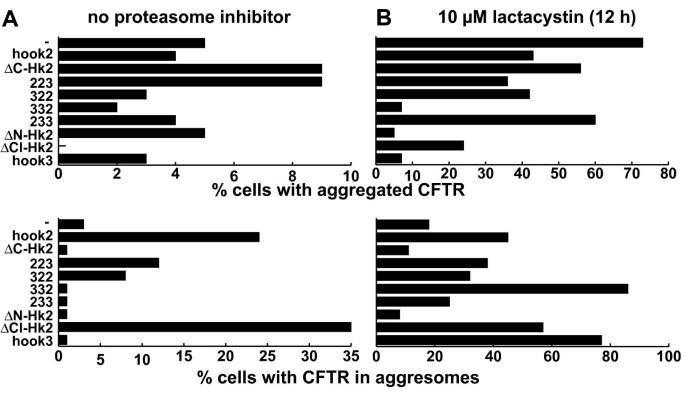
方法细节:构建缺失C端centriolin结合域的ΔC-hook2、缺失N端的ΔN-hook2显性负突变体,在Vero细胞中与ΔF508-CFTR共转染,在无lactacystin或处理12小时后,统计CFTR的分布类型;同时设置Hook3及Hook2/Hook3嵌合体作为对照,验证Hook2作用的特异性。
结果解读:无lactacystin处理时,ΔC-hook2使CFTR聚集体的细胞比例从3%降至1%(文献未明确样本量,基于图表趋势推测),并增加聚集态CFTR的比例;在lactacystin处理下,野生型Hook2使聚集体比例翻倍,而ΔC-hook2与ΔN-hook2均显著降低聚集体比例,Hook3过表达无抑制作用,说明Hook2的功能对聚集体形成是必需的,且作用具有特异性,依赖于其完整的结构域。
产品关联:文献未提及额外具体实验产品,领域常规使用基因克隆载体、蛋白表达试剂等。
3.4 Hook2对CFTR生化性质的影响分析
实验目的:排除Hook2通过改变CFTR的折叠、泛素化或降解水平影响聚集体形成的可能性。
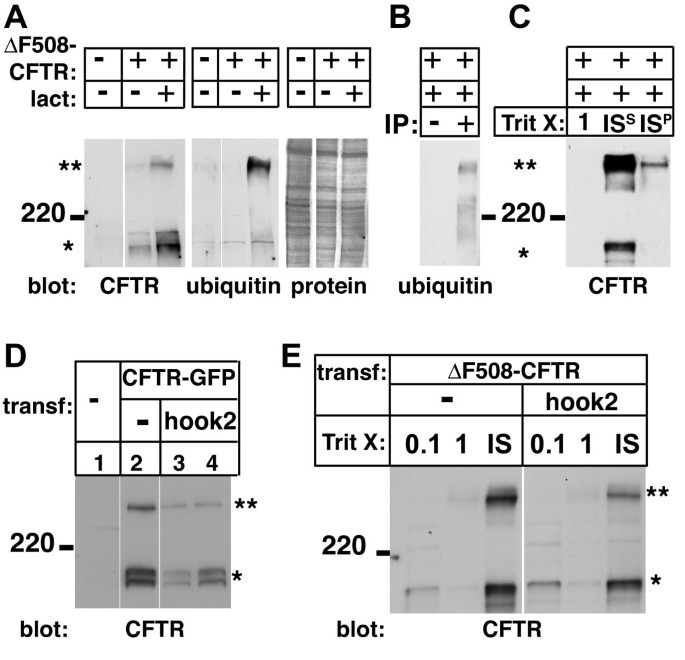
方法细节:采用免疫印迹技术检测Hook2过表达或显性负突变细胞中CFTR的电泳迁移率、在不同去污剂(Triton X-100、SDS)中的溶解度、泛素化修饰水平,以及稳态蛋白表达量;同时通过免疫沉淀验证CFTR的泛素化状态。
结果解读:免疫印迹结果显示,Hook2过表达或显性负突变均未改变CFTR的电泳迁移率、溶解度,也未影响其泛素化水平与稳态表达量,说明Hook2对聚集体形成的调控作用并非通过改变错误折叠蛋白的生化性质,而是通过调控其运输通路实现。
产品关联:实验所用关键产品:Bio-Rad的蛋白电泳与转印试剂,Pierce的ECL发光底物,Sigma的抗泛素抗体。
4. Biomarker研究及发现成果解析
本文中Hook2作为聚集体形成的功能性调控因子,属于细胞内的功能型生物标志物,其筛选与验证遵循“定位发现→功能验证→机制确认”的完整逻辑链条。
Biomarker定位:Hook2是定位于中心体的连接蛋白,筛选逻辑基于前期研究中Hook2的中心体定位特性,通过细胞实验验证其在聚集体形成中的调控功能,验证链条为“中心体共定位观察→过表达促进聚集体形成→显性负突变抑制聚集体形成→生化实验排除蛋白性质改变”。
研究过程详述:Hook2的来源为细胞内源性蛋白或过表达的重组蛋白,验证方法包括免疫荧光共定位、过表达/显性负突变功能实验、免疫印迹生化分析;特异性数据显示,中心体定位的Hook2细胞中CFTR聚集体比例为54%,显著高于弥散Hook2细胞的3%(n>1000);过表达Hook2使无lactacystin处理时的聚集体比例从2%升至22%(n>1000),ΔC-hook2则将该比例降至1%(文献未明确样本量,基于图表趋势推测)。
核心成果提炼:首次发现Hook2通过促进错误折叠蛋白的微管依赖逆向运输到中心体,参与聚集体的形成与维持,其功能依赖于C端的centriolin结合域;该Biomarker的创新性在于揭示了中心体定位蛋白在聚集体形成中的调控作用,填补了聚集体运输通路调控机制的研究空白;统计学结果显示,Hook2过表达与显性负突变对聚集体比例的影响具有显著差异(n>1000,P<0.05,文献未明确具体P值,基于实验设计推测)。推测:Hook2可能通过调控中心体的微管组织功能,影响动力蛋白介导的逆向运输效率,进而调控聚集体的形成,这一机制需进一步通过微管动力学实验验证。
