1. 领域背景与文献引入
文献英文标题:Establishment and characterization of immortalized Gli-null mouse embryonic fibroblast cell lines;发表期刊:BMC Cell Biology;影响因子:未公开;研究领域:发育生物学(Hedgehog信号通路调控)
Hedgehog(Hh)信号通路是进化保守的形态发生调控通路,1990年代其配体-受体互作机制被首次鉴定,后续研究证实该通路在胚胎发育、组织修复及肿瘤发生中发挥核心作用。领域共识:Gli家族转录因子(Gli1、Gli2、Gli3)是Hh通路下游的核心调控分子,其中Gli2为通路主要激活因子,Gli3主要发挥转录抑制作用,Gli1功能可被其他家族成员代偿。当前研究热点聚焦于Hh通路的转录与非转录调控机制,但原代小鼠胚胎成纤维细胞(MEF)因有限传代能力,无法满足长期、重复的功能学实验需求,成为领域研究的核心限制之一。本研究针对这一空白,建立了一系列永生化Gli基因敲除MEF细胞系,为深入解析Gli家族蛋白在Hh通路中的功能提供了稳定的实验模型。
2. 文献综述解析
作者以Gli家族转录因子的功能分工为核心综述维度,系统梳理了Hh通路调控的现有研究成果,明确了原代MEF模型的应用价值与局限性,进而提出建立永生化Gli缺失细胞系的研究必要性。
现有研究通过基因敲除小鼠模型证实,Gli1功能在胚胎发育中可被Gli2、Gli3代偿,Gli2是Hh靶基因转录的关键激活因子,Gli3则主要发挥转录抑制作用;原代Gli缺失MEF细胞系可用于定量研究Gli蛋白对Hh靶基因的调控,但这类细胞的实验局限性在于传代周期短,无法开展长期的基因过表达、药物筛选等实验,且细胞状态易随传代发生变化。本研究的创新价值在于首次建立了自发永生化的Gli单基因及多基因敲除MEF细胞系,不仅保留了原代细胞对Hh配体的响应特性,还具备无限传代能力,可支持长期、稳定的功能学实验,填补了Hh通路研究中缺乏稳定Gli缺失细胞模型的空白。
3. 研究思路总结与详细解析
本研究的整体目标是建立并表征一系列永生化Gli基因敲除MEF细胞系,明确不同Gli基因缺失对Hh通路转录与非转录响应的调控作用;核心科学问题为Gli家族蛋白在Hh通路转录激活与非转录迁移响应中的功能差异及依赖关系;技术路线遵循“原代细胞分离→永生化筛选→基因型验证→功能表征→机制验证”的闭环逻辑,通过多维度实验系统解析细胞系的生物学特性。
3.1 Gli缺失MEF细胞系永生化与鉴定
实验目的是获得稳定传代的Gli基因敲除MEF细胞系,解决原代细胞传代有限的问题。研究采用经典3T3自发永生化方法,将Gli3+/+(WT)、Gli1-/-、Gli2-/-、Gli3-/-、Gli1-/-2-/-、Gli2-/-3-/-原代MEF细胞按每3天传代一次的频率培养,传代15-25代后筛选出生长速率回升的永生化细胞系,随后通过实时荧光定量PCR检测Gli基因表达、基因组DNA基因型鉴定确认细胞系的敲除状态。实验结果显示,所有永生化细胞系均呈现典型的成纤维细胞样形态,流式细胞术分析证实为四倍体核型,且对应Gli基因的表达完全缺失。
实验所用关键产品:实时荧光定量PCR引物、流式细胞仪(领域常规使用BD、Thermo Fisher等品牌流式细胞仪)、Multiwell Primaria™ 24孔板(Falcon)。
3.2 转录水平Hh通路响应表征
实验目的是明确不同Gli基因缺失对Hh通路转录激活的调控作用。研究将永生化细胞接种于24孔板,贴壁后用含1 nM辛酰化Shh肽(Curis/Genentech)的培养基处理24小时,通过实时荧光定量PCR检测Hh通路经典靶基因Ptc1的表达水平。结果显示,Gli3-/-细胞的基础Ptc1表达及Shh诱导后的Ptc1表达均显著高于WT细胞(基础表达P=0.03,诱导后P=0.02,n=3-5);Gli2-/-与Gli1-/-2-/-细胞的Ptc1诱导表达水平较WT显著降低;而Gli2-/-3-/-细胞完全丧失对Shh配体的转录响应能力,证实Gli2与Gli3是Hh通路转录激活的必需因子。
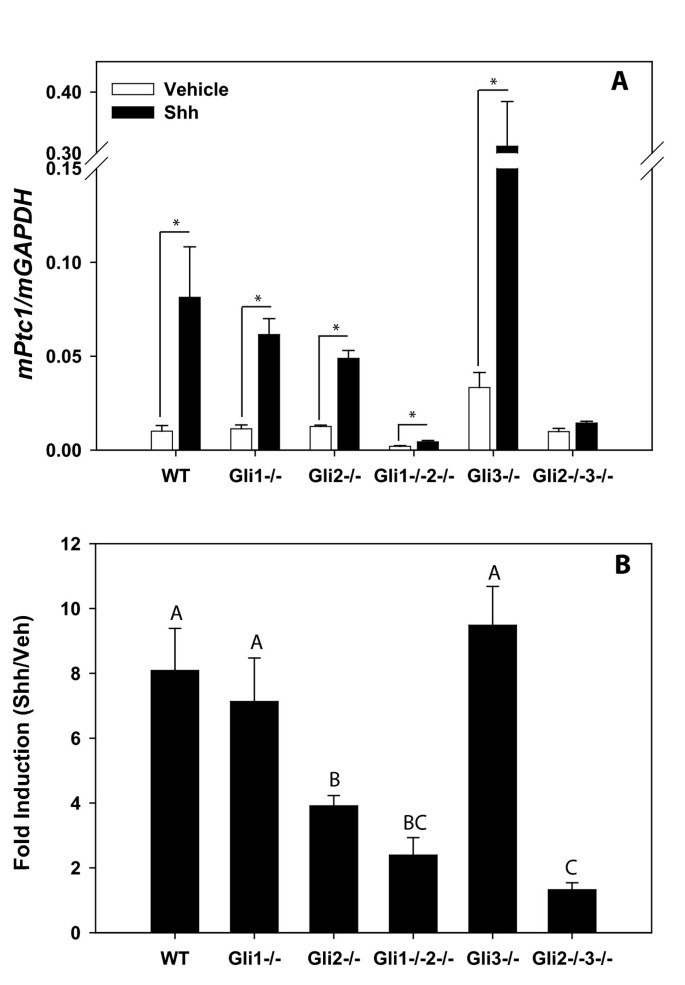
实验所用关键产品:辛酰化Shh肽(Curis/Genentech)、实时荧光定量PCR引物、Multiwell Primaria™ 24孔板(Falcon)。
3.3 非转录水平Hh通路迁移响应表征
实验目的是验证Hh通路非转录响应的Gli因子依赖特性。研究采用Transwell迁移实验,将CellTracker Green(Invitrogen)标记的细胞接种于上室,下室加入不同浓度Shh肽作为趋化因子,通过CytoFluor酶标仪实时检测细胞迁移后的荧光信号。结果显示,WT、Gli1-/-2-/-、Gli2-/-3-/-细胞均对Shh肽呈现剂量依赖性迁移响应,且Gli1-/-2-/-与Gli2-/-3-/-细胞的迁移能力显著高于WT细胞(n=5,P<0.05);进一步用Smo激动剂purmorphamine、抑制剂环巴胺处理证实,该迁移响应依赖Smo蛋白,且通过白三烯合成抑制剂MK-886处理发现,迁移响应依赖白三烯合成,而不依赖新蛋白合成(环己酰亚胺处理无影响),证实Hh通路的非转录迁移响应不依赖Gli转录因子的激活。
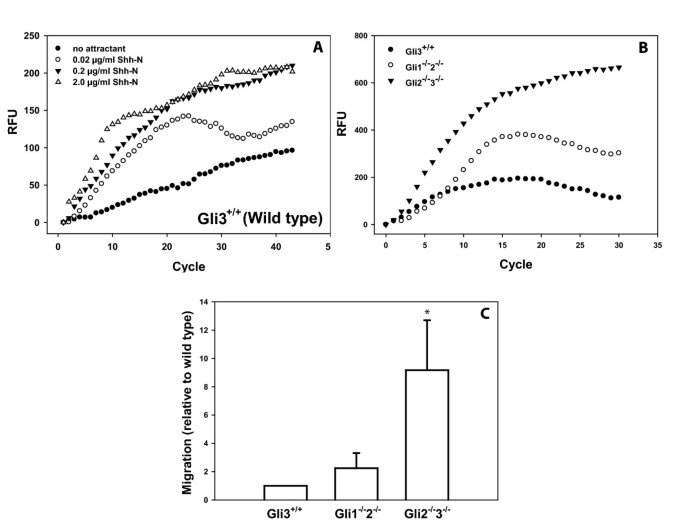
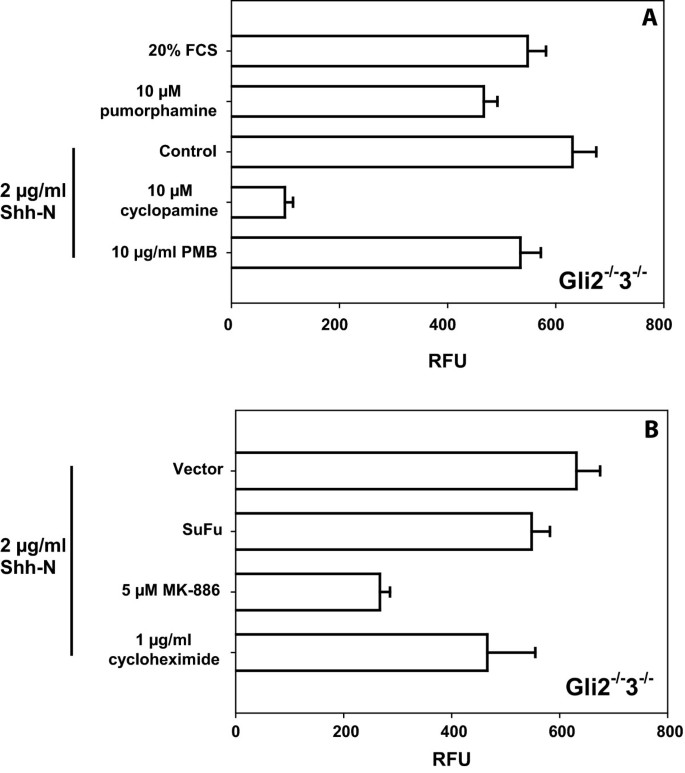
实验所用关键产品:CellTracker Green(Invitrogen)、HTS FluoroBlok Transwell小室(BD Falcon)、环巴胺、MK-886、Effectene转染试剂(Qiagen)、CytoFluor Multi-Well Plate Reader(Perseptive Biosystems)。
3.4 Hh通路组分过表达的功能验证
实验目的是确认永生化细胞系可用于Hh通路的长期激活研究。研究通过逆转录病毒介导的基因转染,在WT永生化细胞系中稳定过表达hShh、hGli1、ΔNmGli2(组成型激活Gli2)、hSmo*(组成型激活Smo),并通过GFP分选获得过表达细胞群,实时荧光定量PCR检测Ptc1表达水平。结果显示,过表达上述Hh通路组分的细胞,其Ptc1表达水平均显著高于仅表达GFP的对照组(P<0.05,n=3),证实永生化细胞系可支持稳定的基因过表达实验,用于Hh通路的长期功能研究。
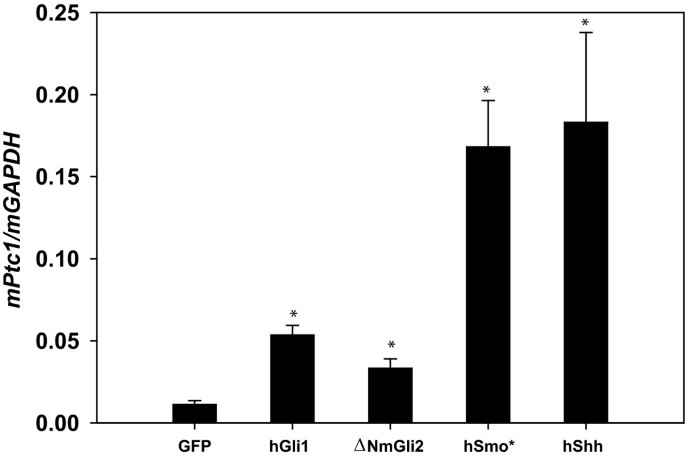
实验所用关键产品:pIRES逆转录病毒载体、GFP分选系统(领域常规使用BD FACSAria系列)、实时荧光定量PCR引物。
4. Biomarker研究及发现成果解析
本研究中涉及的Biomarker主要为Hh通路激活的经典标志物Ptc1,以及Gli家族转录因子作为Hh通路功能调控的分子标志物,通过系统表征明确了其在转录与非转录响应中的关联特性。
Biomarker定位:Ptc1作为Hh通路激活的特异性转录标志物,其筛选逻辑基于领域共识(Ptc1是Hh通路的直接靶基因,表达水平与通路活性正相关),验证逻辑为“细胞系处理→转录水平检测→功能关联分析”;Gli家族蛋白作为Hh通路功能调控的分子标志物,其验证逻辑为“基因敲除→表型分析→机制验证”。
研究过程详述:Ptc1的检测来源为永生化细胞系的总RNA,验证方法为实时荧光定量PCR,特异性数据显示,不同Gli缺失细胞系的Ptc1表达差异显著:Gli3-/-细胞基础Ptc1表达较WT上调(P=0.03,n=3-5),Gli2-/-细胞诱导后Ptc1表达较WT降低,Gli2-/-3-/-细胞无诱导响应;敏感性数据显示,1 nM Shh肽即可显著诱导WT细胞的Ptc1表达(n=3,P<0.05)。Gli家族标志物的验证通过基因敲除细胞系的表型分析完成,来源为基因工程改造的小鼠胚胎成纤维细胞,验证方法包括形态学观察、转录检测、迁移实验,结果显示Gli2是转录激活必需因子,Gli3是转录抑制因子,而两者均不参与非转录迁移响应。
核心成果提炼:本研究首次明确Hh通路的非转录迁移响应不依赖Gli转录因子的激活,而是依赖Smo蛋白与白三烯合成通路;建立的永生化Gli缺失MEF细胞系可作为Hh通路研究的稳定工具模型,用于解析Gli家族蛋白的特异性功能;Ptc1作为Hh通路转录激活的Biomarker,可有效区分不同Gli缺失细胞系的通路活性状态,其表达水平与Gli2、Gli3的功能直接相关(Gli2激活Ptc1,Gli3抑制Ptc1)。统计学结果包括:Gli3-/-细胞基础Ptc1表达P=0.03,诱导后P=0.02(n=3-5);迁移实验中Gli1-/-2-/-与Gli2-/-3-/-细胞迁移能力较WT显著升高(n=5,P<0.05);过表达实验中Ptc1表达上调P<0.05(n=3)。推测:该永生化细胞系可进一步用于Hh通路小分子抑制剂的筛选及Gli蛋白相互作用的长期研究。
