1. 领域背景与文献引入
文献英文标题:Cell specific apoptosis by RLX is mediated by NFκB in human colon carcinoma HCT-116 cells;发表期刊:BMC Cell Biology;影响因子:未公开;研究领域:结直肠癌肿瘤药理学
结直肠癌(CRC)是全球高发的恶性肿瘤,2011年统计数据显示年发病量达120万例,死亡超60万例,在男性中为第三大常见诊断肿瘤、第四大死亡原因,女性中为第二大常见诊断肿瘤、第三大死亡原因。领域共识:CRC的发生发展是多因素调控过程,细胞增殖、炎症、迁移及血管生成等均参与其中,传统化疗方案如FOLFOX、XELOX等虽为标准治疗手段,但存在疗效有限、毒副反应显著的核心问题,亟需开发新型低毒高效的治疗药物。NFκB通路作为炎症与癌变的关键枢纽,在CRC细胞中持续激活,通过上调抗凋亡蛋白促进肿瘤细胞存活与增殖,是CRC治疗的潜在靶点。天然产物Adhatoda vasica中的vasicinone具有支气管扩张、抗炎等活性,其类似物RLX的药理活性已有部分报道,但抗癌作用尚未被探索,因此本研究旨在填补这一空白,明确RLX对CRC的抗癌活性及分子机制。
2. 文献综述解析
作者从传统化疗方案局限、NFκB通路调控机制、天然产物类似物研究三个维度梳理领域现状,系统整合现有研究的核心结论与局限性。现有研究显示,传统CRC化疗方案如FOLFOX、IFL等虽能在一定程度上抑制肿瘤进展,但疗效已达瓶颈,且伴随严重的胃肠道毒性、神经毒性等不良反应;NFκB通路在CRC中调控细胞存活、增殖、迁移等多个生物学过程,针对该通路的抑制剂如BEZ-235已进入临床试验,但仍需更多结构新颖的候选药物;天然产物来源的vasicinone具有一定抗癌活性,但其类似物的抗癌潜力尚未被系统挖掘。本研究的创新价值在于首次证实RLX对CRC细胞的特异性抑制作用,明确其通过下调NFκB、上调caspase-3介导凋亡的分子机制,为CRC治疗提供新的天然产物候选药物,弥补了天然产物类似物在CRC抗癌研究中的空白。
3. 研究思路总结与详细解析
本研究整体遵循“药物活性筛选→分子机制探究→功能验证→形态学确认”的闭环逻辑链条,以RLX对结直肠癌HCT-116细胞的抗癌活性及机制为核心科学问题,通过多组实验验证RLX诱导细胞凋亡的作用及通路靶点,为RLX的临床转化提供实验依据。
3.1 癌细胞增殖抑制活性筛选
实验目的:筛选RLX对多种癌细胞及正常细胞的增殖抑制活性,确定其最优作用细胞系与半数抑制浓度(IC₅₀)值。方法细节:采用MTT法,对白血病(THP-1)、前列腺癌(PC-3)、乳腺癌(MCF-7、T47D)、胰腺癌(MIAPaca2)、结直肠癌(HCT-116、Caco-2)及正常上皮细胞(fR-2)分别给予5、10、20、30、50μM的RLX,同时设置BEZ-235(10nM)与5-氟尿嘧啶(20μM)为阳性对照,处理48h后检测细胞存活率。结果解读:RLX对多种癌细胞呈浓度依赖性增殖抑制,其中对HCT-116细胞的抑制作用最强,在50μM浓度下抑制率达96%,IC₅₀值为12μM(文献未明确样本量,基于图表趋势推测);对正常上皮细胞fR-2的抑制作用极弱,仅在50μM浓度下抑制率为23%,显示出良好的肿瘤细胞特异性。
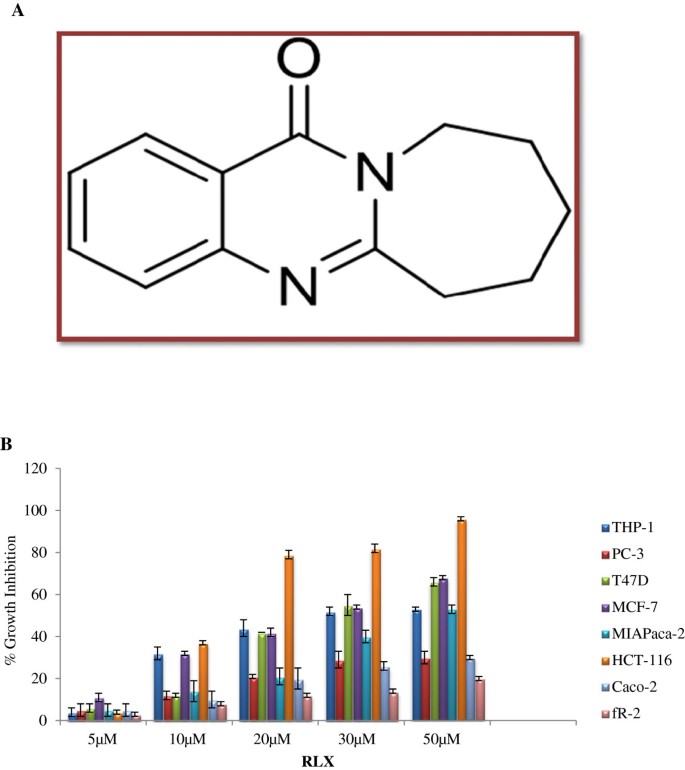
实验所用关键产品:Sigma的MTT染料、Bio-Rad的酶标仪、Iwaki的96孔板等。
3.2 NFκB与caspase-3蛋白表达检测
实验目的:探究RLX诱导HCT-116细胞凋亡的分子机制,检测NFκB(p65)与caspase-3的蛋白表达变化。方法细节:将HCT-116细胞分别用0、10、20、30μM的RLX及10nM的BEZ-235处理48h,提取全细胞蛋白后采用蛋白质免疫印迹(Western Blot,WB)检测NFκB(p65)与caspase-3的表达水平,通过灰度值统计分析表达变化倍数。结果解读:RLX处理后,NFκB(p65)的表达水平从1倍下调至0.1倍,caspase-3的表达水平从1倍上调至2倍,且在20、30μM浓度下差异具有统计学显著性(*p ≤ 0.001,p ≤ 0.01,文献未明确样本量,基于图表趋势推测),提示RLX通过调控NFκB与caspase-3的表达介导细胞凋亡。
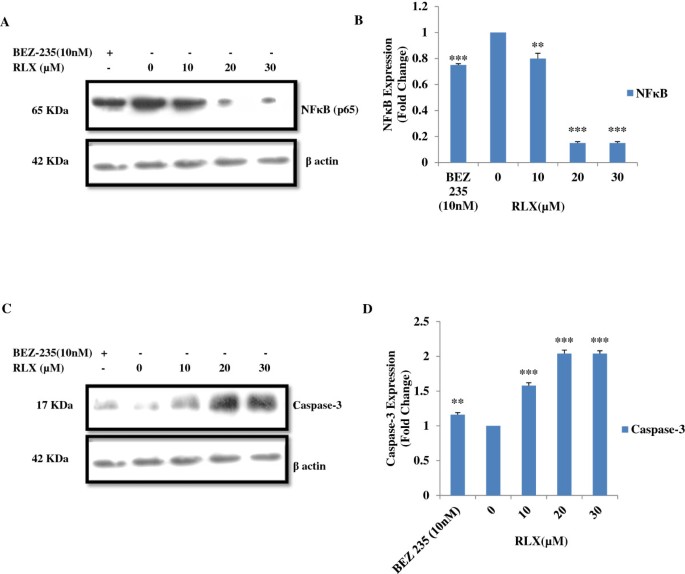
实验所用关键产品:Millipore的NFκB(p65)、caspase-3抗体及化学发光WB试剂盒,Sigma的RIPA裂解液等。
3.3 细胞迁移能力检测
实验目的:验证RLX对HCT-116细胞迁移的抑制作用,评估其抗转移潜力。方法细节:采用划痕愈合实验,将HCT-116细胞培养至汇合后划痕,分别给予0、10、20、30μM的RLX及10nM的BEZ-235处理,48h后通过Image J软件测量划痕愈合面积,统计迁移抑制率。结果解读:RLX对HCT-116细胞的迁移呈浓度依赖性抑制,30μM浓度下的迁移抑制率显著高于对照组与BEZ-235组(*p ≤ 0.001,p ≤ 0.01,n=3),提示RLX具有潜在的抗转移活性。
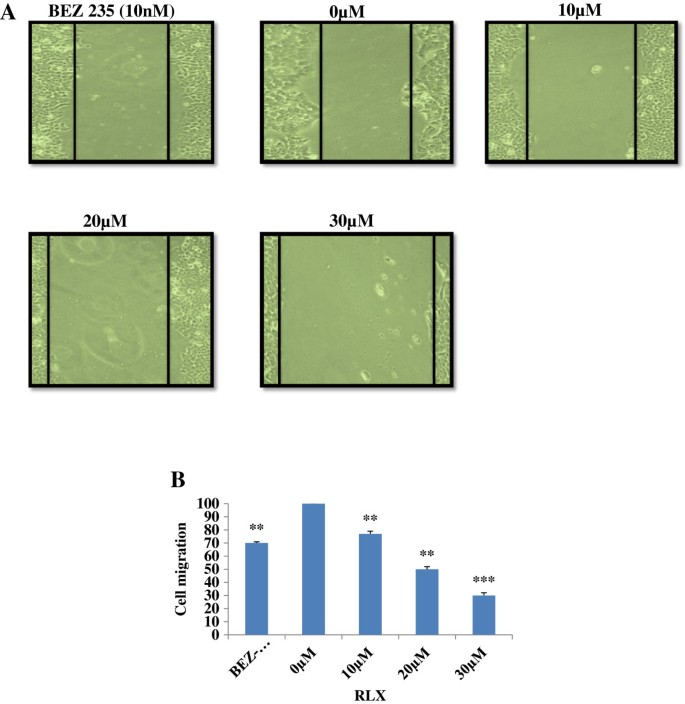
实验所用关键产品:Image J软件,Iwaki的6孔板等。
3.4 凋亡形态学验证
实验目的:通过扫描电子显微镜(SEM)与荧光显微镜观察RLX处理后HCT-116细胞的形态学变化,确认细胞凋亡特征。方法细节:将HCT-116细胞分别用0、10、20、30μM的RLX及10nM的BEZ-235处理24h(SEM)或48h(荧光染色),SEM观察细胞表面微绒毛变化,DAPI染色后荧光显微镜观察细胞核形态。结果解读:SEM结果显示,RLX处理后HCT-116细胞出现微绒毛丢失、细胞膜起泡、细胞皱缩等早期凋亡形态,30μM浓度下变化最为显著;DAPI染色显示细胞核固缩、染色质凝聚,进一步证实RLX诱导细胞凋亡的作用。
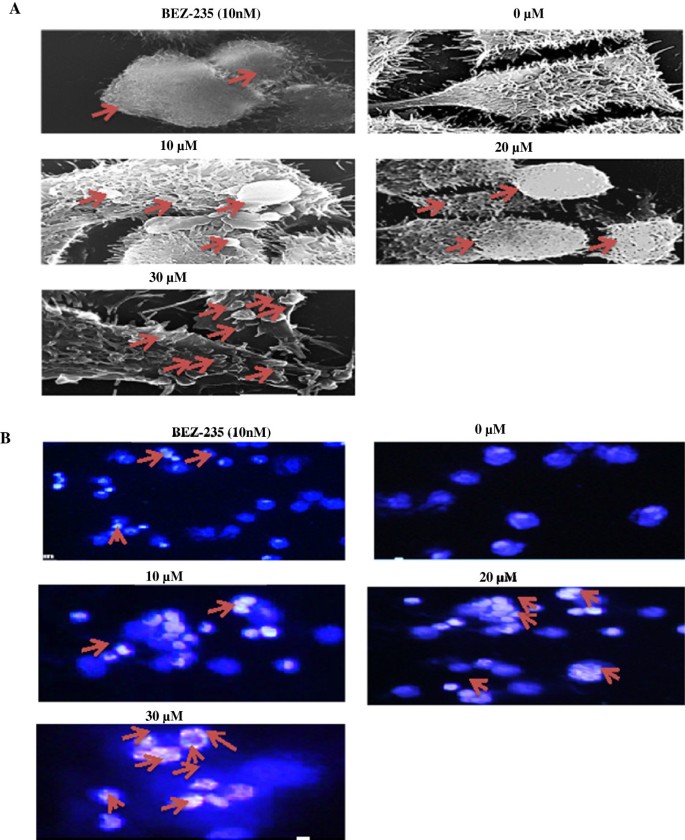
实验所用关键产品:Sigma的DAPI染色剂,JEOL的扫描电子显微镜等。
4. Biomarker研究及发现成果解析
本研究中涉及的Biomarker为NFκB(p65)与caspase-3,二者作为结直肠癌凋亡调控的关键分子,其表达变化直接反映RLX的抗癌作用机制。Biomarker定位:NFκB(p65)是结直肠癌中促存活的核心分子,caspase-3是凋亡执行的关键蛋白酶,筛选逻辑基于NFκB通路在CRC中的致癌作用,通过检测二者的表达变化验证RLX的作用靶点。研究过程详述:Biomarker来源于HCT-116细胞的全蛋白提取物,采用蛋白质免疫印迹法进行验证,RLX处理后NFκB(p65)表达水平下调至0.1倍(20、30μM浓度下p ≤ 0.001,*p ≤ 0.01),caspase-3表达水平上调至2倍(10、20、30μM浓度下p ≤ 0.001,*p ≤ 0.01);同时通过形态学实验验证凋亡表型,进一步确认Biomarker与凋亡的关联。核心成果提炼:RLX通过下调NFκB(p65)、上调caspase-3的表达,特异性诱导HCT-116细胞凋亡,其IC₅₀值为12μM,对正常细胞毒性极低;该发现首次证实RLX的结直肠癌抗癌活性,明确其分子通路,为CRC治疗提供新的天然产物候选药物,具有潜在的临床转化价值。
