1. 领域背景与文献引入
文献英文标题:Protein kinase Cζ regulates phospholipase D activity in rat-1 fibroblasts expressing the α₁A adrenergic receptor;发表期刊:BMC Cell Biology;影响因子:未公开;研究领域:细胞信号转导(α₁A肾上腺素能受体介导的蛋白激酶与磷脂酶调控机制)。
领域共识:磷脂酶D(PLD)是广泛存在于哺乳动物细胞中的信号分子,通过水解磷脂酰胆碱生成磷脂酸和胆碱,参与信号转导、蛋白转运、细胞增殖、分化及凋亡等过程,其激活受Arf、Rho家族小G蛋白、蛋白激酶C(PKC)及磷脂酰肌醇4,5-二磷酸调控。PKC家族分为经典型(依赖钙和二酰甘油)、新型(依赖二酰甘油)和非典型(不依赖钙和二酰甘油)三类,其中非典型PKCζ是多种细胞有丝分裂信号的关键介导分子。当前研究热点聚焦于不同细胞类型中PLD与PKC亚型的特异性调控关系,但存在争议:经典PKC在体外可激活PLD1,但体内是否依赖其催化活性尚不明确;部分研究显示受体介导的PLD激活不依赖经典PKC,而非典型PKCζ在血管平滑肌细胞中被去甲肾上腺素激活后可促进PLD2活性,但在表达α₁A肾上腺素能受体的rat-1成纤维细胞中,去甲肾上腺素无法激活ERK通路(通常由PKCζ介导),提示该细胞模型中PKCζ的功能可能存在特殊性。现有研究未明确α₁A肾上腺素能受体激活时PKCζ对PLD的调控作用,成为领域内的核心空白。本文旨在探究这一调控关系及机制,为不同细胞模型中PLD的调控机制补充新的实验依据。
2. 文献综述解析
作者以PKC亚型分类(经典型、新型、非典型)及PLD调控的细胞特异性为维度,对现有研究进行系统评述,明确不同PKC亚型在PLD调控中的作用差异及争议点,进而提出本研究的核心科学问题。
现有研究结论显示,经典PKC亚型在体外可通过非催化机制激活PLD1,但体内完整细胞中PLD激活是否依赖经典PKC的催化活性仍不明确;新型PKC对PLD的调控作用存在细胞模型特异性,部分研究显示其不参与受体介导的PLD激活;非典型PKCζ在血管平滑肌细胞中被去甲肾上腺素激活后,可通过催化活性促进PLD2激活并介导细胞增殖,但在表达α₁A肾上腺素能受体的rat-1成纤维细胞中,去甲肾上腺素无法激活ERK通路,提示该细胞中PKCζ的功能与血管平滑肌细胞存在差异。现有研究的技术方法优势在于通过细胞转染、激酶活性检测等手段明确了部分PKC亚型与PLD的调控关系,但局限性在于缺乏对α₁A肾上腺素能受体激活时非典型PKCζ调控PLD的研究,且不同细胞模型的结果无法形成统一机制,难以解释细胞特异性的调控差异。本文的创新价值在于首次发现α₁A肾上腺素能受体激活会抑制PKCζ活性,进而介导PLD激活,且这种调控不依赖PKCζ的催化活性,补充了非典型PKCζ在不同细胞模型中对PLD的双向调控机制,为细胞特异性信号转导通路的研究提供了新的实验证据。
3. 研究思路总结与详细解析
本研究的整体研究目标是明确表达α₁A肾上腺素能受体的rat-1成纤维细胞中,非典型PKCζ对PLD活性的调控作用及分子机制;核心科学问题为PKCζ如何参与α₁A受体介导的PLD激活,且该调控是否依赖PKCζ的催化活性;技术路线遵循“现象观察→机制假设→实验验证→结论推导”的闭环逻辑:首先验证去氧肾上腺素(PHE)对PLD和PKCζ活性的影响,然后通过转染PKCζ突变体及特异性抑制剂验证二者的调控关系,最后探讨调控是否依赖PKCζ的催化活性及假底物结构域的作用。
3.1 PLD活性的浓度依赖性激活验证
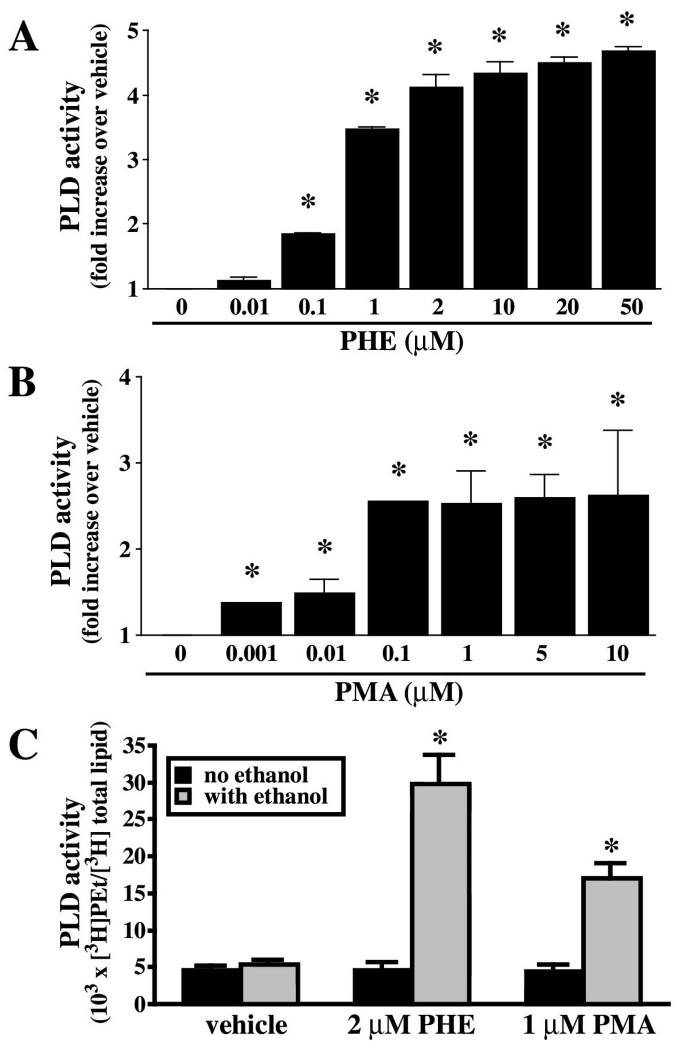
实验目的为确定PHE和佛波酯(PMA)对rat-1成纤维细胞PLD活性的激活效果,筛选后续实验的最优刺激浓度。实验方法为将稳定转染α₁A受体的rat-1成纤维细胞用[³H]油酸标记过夜,预处理乙醇后,加入不同浓度的PHE或PMA处理15分钟,通过薄层层析法检测磷脂酰乙醇(PEt)的生成量,以[³H]PEt与[³H]总脂质的比值反映PLD活性。实验结果显示,2μM PHE可使PLD活性升高至基础水平的4-5倍(n=3,P<0.05),1μM PMA可使PLD活性升高至基础水平的2.5倍;无乙醇条件下检测到的非PLD产物需进行校正,校正后PHE对PLD的激活倍数提升至30倍。
实验所用关键产品:Sigma的去氧肾上腺素(PHE)、Calbiochem的佛波酯(PMA)、American Radiolabeled Chemicals的[³H]油酸。
3.2 PKCζ的亚细胞定位与活性变化检测
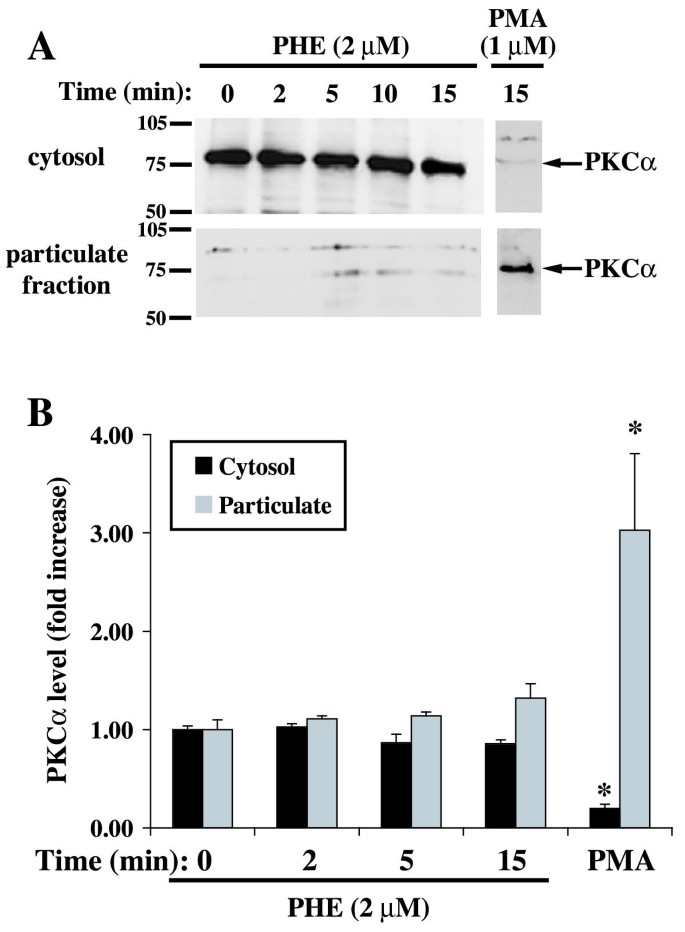
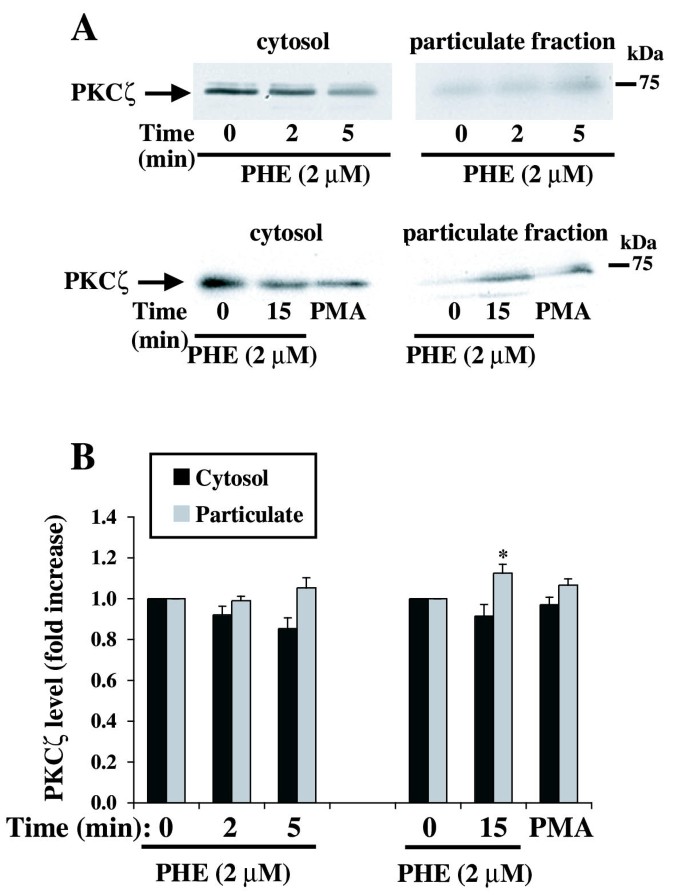
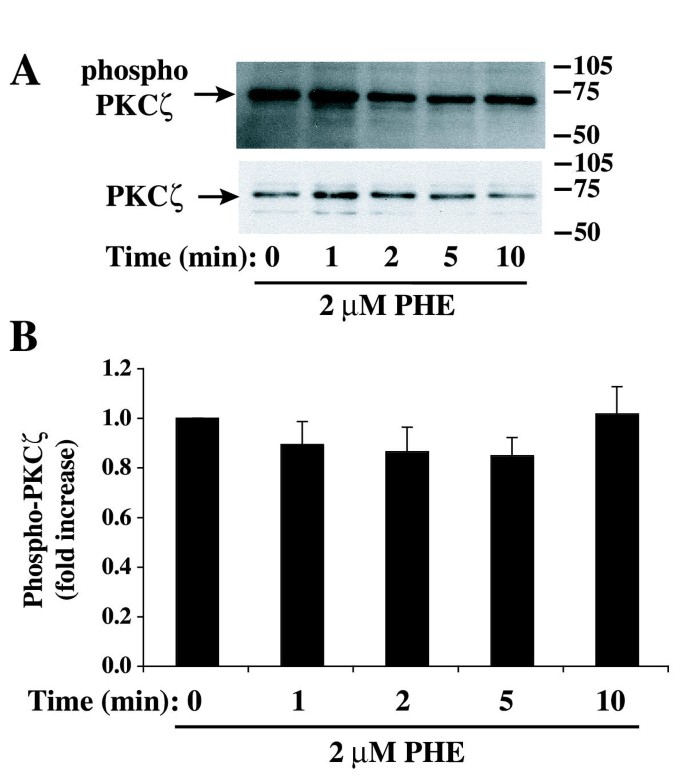
实验目的为明确PHE处理对PKCζ亚细胞定位、磷酸化水平及激酶活性的影响,初步探索二者的调控关系。实验方法为用PHE处理细胞不同时间后,通过细胞组分分离结合免疫印迹检测PKCα和PKCζ在胞质与颗粒组分中的分布;用磷酸化特异性抗体检测PKCζ的Thr410磷酸化水平(该位点磷酸化是PKCζ激活的标志);通过免疫沉淀法富集PKCζ,检测其激酶活性。实验结果显示,PHE处理后PKCα的亚细胞定位无显著变化,而PKCζ在15分钟时向颗粒组分轻微转位(n=5,P<0.05);PKCζ的Thr410磷酸化水平在PHE处理前后无显著差异;PKCζ的激酶活性在PHE处理2、5分钟时显著降低,10-15分钟回到亚基础水平(n=4,P<0.05);PKCζ特异性抑制剂(PSζ)可降低基础PKCζ活性,并阻断PHE诱导的PKCζ活性降低(n=4,P<0.01)。
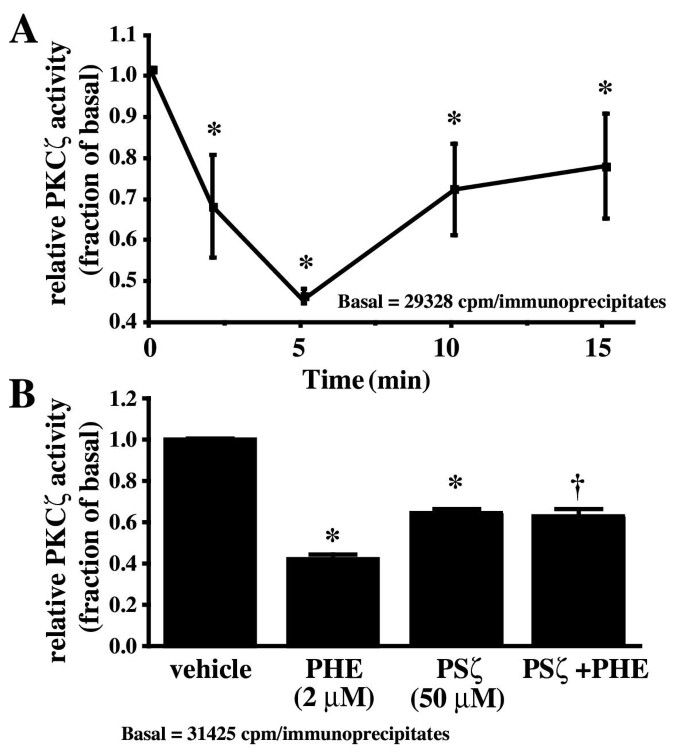
实验所用关键产品:Santa-Cruz Biotechnology的PKCα、PKCζ抗体,Cell Signaling Technology的磷酸化PKCζ/λ抗体,Biomol的PKCζ肽抑制剂。
3.3 PKCζ突变体对PLD活性的调控验证
实验目的为验证PKCζ的催化活性是否参与PLD的激活调控。实验方法为瞬时转染野生型、激酶失活型(T410A,无法磷酸化激活)、组成型激活型(T410E,模拟持续激活)PKCζ至rat-1成纤维细胞,转染48小时后检测PLD活性;同时检测p38 MAPK的磷酸化水平,验证转染对α₁A受体信号通路的影响。实验结果显示,组成型激活型PKCζ对PHE诱导的PLD活性无显著影响,而激酶失活型PKCζ可显著增强PHE诱导的PLD活性(n=3,P<0.01);不同PKCζ突变体转染后,p38 MAPK的磷酸化水平无显著变化,说明转染未影响α₁A受体的信号通路功能。
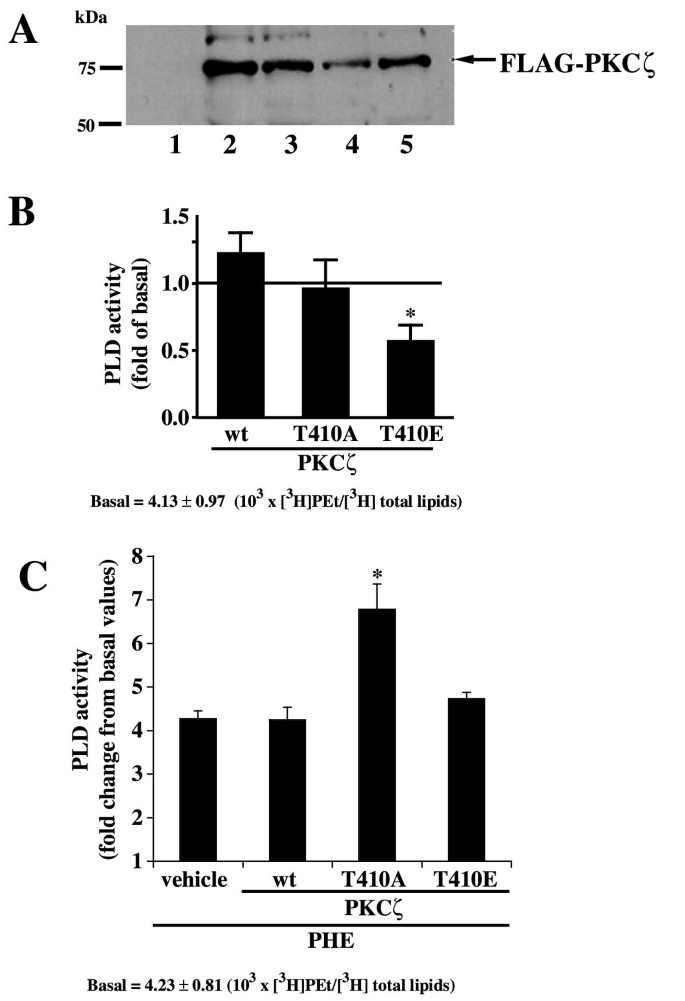
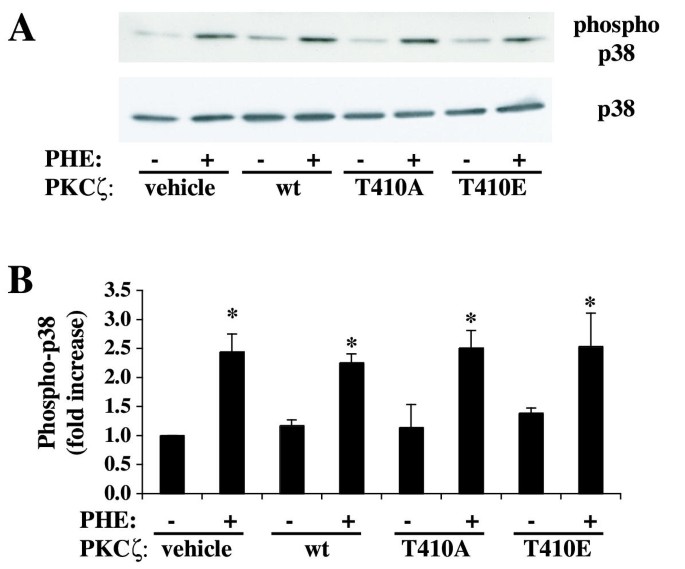
实验所用关键产品:Invitrogen的Lipofectamine PLUS转染试剂、Sigma的FLAG抗体,Santa-Cruz Biotechnology的p38抗体,Cell Signaling Technology的磷酸化p38抗体。
3.4 PKCζ假底物结构域对PLD活性的调控作用
实验目的为明确PKCζ的假底物结构域是否参与PLD的激活调控。实验方法为用PKCζ假底物抑制剂(PSζ)和经典PKC抑制剂预处理细胞后,检测PHE诱导的PLD活性。实验结果显示,50μM PSζ可完全阻断PHE诱导的PLD激活(n=3,P<0.05),而经典PKC抑制剂对PLD活性无显著影响,提示PKCζ的假底物结构域在PLD激活中发挥特异性作用。
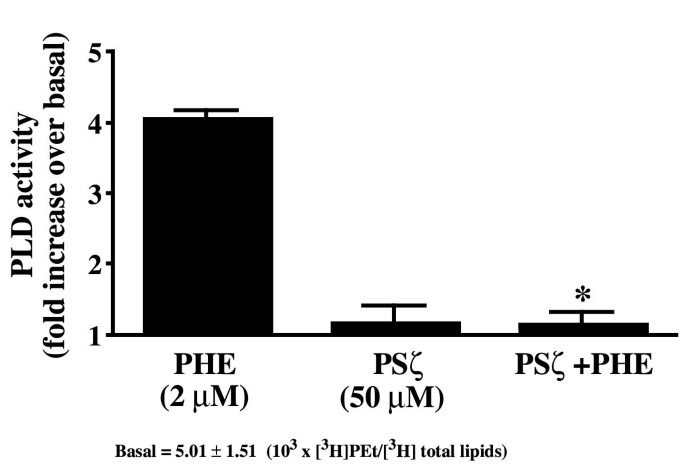
实验所用关键产品:Biomol的PKCζ和PKCα/β肽抑制剂。
4. Biomarker研究及发现成果
本研究中,非典型PKCζ作为α₁A肾上腺素能受体介导PLD激活的关键调控分子,属于功能型生物标志物,其筛选逻辑基于前期研究排除经典和新型PKC的参与后,聚焦非典型PKCζ的调控作用,通过细胞模型验证、突变体转染及特异性抑制剂实验形成完整的验证链条。
PKCζ的筛选与验证过程为:以表达α₁A肾上腺素能受体的rat-1成纤维细胞为研究模型,首先通过免疫印迹和激酶活性检测发现PHE处理后PKCζ活性降低,且与PLD活性升高呈负相关;然后通过转染激酶失活型PKCζ发现其可增强PHE诱导的PLD活性,转染组成型激活型PKCζ无显著影响;最后通过特异性抑制剂实验证实PKCζ的假底物结构域参与PLD激活。验证方法包括免疫印迹检测亚细胞定位与磷酸化水平、免疫沉淀法检测激酶活性、瞬时转染突变体及特异性抑制剂处理,特异性数据显示PKCζ抑制剂可完全阻断PHE诱导的PLD激活,而经典PKC抑制剂无作用,说明PKCζ的调控具有特异性;敏感性数据显示PHE处理2分钟即可显著降低PKCζ活性(n=4,P<0.05),提示其调控具有快速响应性。
核心成果为:首次发现α₁A肾上腺素能受体激活可通过抑制PKCζ活性介导PLD激活,且这种调控不依赖PKCζ的催化活性,而是依赖其假底物结构域;该成果明确了PKCζ在不同细胞模型中的双向调控作用:在血管平滑肌细胞中PKCζ激活促进PLD2活性,而在rat-1成纤维细胞中PKCζ抑制促进PLD活性,这种差异可能与细胞表型或肾上腺素能受体亚型有关;同时,该研究首次报道了受体激活可抑制PKCζ活性的现象,为细胞特异性信号转导通路的研究提供了新的实验依据。统计学结果显示,激酶失活型PKCζ增强PHE诱导的PLD活性(n=3,P<0.01),PKCζ抑制剂阻断PLD激活(n=3,P<0.05),PKCζ活性在PHE处理2、5分钟时显著降低(n=4,P<0.05)。
